Cryptococcus neoformans’ın Lipit Damlacıklarının Boyanmasında Üç
Farklı BODIPY Bileşiğinin Akan Hücre Ölçer için Optimizasyonu
Flow Cytometry Optimization of Three Different BODIPY Molecules for
Staining Lipid Droplets of Cryptococcus neoformans
Çağrı ERGİN1 , Melek PAMUK ALGI2,3 , Ergun METE1 , Mücahit SEÇME4
1Pamukkale Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Denizli, Türkiye.
1Pamukkale University Faculty of Medicine, Department of Medical Microbiology, Denizli, Turkey.
2Aksaray Üniversitesi Fen Edebiyat Fakültesi, Kimya Bölümü, Aksaray.
2Aksaray University Faculty of Science and Letters, Department of Chemistry, Aksaray, Turkey.
3Aksaray Üniversitesi Bilimsel ve Teknolojik Uygulama ve Araştırma Merkezi, Memduh Bilmez BiyoNanoteknoloji Araştırma Laboratuvarı, Aksaray.
3Aksaray University Scientific and Technological Application and Research Center, Memduh Bilmez BioNanotechnology Searching Laboratory, Aksaray, Turkey.
4Pamukkale Üniversitesi Tıp Fakültesi, Tıbbi Biyoloji Anabilim Dalı, Denizli.
4Pamukkale University Faculty of Medicine, Department of Medical Biology, Denizli, Turkey.
Makale Atıfı:Ergin Ç, Pamuk Algı M, Mete E, Seçme M. Cryptococcus neoformans’ın lipit damlacıklarının boyanmasında üç farklı BODIPY bileşiğinin akan hücre ölçer için optimizasyonu. Mikrobiyol Bul 2021;55(4):592-602.
ÖZ
Patojenik Cryptococcus neoformans immün sistemi baskılanmış hastalarda hayatı tehdit eden enfeksiyonlara neden olmaktadır. C.neoformans patogenezinde lipit damlacıklarının rolü hakkında hipotezler bulunsa da, henüz konu hakkında kapsamlı veri bulunmamaktadır. Lipit damlacıkları, mayalarda bulunan dinamik sitoplazmik enerji depolama cisimleridir. Lipit damlacıklarının araştırılmasında sıklıkla diazo boyalar, Nil kırmızısı, LD540 ve boradiazaindasen (BODIPY) bileşikleri kullanılmaktadır. BODIPY (4,4-difloro-4-bora-3a,4a-diaza-s-indacene) boyar maddeler en parlak yeşil ışık yayan floroforlar arasındadır. Bu nötr bileşikler yüksek lipofilikliğe sahiptir; hücre duvar ve membranından kolaylıkla geçerler. Bu çalışmada, C neoformans’ın lipit damlacıkları ile ilgili gelecekteki çalışmalara yönelik olarak üç farklı BODIPY bileşiğini (BODIPY480/525, BODIPY480/530, BODIPY480/535) floresan mikroskopi ve akan hücre ölçer cihazı için optimize edilmesi amaçlanmıştır. Moleküler tanımlaması yapılmış on farklı çevresel C.neoformans izolatı, oleik asit içeren ve içermeyen Sabouraud dekstroz agar besiyerinde üretilmiştir. Paraformaldehit ile fikse edilen C.neoformans lipit damlacıkları için farklı konsantrasyonlarda BODIPY boyama yöntemleri uygulanmıştır. C.neoformans izolatlarının lipit damlacıkları floresans mikroskopi ile görselleştirilmiş ve akan hücre ölçer ile saptanarak değerlendirilmiştir. Akan hücre ölçerde, sitoplazmik bölge kadranında belirlenen lipit damlacıklarının sayılarını değerlendirmek için ileri-saçılım ve yan-saçılım analizi yapılmıştır. Araştırmada kullanılan her üç BODIPY bileşiğinin, C.neoformans’ın lipit damlacıklarını boyaması floresans mikroskobu ile belirgin parlaklık ve zemin ile keskin kontrast oluşturacak şekilde izlenmiştir. Tüm BODIPY bileşikleri bir dakikayı geçen süre içinde parlaklık kaybı olmaksızın floresan mikroskobu ile incelenebilmiştir. 2 µM BODIPY bileşikleri optimal boyar konsantrasyon olarak bulunmuştur. Oda sıcaklığında beş dakika süreyle inkübasyon boyanma için yeterli olmuştur. Her üç bileşiğin, ısı ile inaktive edilmiş C.neoformans izolatlarındaki lipit damlacıklarını boyayabildikleri de gösterilmiştir. BODIPY480/525, BODIPY480/530 ve BODIPY480/535 bileşikleri, C.neoformans’ın patogenezinde rol aldığı öne sürülen lipit damlacıklarının boyanarak floresans mikroskopi ile incelenmiş ve akan hücre ölçer ile analizine uygun olarak değerlendirilmiştir. BODIPY bileşikleri lipit damlacıkları boyamada birbirlerinden farklı özellikler gösterebilir. Bu bileşiklerin farklı maya türlerinde lipit damlacıklarının varlığının gösterilmesi ve patogenez çalışmalarına uygunluğu test edilmelidir.
Anahtar kelimeler: Cryptococcus neoformans; BODIPY; lipit damlacıkları; optimizasyon.
ABSTRACT
The pathogenic Cryptococcus neoformans causes life-threatening disease in immunocompromised patients. Although there are hypotheses about the role of lipid droplets in C.neoformans pathogenesis, there is still not extensively data determined on the subject yet. Lipid droplets are dynamic cytoplasmic energy storage bodies in yeasts. Diazo dyes, Nile red, LD540 and borradiazaindasen (BODIPY) molecules are frequently used in the lipid droplets studies. BODIPY (4,4-difluoro-4-bora-3a,4a-diaza-s-indacene) dyestuffs are among the brightest green light emitting fluorophores. These neutral molecules have high lipophilicity and can easily pass through the cell wall and membrane. In this study, for the future studies on lipid droplets of C.neoformans, we aimed to optimize three different BODIPY (BODIPY480/525, BODIPY480/530, BODIPY480/535) molecules for fluorescence microscopy and flow cytometry system. Ten molecularly confirmed environmental C.neoformans strains were grown on Sabouraud dextrose agar with and without oleic acid. BODIPY staining protocols at different concentrations were used for C.neoformans lipid droplets fixed with paraformaldehyde. The visualization (by fluorescence microscopy) and detection (by flow cytometer) of the lipid droplet structures of C.neoformans strains were evaluated. Forward-scatter and side-scatter analysis were performed to evaluate the number of lipid droplets determined in the cytoplasmic region quadrant in flow cytometry. The staining of the lipid droplets of C.neoformans of all three BODIPY molecules used in the study was observed by fluorescence microscope with creating distinct brightness and sharp contrast with the background. All BODIPY molecules could be examined by fluorescence microscopy without loss of brightness in more than one minute. The optimal dye concentration of BODIPY compounds were found as 2 µM. Incubation at room temperature for five minutes was sufficient for fluorochrome staining. They were also shown to be able to stain lipid droplets in heat-inactivated C.neoformans strains in all three compounds. The synthesized BODIPY480/525, BODIPY480/530 and BODIPY480/535 molecules were evaluated in accordance with the staining of lipid droplets, which were claimed to play a role in the pathogenesis of C.neoformans, and analysis by fluorescence microscopy and analysis with flow cytometer. BODIPY molecules may exhibit different properties in staining lipid droplets. These molecules should be tested for demonstrating the presence of lipid droplets in different yeast species and their suitability for pathogenesis studies.
Keywords: Cryptococcus neoformans; BODIPY; lipid droplets; optimization.
Geliş Tarihi (Received): 23.04.2021 - Kabul Ediliş Tarihi (Accepted):04.07.2021
GİRİŞ
Cryptococcus neoformans özellikle bağışıklığı baskılanmış hastalarda hayatı tehdit eden enfeksiyonlar oluşturan, ülkemizde de enfeksiyonları giderek daha sık bildirilen bazidiyomiçet maya mantarıdır[1]. Fosfolipazlar, proteazlar, üreaz, lakkaz, fizyolojik sıcaklık, melanin sentezi ve polisakkarit kapsül önemli virülans faktörleridir. Çevresel ortamda serbest yaşayan C.neoformans, insanlarda enfeksiyon esnasında makrofaj içinde fakültatif intraselüler yapıda çoğalır. Makrofaj fagozomu içinde glukoz kullanımı sınırlıdır ve bu durumda alternatif karbon kaynaklarından enerji sağlamak zorundadır. Bu şartlar, intraselüler C.neoformans’ta gen aktivasyonunu tetikler. Maya, yağlardan ß-oksidasyon ile karbohidrat sentezleyerek enerji elde eder. Ekzojen yağ asidi varlığı ile peroksizomal ve mitokondriyal ß-oksidasyon aktive olur. Bu nedenle kriptokok enfeksiyonlarında mayanın içindeki ve çevresindeki lipit varlığı ve metabolizmasının incelenmesi virülansın anlaşılmasında yol gösterici niteliktedir[2]. Aynı zamanda trigliserit ve sterol esterlerini hücre içi döngüye lipit damlacıkları (LD) taşımaktadır. LD’nin C.neoformans’ın önemli bir virülans faktörü olan melanin sentezinde ve hücre duvarı oluşumda rol oynadığı öne sürülmektedir[3].
Kolesterol esterleri ve trigliseritleri içeren tek katlı fosfolipit bir tabaka ile kaplı olan LD, ökaryotik hücrelerin nötral lipit depo organelleridir[4]. Membran dinamiği, formasyonu, protein-protein ilişkileri gibi farklı hücresel oluşumlarla olan ilişkileri nedeniyle hem enfeksiyöz hem de metabolik hastalıklarda önem kazanmıştır[5],[6]. Günümüzde uygun görüntüleme teknikleriyle bu yapılar dinamik olarak araştırılmaya çalışılmaktadır. Bu inceleme teknikleri arasında konvansiyonel ışık mikroskopisi, direkt organel kütle spektroskopisi ile Raman spektroskopisi ve türevleri bulunmaktadır. LD’nin hücre içi lokalizasyonu ve dağılımı incelenebilirken, aynı zamanda mitokondiri, nükleus ve plazma membranı gibi hücre içi yapılarla olan fizyolojik ilişkileri de çalışılabilmektedir. Bu amaçla, farklı renklerde floresans veren ve kolorimetrik sensörler ile saptanabilen maddeler sentezlenmektedir. Floresans biyogörüntüleme için immün boyalar, diazo boyaları (Sudan III, Oil Red O vb.), Nil kırmızısı ve BODIPY bileşikleri sıklıkla kullanılmaktadır. Bu boyaların, organik yapılar ile etkileşimleri farklı fiziksel ve kimyasal özelliklerine dayalıdır ve boyama işlemlerini farklı basamaklarda etkileyen farklı parametreleri vardır[5],[6],[7]. Ökaryotik hücrelerde sıklıkla kullanılan Nil kırmızısı ve LD540 BODIPY bileşikleri kadar canlı mayada hücre içine girememektedir[7]. Ayrıca salvatokromizm gösteren boyalar hücre içi ortamın fiziksel durumundan çok etkilenirler. LD’nin görüntülenmesinde yüksek kontrast gösteren, canlı maya hücresinin içine kolaylıkla geçebilen ve fotostabilitesi olan boyalar tercih edilmektedir[6],[7].
BODIPY (4,4-difluoro-4-bora-3a,4a-diaza-s-indasen) bileşikleri canlı maya hücreleri içine girebilen, lipit moleküllere bağlanan ve kendilerine özgü dalga boylarında uyarıldıklarında floresans özellik gösteren yapılardır. Ayrıca, BODIPY’ler yüksek molar absorpsiyon katsayıları, yüksek floresan kuantum verimleri, kimyasal, termal ve fotokararlılıklarının iyi olması gibi benzersiz fotofiziksel özelliklerinden dolayı önemli bir floresans boya sınıfıdır. Bu bileşiklerin ek bir avantajı, zengin kimyası aracılığıyla ana yapının tüm pozisyonlarında modifikasyon kolaylığı sağlamalarıdır. Bu şekilde BODIPY’lerin uyarılma ve emisyon dalga boylarının ayarlanabilmesi de söz konusu olabilmektedir. Sonuç olarak, bu özellikler BODIPY’leri biyolojik etiketleme, yapay ışık toplayıcılar, floresans anahtarlar ve kemosensörler olarak mükemmel adaylar haline getirmiştir. Ek olarak, polimerik BODIPY’ler son zamanlarda makromoleküler sistemlerin repertuvarına eklenmiştir ve hem malzeme hem de optik görüntüleme alanlarında giderek artan sayıda uygulama bulmaktadır[8],[9],[10]. Değişken fotostabilite ve solvatokromizm gösteren BODIPY bileşikleri üzerinde çalışılmaktadır[6].
Akan hücre ölçer sistemleri; cihazın ürettiği lazerin önünden geçen hücrelerden saçılım sonucu açığa çıkan optik sinyalin farklı dalga boylarını yakalayabilen dedektörler prensibi ile çalışmaktadır. Farklı florokrom boyalar kullanılarak, hücrelerin yapısındaki farklılıklar saptanabilir ve yorumlanabilir[11]. Akan hücre ölçer sistemlerinde granülitenin saptanabiliyor olması, sitoplazmada bulunan LD’nın farklı hücrelerde BODIPY ile boyanarak incelemeye alınmasına imkan tanıyabilmektedir[12],[13].
Ülkemizde farklı merkezlerde çoğunlukla araştırma amaçlı BODIPY bileşikleri sentezlenmektedir. Sunulan çalışmanın amacı, C.neoformans’ın LD varlığının, yeni sentezlenerek tanımlamaları yapılmış olan üç farklı BODIPY bileşiği yardımıyla gösterilmesi ve yöntemin ileriki araştırmalar için optimizasyonunu gerçekleştirmektir.
GEREÇ ve YÖNTEM
Araştırmaya çevresel taramalarla izole edilerek moleküler tanımlamaları yapılan[14] 10 farklı C.neoformans izolatı alındı. İzolatlar, Sabouraud dekstroz agar (SDA) besiyerinde 28ºC’de üç gün süreyle edilerek üretilerek çoğaltıldı. Her izolat 33°C’de %0.2 oleik asit içeren (Test grubu) ve içermeyen (Kontrol grubu) Sabouraud dekstroz buyyon (SDB) besiyerinde, çalkalamalı su banyosu içinde üç gün süreyle inkübe edildi. İnkübasyon sonunda kültürler üçer defa fosfatlı tamponlu tuzlu suyla (PBS) yıkandı. Süpernatan döküldü. LD fiksasyonu amacıyla çökeleklere 400 µl %4 paraformaldehit eklenerek 10 dakika oda sıcaklığında bırakıldı. Üzerine 500 µl daha PBS eklenen tüplere, son konsantrasyonu 5, 2.5, 2 ve 1 µM olacak şekilde 100 µl BODIPY solüsyonu ilave edildi. Örnekler oda sıcaklığında beş dakika ışık almayan ortamda bekletildikten sonra incelemeye alındı.
Bir maya kökeni (C.neoformans Z-121) PBS içinde yoğun McFarland 2 bulanıklığında hazırlandıktan sonra 60°C’de bir saat bekletilerek öldürüldü[15]. Süre sonunda PBS ile yıkandı. Santrifüj ile elde edilen çökelek üzerine 800 µl %4 paraformaldehit ilave edildi. Hücre canlılığını saptamak için son konsantrasyonu 1 μg/ml olacak şekilde propidyum iyodit eklendi. Aynı tüpe son konsantrasyonu 2 µM olacak şekilde BODIPY480/530 eklenerek 10 dakika oda sıcaklığında bekletildi. Sıcakta bekletilerek öldürülen mayalardan SDA besiyerine ekim yapılarak canlılık kontrolü yapıldı.
Araştırmaya alınan maya izolatlarının ortalama nükleus/hücre çapı 2D oranını saptamak için Hoescht 33342 (2’-[4-ethoxyphenyl]-5-[4-methyl-1-piperazinyl]-2, 5’-bi-1H-benzimidazole trihydrochloride trihydrate) boyası kullanıldı. Boyama için mayalar, sekiz odacık içeren lamlara (BD Falcon Culture Slides; 8 Chamber Polystyrene Vessel Tissue culture treated Glass Slide, ABD) %4 paraformaldehit içeren solüsyon içinde yayıldı ve beş dakikaoda sıcaklığına bırakıldı. İnkübasyon sonrası 1 µg/ml Hoechst 33342 ve 2 µM konsantrasyonda BODIPY480/525 bileşiği ile boyandı. Mikroskobik incelemede Olympus BX51 mikroskobu ile Hoescht 33342 için 461 nm, BODIPY480/525 bileşiği için 516 nm dalga boyu filtreleri kullanıldı. Elde edilen görüntüler ImajeJ (ver 1.53) programına aktarıldı; randomize 20 hücre görüntüsünün ölçümleri yapılarak ortanca nükleus/hücre çapı oranı bulundu.
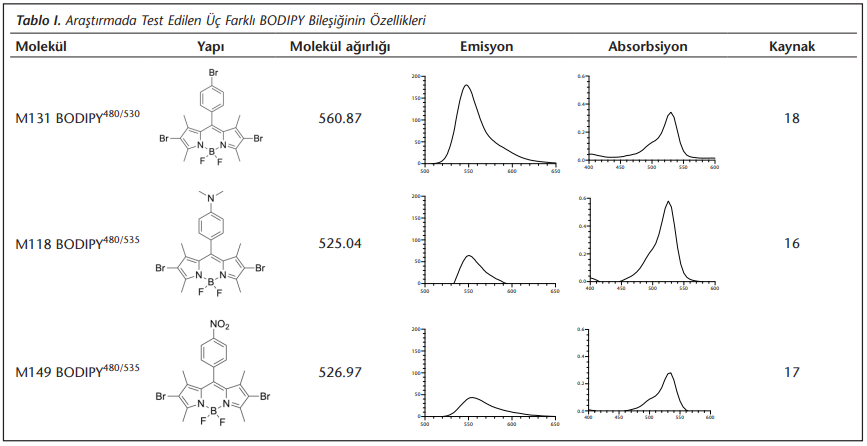
Araştırmada kullanılan BODIPY’ler (BODIPY480/525, BODIPY480/530, BODIPY480/535) ASUBTAM Memduh Bilmez BiyoNanoTeknoloji Araştırma Laboratuvarı’nda, literatürde bahsedildiği şekilde sentezlendi[16],[17],[18]. Stok solüsyonlar dimetil sülfoksit içinde 5 mm hazırlandı ve kullanım zamanına kadar -20°C’de bekletildi. Stok çözeltiden çalışma solüsyonu dilüsyonları PBS ile yapıldı. Kullanılan BODIPY’lerin özellikleri Tablo 1’de verildi[16],[17],[18].
İncelemeye alınan izolatların akan hücre ölçer analizleri, Navios Flow Cytometer (Version 1.5, Beckman Coulter, İndianapolis, ABD) cihazında yapıldı. Ölçümlerde 488 nm eksitasyon lazeri kullanıldı. Her bir kontrol ve test örneği için 20000 maya hücresi test edildi. Yapılan ölçümlerle alınan *.LMD dosyaları FCSalyzer (ver 0.9.21-alpha, GPLv3, https://sourceforge.net/projects/fcsalyzer) programına aktarıldı. 525 nm’de dedektör yardımı ile akım hücre sayımı ve saçılım verileri elde edilerek incelendi. Histogram analizlerinde ortalama ışıma yoğunluğu ortanca değerleri kullanıldı. Matriks değerlendirmede, orijin kesim noktası için yatay ve düşey eksen için nükleus/hücre çapı oranı kullanıldı. Hücre sitoplazmik granülositesine bağlı olarak dağılım ışımasının saptanacağı sağ üst kadran, karşılaştırılabilir LD verisi olarak kabul edildi[19].
Lipit içeren ortamda çoğaltılan C.neoformans’ın daha çok lipit damlacığı oluşturacağına dair tek yönlü hipotez, Jamovi (Ver. 1.2, GPL2+, https://www.jamovi.org) programı ile test edildi. Shapiro-Wilks testi ile Gauss dağılımına uymayan veriler Wilcoxon eşleştirilmiş çiftler işaret testi ile karşılaştırıldı. İstatistik hata payı 0.05 olarak alındı.
BULGULAR
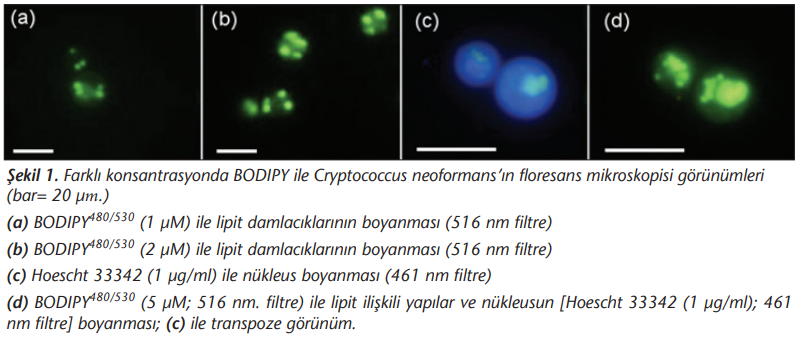
Floresans mikroskopi ile yapılan ön değerlendirmede, sitoplazma içinde boyanan LD’nin test edilen her üç BODIPY bileşiği ile boyandığı ve parlak yeşil refle verdiği görülmüştür. LD, keskin sınırlı ve yüksek kontrast oluşturarak boyanmıştır (Şekil 1 a,b). 2 µM konsantrasyonun üzerinde yapılan boyamalarda görüntülemede keskinlik sorunlarının görüldüğü, transpozisyon nedeniyle netleştirme sorunları oluştuğu ve 5 µM boyamada hücrenin lipit-ilişkili yapılarının boyandığı, nükleus yapısının görüntüleme ile ayrılamadığı görülmüştür (Şekil 1). Her üç bileşiğin inceleme esnasında parlaklığını yaklaşık 30 saniye süreyle koruyabildiği, bu süre sonunda soluklaşarak parlaklılığını kaybettiği gözlenmiştir.
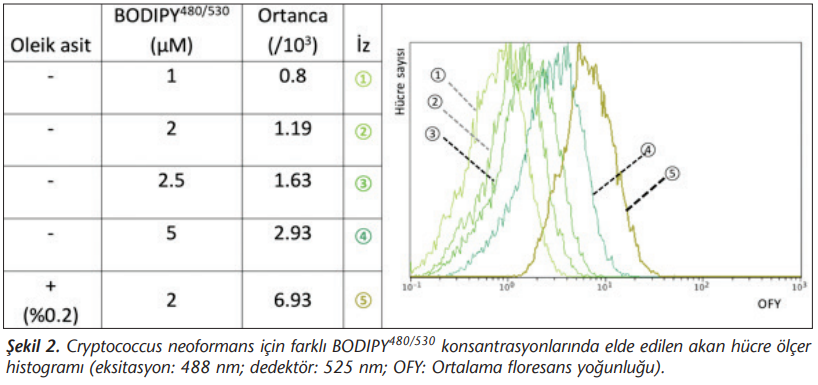
Her üç BODIPY bileşiğinin 1, 2, 2.5 ve 5 µM konsantrasyonları ile elde edilen veriler Şekil 2’de verilmiştir. Konsantrasyon yükselmesi ile birlikte, ortanca floresans değeri verisinin non-lineer olan histogram apsisinde sağa yaklaştığı görülmektedir. Oleik asitin olmadığı (Kontrol grubu, minimal LD’nin bulunduğu) ortamda üretilen C.neoformans’ın BODIPY bileşikleri ile boyanmasında en belirgin floresans ortanca değerleri 1 ve 2 µM konsantrasyonlarda elde edilmiştir (Şekil 2). Oleik asiti 1 ve 2 µM içeren ortamlarda üretilen C.neoformans’dan elde edilen ışıma verisi, oleik asidin bulunmadığı ortamda üretilen mayalardan elde edilen ışımadan daha yüksektir (p< 0.05).
Akan hücre ölçer verilerinin alımı öncesinde Hoescht 33342 boyaması ile yapılan nükleus/sitoplazma oranı ortanca değeri %40 bulunmuştur (Şekil 1 c). Bu veriye göre tüm izolatlar için matriks veri analizlerinde orijin değeri, eksenlerin %40’ı kabul edilmiştir.
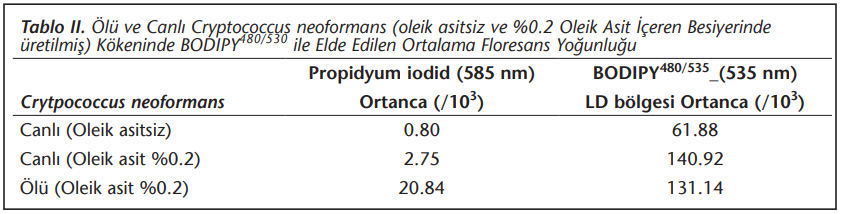
Ölü ve canlı C.neoformans izolatlarında LD’nin BODIPY480/535 ile saptanabildiği görülmüştür. Transpozisyon nedeni ile BODIPY480/535 ile boyanan ölü ve canlı hücreler, akan hücre ölçer ile yaklaşık aynı ortanca ışıma değerini göstermiştir. Bu nedenle ölü ve canlı hücre ayrımı bu bileşikler ile yapılamamıştır. Bu durum, bu çalışmada uygulanan ısı ile öldürme işleminin15 LD’nin saptanmasını bozmadığını göstermiştir (Tablo 2).
TARTIŞMA
Bu çalışmayla ülkemizde sentezlenen ve sağlık bilimleri alanında kısıtlı araştırılması yapılmış[16] olan üç yeni BODIPY bileşiğinin floresans mikroskopide kullanılabilirliği ve akan hücre ölçer cihazında test edilebilirliği gösterilmiştir. Özellikle doku tipleme laboratuvarları, alerji ve hematoloji servislerinin olduğu birçok hastanemizin altyapısında bulunan akan hücre ölçer cihazındaki standart ayarlar genel olarak floresan izotiyosiyanat (FITC)’ın rutin kullanıma uygun olan dedektörlere (520 nm ve yakın alanı) göre ayarlıdır. Bu araştırmada incelenen her üç BODIPY bileşiği de bu aralıkta yüksek emisyon göstermeleri nedeniyle, rutin kullanılan akan hücre ölçer cihazlarında FITC dedektörünün sonuçların incelenmesinde kullanılması kolaylıkla mümkündür (Tablo 1). Benzer şekilde her üç bileşiğin de eksitasyon değerlerinin de 480 nm olması genel olarak FITC çalışılan hem mikroskop hem de akan hücre ölçer çalışma prensiplerine uygundur. Bu açıdan hem mikroskobik LD görüntülenmesi sağlanmış (Şekil 1), hem de sayısal analizler için akan hücre ölçer verileri ((Tablo 2), (Şekil 2)) alınabilmiştir.
BODIPY bileşiklerinin, mayaların yaşam dinamiklerinde ve metabolizma özelliklerini içeren araştırmalarda kullanılması, yaklaşık otuz yıl önce yaygınlık kazanmaya başlamış ve artarak devam etmiştir[2],[10],[20],[21],[22],[23],[24]. Son yıllarda BODIPY bileşik yapısına sahip yapıların fotodinamik inaktivasyon ile antimikrobiyal aktiviteleri araştırılmaya başlanmıştır[16],[25],[26],[27]. Ancak her BODIPY bileşiği panmikrobiyal fotodinamik inaktivasyon göstermemekte; mayalar üzerindeki LD ile ilişkili değişimler bu sayede incelenebilmektedir[20]. Mayaların virülans ve patojenite incelemelerinde BODIPY bileşiklerinin sıvı ortamdaki oluşturdukları ışıma ile “sıvı floresans geri kazanımı” gibi yeni teknikler de tanımlanmaktadır[28]. BODIPY bileşikleri ile mayalarda bulunan LD’nin yapı, fonksiyon ve etkilerinin incelenmesinde akan hücre ölçer kullanımı henüz yeni sayılabilecek bir inceleme alanıdır[20],[29].
Sunulan araştırmada C.neoformans’ın LD’nin boyanmasında 1 ve 2 µM konsantrasyonların sitoplazmada keskin sınırlı LD saptamada yeterli olduğu görülmüştür. Oleik asitli ortam, hücre içi lipit sentezini stimüle eder ve bu nedenle LD’nin birikimi sağlanır[2]. Floresans mikroskopta elde edilen verilere benzer şekilde, arka plan aktivitesinin düşük olması sonucu akan hücre ölçer cihazında da oleik asit varlığında üretilen izolatlardaki LD varlığını kolaylıkla değerlendirebilmek mümkün olmuştur (Şekil 2). Bununla birlikte, C.neoformans’ın hücre yapısının bozulmadan ısı ile öldürülmesinde LD korunmuş; canlı ve ölü C.neoformans mayalarında LD varlığı saptanabilmiştir. Bu araştırmada fotodinamik inaktivasyon bakılmamış, sadece ilk eksitasyon durumundaki değerlendirme yapılmıştır.
Yapılan araştırmada, 5 µM konsantrasyon kullanıldığında subselüler yapılarda boyama görülmüştür (Şekil 1 d). Bu durum floresan mikroskopide gözlemlenebilmekle birlikte, akan hücre ölçer için granülosite artışı olarak yansıyabilmektedir. Arka plan ışımasının da artması sonucu ortalama floresans değerlerinin sağa kaymasına neden olmakta, bu durum LD içermeyen mayaların ayrımını zorlaştırmaktadır (Şekil 2). Boyar madde konsantrasyonuna bağlı olarak endoplazmik retikulum ve plazma membranı yapısal lipit içeriklerinden dolayı boyar bileşikleri alabilmektedir. Çoğunlukla LD yapısında saptanan lipit yapıları fosfatidilkolin olmakla birlikte fosfotidilinositol, kardiyolipin, dimetil-fosfatidiletanolamin gibi diğer LD yapıları da subselüler membranda bulunarak boyanabilmektedir. Bu değişenlik kullanılan boyar bileşikle birlikte mayanın üretildiği ortamdaki glukoz, oleik asit veya diğer karbon kaynaklarının oranlarıyla da ilişkilidir[6]. Yapılan araştırma da 5 µM konsantrasyonda homojen nükleer boyanma da görülmüş ancak bu durum 2 µM ve altında saptanmamıştır (Şekil 1 b, d). Bu nedenle akan hücre ölçer ile yapılacak araştırmalarda yüksek konsantrasyondan kaçınılmalıdır.
İncelenen her üç BODIPY bileşiği fotostabilite göstermemiş, kısa sürede vermekte oldukları ışımayı kaybetmişlerdir. Bu durum akan hücre ölçer sistemleri için sorun olmamakla birlikte floresan mikroskobik araştırmalarda inceleme süresinin kısalmasına neden olmaktadır. Fotostabilitenin bulunması LD’nin incelenmesinde önemlidir ve BODIPY493/503’nin mayalarla yapılan floresan mikroskobik araştırmalarda sıklıkla kullanılmasının en önemli nedenidir[6].
Sunulan araştırmanın en önemli kısıtlılığı, inceleme alınan BODIPY bileşiklerinin ortak özelliklerine bağlı olarak, eksitasyon esnasında floresans kuvvetinin kısa sürede azalmasıdır. Bu durum akan hücre ölçer sistemleri için sorun olmamakla birlikte, mikroskopi esnasında yüksek çözünürlüklü görüntü elde edilmesine engel olmuştur. Elde edilen veriler, test edilen bileşiklerin sayısal olarak daha hızlı veri alabilen konfokal mikroskopisi ile çalışılmasına uygun olduğunu düşündürmektedir. Ülkemizde konfokal mikroskopisinin çoğunlukla araştırma temelli laboratuvarlarda bulunması, deneyim gerektirmesi ve pahalı olması da bu bileşiklerin incelenmesinde kısıtlayıcı bir faktördür. Araştırmanın bir diğer kısıtlılığı ise rutin hastane laboratuvarlarında kullanılan, akan hücre ölçer cihazının dedektör optimizasyonunun yapılamamasıdır. Bu nedenle sunulan araştırmada, maksimum eksitasyon ve emisyon değerleri kullanılamamış, halihazırda rutin olarak çalışan sistemin mevcut değişkenleri kullanılmıştır.
Araştırmada, BODIPY bileşiklerinin mayalar üzerindeki ölüm aktivitesi incelenememiştir. Bunun nedeni LD fiksasyonu için paraformaldehit kullanımıdır.
Sunulan çalışma; ülkemizde sentezlenmiş olan üç farklı BODIPY bileşiğinin, C.neoformans’ın intrastoplazmik LD’nin görüntülenmesinde ve akan hücre ölçer cihazında inceleme amacıyla kullanılmasının uygun olduğunu göstermektedir. Floresans mikroskopisinin aksine akan hücre ölçer cihazında verilerin sayısallaştırılması, otomatize olması ve karşılaştırılması daha kolaydır. Bahsedilen yöntemin farklı insan patojeni mayalar ile denenmesi ve optimizasyonu gereklidir. Sonuç olarak, C.neoformans’ın patogenez ve virülans araştırmalarında bu çalışmada sunulan BODIPY’lerin, LD’nin incelenmesi için uygun olduğunu düşünmekteyiz.
ETİK KURUL ONAYI
Bu çalışma için etik kurulu onayı gerekmemektedir.
ÇIKAR ÇATIŞMASI
Yazarlar bu makale ile ilgili herhangi bir çıkar çatışması bildirmemişlerdir.
KAYNAKLAR
- Hilmioglu-Polat S, Seyedmousavi S, Ilkit M, Hedayati MT, Inci R, Tumbay E, et al. Estimated burden of serious human fungal diseases in Turkey. Mycoses 2019; 62(1): 22-31.
- Nolan SJ, Fu MS, Coppens I, Casadevall A. Lipids affect the Cryptococcus neoformans-macrophage interaction and promote nonlytic exocytosis. Infect Immun 2017; 85(12): e00564-17.
- Chrissian C, Camacho E, Kelly JE, Wang H, Casadevall A, Stark RE. Solid-state NMR spectroscopy identifies three classes of lipids in Cryptococcus neoformans melanized cell walls and whole fungal cells. J Biol Chem 2020; 295(44): 15083-96.
- Thiam AR, Farese RV Jr, Walther TC. The biophysics and cell biology of lipid droplets. Nat Rev Mol Cell Biol 2013; 14(12): 775-86.
- Fam TK, Klymchenko AS, Collot M. Recent advances in fluorescent probes for lipid droplets. Materials (Basel) 2018; 11(9): 1768.
- Radulovic M, Knittelfelder O, Cristobal-Sarramian A, Kolb D, Wolinski H, Kohlwein SD. The emergence of lipid droplets in yeast: current status and experimental approaches. Curr Genet 2013; 59(4): 231-42.
- Wolinski H, Bredies K, Kohlwein SD. Quantitative imaging of lipid metabolism in yeast: from 4D analysis to high content screens of mutant libraries. Methods Cell Biol 2012; 108: 345-65.
- Değirmenci A, Algı F. Synthesis, chemiluminescence and energy transfer efficiency of 2,3-dihydrophthalazine-1,4-dione and BODIPY dyad. Dyes Pigm 2017; 140: 92-9.
- Pamuk M, Algı F. Synthesis of a novel on/off fluorescent cadmium(II) probe. Tetrahedron Lett 2012; 53(51): 7010-2.
- Listenberger LL, Studer AM, Brown DA, Wolins NE. Fluorescent detection of lipid droplets and associated proteins. Curr Protoc Cell Biol 2016; 71: 4.31.1-4.31.14.
- Mutlu E, Gültekin M. Akım sitomeride veri analizi. Turk Mikrobiyol Cemiy Derg 2015; 45(4): 155-9.
- Qiu B, Simon MC. BODIPY 493/503 staining of neutral lipid droplets for microscopy and quantification by flow cytometry. Bio Protoc 2016; 6(17): e1912.
- Lee YH, Chen SY, Wiesner RJ, Huang YF. Simple flow cytometric method used to assess lipid accumulation in fat cells. J Lipid Res 2004; 45(6): 1162-7.
- Ergin C, Sengul M, Aksoy L, Dogen A, Sun S, Averette AF, et al. Cryptococcus neoformans recovered from olive trees (Olea europaea) in Turkey reveal allopatry with African and South American lineages. Front Cell Infect Microbiol 2019; 9: 384.
- Baronetti JL, Chiapello LS, Garro AP, Masih DT. Treatment of rats with heat killed cells (HKC) of Cryptococcus neoformans var. grubii induces cellular activation in spleen and lymphatic nodes. Comp Immunol Microbiol Infect Dis 2011; 34(4): 327-34.
- Boran R, Pamuk Algı M, Uğur A. In vitro evaluation of the effectiveness of different BODIPY dyes as photosensitizer in methicillin-resistant Staphylococcus aureus treatment. Mugla J Sci Technol 2018; 4(2): 191-7.
- Cihaner A, Algı F. Synthesis and properties of 4, 4-difluoro-4-bora-3a, 4a-diaza-s-indacene (BODIPY)-based conducting copolymers. React Funct Polym 2009; 69(1): 62-7.
- Pamuk Algı M, Tirkes S, Ertan S, Cansu Ergun ES, Cihaner A, Algı F. Design and synthesis of new 4, 4-difluoro-4-bora-3a, 4a-diaza-s-indacene based electrochromic polymers. Electrochim Acta 2013; 109: 766-74.
- Li M, Wilkins M. Flow cytometry for quantitation of polyhydroxybutyrate production by Cupriavidus necator using alkaline pretreated liquor from corn stover. Bioresour Technol 2020; 295: 122254.
- Kacmar J, Carlson R, Balogh SJ, Srienc F. Staining and quantification of poly-3-hydroxybutyrate in Saccharomyces cerevisiae and Cupriavidus necator cell populations using automated flow cytometry. Cytometry A 2006; 69(1): 27-35.
- Li H, Black PN, DiRusso CC. A live-cell high-throughput screening assay for identification of fatty acid uptake inhibitors. Anal Biochem 2005; 336(1): 11-9.
- Bozaquel-Morais BL, Madeira JB, Maya-Monteiro CM, Masuda CA, Montero-Lomeli M. A new fluorescence-based method identifies protein phosphatases regulating lipid droplet metabolism. PLoS One 2010; 5(10): e13692.
- Princová J, Schätz M, Ťupa O, Převorovský M. Analysis of lipid droplet content in fission and budding yeasts using automated image processing. J Vis Exp 2019; (149).
- Mantilla MJ, Cabrera Díaz CE, Ariza-Aranguren G, de Cock H, Helms JB, Restrepo S, et al. Back to the basics: Two approaches for the identification and extraction of lipid droplets from Malassezia pachydermatis CBS1879 and Malassezia globosa CBS7966. Curr Protoc 2021; 1(5): e122.
- Agazzi ML, Ballatore MB, Reynoso E, Quiroga ED, Durantini EN. Synthesis, spectroscopic properties and photodynamic activity of two cationic BODIPY derivatives with application in the photoinactivation of microorganisms. Eur J Med Chem 2017; 126: 110-21.
- Carpenter BL, Situ X, Scholle F, Bartelmess J, Weare WW, Ghiladi RA. Antiviral, antifungal and antibacterial activities of a BODIPY-based photosensitizer. Molecules 2015; 20(6): 10604-21.
- Gu K, Lin G, Zhu Y, Ji X, Li J, Dong X, et al. Anchoring BODIPY photosensitizers enable pan-microbial photoinactivation. Eur J Med Chem 2020; 199: 112361.
- Romero-Aguilar L, Montero-Lomeli M, Pardo JP, Guerra-Sanchez G. Lipid index determination by liquid fluorescence recovery in the fungal pathogen Ustilago maydis. J Vis Exp 2018; (134).
- Staniszewska M, Sobiepanek A, Gizińska M, Peña-Cabrera E, Arroyo-Córdoba IJ, Kazek M, et al. Sulfone derivatives enter the cytoplasm of Candida albicans sessile cells. Eur J Med Chem 2020; 191: 112139.
İletişim (Correspondence):
Prof. Dr. Çağrı Ergin,
Pamukkale Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
Denizli, Türkiye.
Tel (Phone):+90 (258) 296 24 91,
E-posta (E-mail):cagri@pau.edu.tr