Glia H�crelerinin Antimona Diren�li Leishmania tropica ile Enfekte Edilmesi:
Yeni Bir ex-vivo Modeli*
Infecting Glial Cells with Antimony Resistant Leishmania tropica:
A New ex-vivo Model
Or�un ZORBOZAN1, Mehmet HARMAN2, Vedat EVREN3, M�min Alper ERDOĞAN3, Aslı KILAVUZ4, Varol TUNALI1, İbrahim �AVUŞ5, �zlem YILMAZ3, Ahmet �ZBİLGİN5, Nevin TURGAY1
1 Ege �niversitesi Tıp Fak�ltesi, Parazitoloji Anabilim Dalı, İzmir.
1 Ege University Faculty of Medicine, Department of Parasitology, Izmir, Turkey.
2 Dicle �niversitesi Tıp Fak�ltesi, Dermatoloji Anabilim Dalı, Diyarbakır.
2 Dicle University Faculty of Medicine, Department of Dermatology, Diyarbakir, Turkey.
3 Ege �niversitesi Tıp Fak�ltesi, Fizyoloji Anabilim Dalı, İzmir.
3 Ege University Faculty of Medicine, Department of Physiology, Izmir, Turkey
4 Ege �niversitesi Tıp Fak�ltesi, Geriatri Anabilim Dalı, İzmir.
4 Ege University Faculty of Medicine, Department of Geriatric, Izmir, Turkey
5 Celal Bayar �niversitesi Tıp Fak�ltesi, Parazitoloji Anabilim Dalı, Manisa.
5 Celal Bayar University Faculty of Medicine, Department of Parasitology, Manisa, Turkey.
* Bu Bu �alışma, 6. D�nya Leishmania Kongresi (6th World Congress on Leishmaniasis) (16-20 Mayıs 2017, Toledo/İSPANYA)'nde bildiri olarak sunulmuştur.
�Z
Leyşmanyazis; kutan�z, mukokutan�z, viseral ve viserotropik formlar gibi farklı klinik �zelliklere sahip vekt�r kaynaklı zoonotik bir hastalıktır. Leyşmanyazis� ila� tedavisinde kullanılan protokoller toksik etkilere sahiptir ve uygulamalar sırasında bir�ok kısıtlılık oluşmaktadır. Tedavi ile ilgili kısıtlılıklardan� en �nemlisi uygulanan protokollere karşı gelişen diren�tir. �zellikle diren�li hastalar i�in yeni tedavi se�eneklerinin geliştirilmesine ihtiya� duyulmaktadır. Antimona direnci olan hastalarda yeni ila� se�eneklerinin değerlendirilmesi i�in in-vitro ve in-vivo �alışmalara ek olarak, primer h�cre k�lt�rlerini kullanan ex-vivo modellerin iyi bir kaynak olabileceği d�ş�n�lmektedir. Bu �alışmada, tedaviye yanıt vermeyen kutan�z leyşmanyazisli hastalarda tedavi se�eneklerini değerlendirmek i�in yeni bir ex-vivo k�lt�r modelinin tanımlanması ama�lanmıştır. �alışmamızda oluşturulan deneysel ex-vivo enfeksiyon modelinde, �nceden kutan�z leyşmanyazis tanısı almış bir olgudan� elde edilen Leishmania tropica promastigot formu kullanılmıştır. Ex-vivo modeli i�in kullanılacak primer astroglial h�cre k�lt�r�, steril koşullar altında, 2-3 g�nl�k yeni doğan Sprague Dawley sı�an beyinlerinden McCarthy y�ntemi modifiye edilerek hazırlanmıştır. Yeterli yoğunluğa ulaşan astroglia h�creleri antimona diren�li L.tropica promastigotları ile enfekte edilmiştir. Yirmi d�rt saatlik ink�basyondan sonra, h�crelerin �zerinde bulunan �st sıvı toplanmış, h�cre k�lt�r plağı oda sıcaklığında kurutulduktan sonra metil alkol ile fikse edilmiş ve Giemsa boyası ile boyanarak L.tropica amastigotları tanımlanmıştır. L.tropica promastigotları ile enfekte edilen primer h�cre k�lt�rlerinde glia h�creleri i�erisinde amastigotlar yoğun bir şekilde g�zlenmiştir. Enfekte edilen plaklardan elde edilen sıvı besiyerinin santrif�j� sonrası dip ��keltiden hazırlanan yaymaların Giemsa boyası ile hazırlanan preparatlarında parazitin promastigot formu� g�zlenmemiştir. Bu �alışmada beş değerlikli antimon tedavisine yanıt alınamayan� kutan�z leyşmanyazisli bir hastadan elde edilen promastigotların sı�an glia h�crelerini enfekte ederek amastigot formuna d�n�şt�ğ� g�sterilmiştir. Oluşturulan bu amastigot glia h�cre modeli bildiğimiz kadarıyla L.tropica ile oluşturulan literat�rdeki ilk modeldir. Glia h�creleri i�erisinde L.tropica amastigot şekillerinin� g�r�lmesi Leishmania t�rlerinin santral sinir sistemini enfekte edebileceğinin g�stergesi� olarak d�ş�n�lm�şt�r. Tedaviye yanıt alınamayan leyşmanyazis olgularında, santral sinir sistemi Leishmania amastigotlarının imm�n sistemden ka�ması i�in uygun bir alan olarak g�z�kmektedir.� Bu �alışma, glia h�crelerinin L.tropica amastigotları ile enfeksiyonunu g�steren ilk �alışma olması nedeniyle �nem arz etmektedir.
Anahtar s�zc�kler: Leishmania tropica; ex-vivo; glia h�cresi; antimona diren�.
ABSTRACT
Leishmaniasis is a vector-borne zoonotic disease that shows different clinical features like cutaneous, mucocutaneous, visceral and viscerotropic forms. The protocols used in the treatment of leishmaniasis are toxic and have many limitations during administration. One of the limitations of treatment is the resistance against the protocols in practice. There is also a need to define new treatment options especially for resistant patients. Ex-vivo models using primary cell cultures may be a good source for evaluating new drug options in patients with antimony resistance, in addition to in-vitro and in-vivo studies. In this study, it was aimed to define a new ex-vivo culture model to evaluate treatment options in patients with cutaneous leishmaniasis who did not respond to treatment. In our experimental model of ex-vivo infection, Leishmania tropica promastigotes isolated from a case previously diagnosed with cutaneous leishmaniasis were used. The primary astroglial cell culture used for the ex-vivo model was prepared from 2-3 days old neonatal Sprague Dawley rat brains under sterile conditions by the modification McCarthy's method. The astroglia cells, which reached sufficient density, were infected with antimony resistant L.tropica promastigotes. After 24 hours of incubation, the supernatant on the cells were collected, the cell culture plate was dried at room temperature, then fixed with methyl alcohol and stained with Giemsa to search for L.tropica amastigotes. Amastigotes were intensely observed in glia cells in primary cell cultures infected with L.tropica promastigotes. No promastigotes were seen on Giemsa stained preparations of the precipitates prepared from the bottom sediment after the centrifugation of the liquid medium removed from the infected plates. In this study, promastigotes from a cutaneous leishmaniasis patient unable to respond to pentavalent antimony therapy were shown to infect rat glia cells and converted to amastigote form. This amastigote glial cell model, as far as we know, is the first model in the literature produced by L.tropica. The occurrence of L.tropica amastigote forms in glia cells may be indicative of the ability of Leishmania species to infect the central nervous system. The central nervous system may be an area for the Leishmania amastigotes to escape from the immune system in cases of leishmaniasis without a treatment response. Our study is important because it is the first study to show the infection of glia cells with L.tropica amastigotes.
Keywords: Leishmania tropica; ex-vivo; glial cell; antimony resistance.
Geliş Tarihi (Received): 28.07.2017 - Kabul Ediliş Tarihi (Accepted): 24.12.2017
GİRİŞ
Leyşmanyazis; kutan�z, mukokutan�z, viseral ve viserotropik formlar gibi farklı klinik �zelliklere sahip vekt�r kaynaklı zoonotik bir hastalıktır1. Tropikal ve subtropikal b�lgelerde ve Akdeniz havzasında yaşayan insanlar enfeksiyon a�ısından risk altındadır2. Leyşmanyazis tedavisinde uygulanan protokoller toksik etkilere sahiptir ve uygulamalar sırasında bir�ok kısıtlılık oluşmaktadır3. Tedavi ile ilgili kısıtlılıklardan birisi de uygulamadaki protokollere karşı gelişen diren�tir4. �zellikle diren�li hastalar i�in yeni tedavi se�eneklerinin tanımlanmasına ihtiya� duyulmaktadır. Antimona direnci olan hastalarda yeni ila� se�eneklerinin değerlendirilmesi i�in in-vitro ve in-vivo �alışmalara ek olarak, primer h�cre k�lt�rlerini kullanan ex-vivo modeller iyi bir kaynak olmaktadır. Leishmania t�rlerine karşı ila� etkinliğinin değerlendirilmesinde amastigot-makrofaj modeli altın standart y�ntem olarak kullanılmaktadır5,6. Ancak bu y�ntemle yapılan �alışmalarda klinik yanıt ile uyumsuz sonu�lar elde edildiğine dair yayınlar mevcuttur7. Bu �alışmada, tedaviye yanıt vermeyen kutan�z leyşmanyazisli hastalarda tedavi se�eneklerini değerlendirmek i�in yeni bir ex-vivo k�lt�r modelinin tanımlanması ama�lanmıştır.
GERE� ve Y�NTEM
Antimona Diren�li Kutan�z Leyşmanyazis Olgusu Deri Kazıntı �rneğinden Leishmania tropica Promastigotlarının İzolasyonu
�alışmamızda oluşturulan "deneysel ex-vivo enfeksiyon modelinde, �nceden kutan�z leyşmanyazis tanısı almış bir olgudan� elde edilen Leishmania tropica promastigotları kullanıldı.
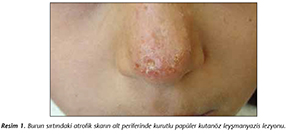
�Promastigotlar 2013 yılında burun sırtında atrofik skarın alt periferinde� kabuklu pap�ler lezyonla Dicle �niversitesi Tıp Fak�ltesi Dermatoloji Polikliniğine annesi tarafından getirilen ve iki ay �nce toplu iğne başı b�y�kl�ğ�nde bir kabartı şeklinde başlayıp b�y�yen, 11 yaşında kız �ocuğu olgusuna ait lezyondan elde edildi (Resim 1). Lezyondan yapılan dermal kazıntı yaymalarında Leishmania spp. amastigotları g�r�ld�. Lezyondan alınan klinik �rneğin ekildiği zenginleştirilmiş Novy-Nicolle-McNeal (NNN) besiyerinde promastigotlar saptandı. Elde edilen promastigotlar %10 f�tal sığır serumu ve RPMI 1640 i�eren besiyerine ekilerek 108 promastigot/ml sayısına ulaştığında kriyoprezervasyonu yapılarak sıvı azotta saklandı. Klinik �rnekten ve �retilen promastigotlardan elde edilen DNA'lar ile parazitin ITS-1 b�lgesine �zg� tasarladığımız primer ve problar ile ger�ek zamanlı PCR ile yapılan genotiplendirme �alışmalarında etken t�r�n L.tropica olduğu saptandı. Hastaya 11 g�n boyunca 5 ml/g�n meglumine-antimoniate (Glucantime� enjektabl, Sanofi-Aventis, Fransa) intralezyonel olarak uygulandı. �� ay sonra yapılan kontrol muayenesinde lezyonda belirgin iyileşme olmadığının g�zlenmesi �zerine� 11 g�n boyunca tekrar 7 ml/g�n Glucantime intralezyonel olarak� uygulandı. 2014'te lezyonunun iyileşmemesi nedeniyle tekrar başvuran hastaya bu kez 17 g�n 4 ml/g�n sodium stibogluconate (Pentostam� enjektabl, GlaxoSmithKline, Birleşik Krallık) intraven�z yoldan uygulandı. Tedavi bitiminden 6 ay sonra yapılan değerlendirmede lezyonda belirgin iyileşme olmadığı g�r�ld�. Beş değerlikli antimon tedavisine cevap alınamaması nedeniyle hasta "antimona diren�li olgu" olarak kabul edildi.
Primer H�cre K�lt�r�
Primer h�cre k�lt�r�, Ege �niversitesi Tıp Fak�ltesi Fizyoloji Anabilim Dalı h�cre k�lt�r� laboratuvarında, Helsinki bildirgesinin deney hayvanı kullanım ilkelerine uygun şekilde yapıldı. H�cre k�lt�r�nde kullanılan t�m malzemeler steril şekilde kullanıldı.
Primer astroglial h�cre k�lt�r�, steril koşullar altında, 2-3 g�nl�k yeni doğan Sprague Dawley sı�an beyinlerinden hazırlandı. McCarthy y�ntemi modifiye edilerek kullanıldı8,9. Kısaca; yeni doğan sı�anların kafatasları a�ıldı serebral korteksleri �ıkarılıp buz �zerinde, i�erisinde DMEM besiyeri (Biological Industries, ABD) bulunan steril petri kaplarına alındı. Beyin zar ve damarları stereo zoom mikroskop altında uzaklaştırıldı. Elde edilen doku �nce 1-2 mm3 boyutlarında k���k par�alara kesilerek ayrıldı; daha sonra ise bağ dokusunun par�alanması i�in %5 oranında %0.25'lik Tripsin-Edta (Sigma-Aldrich, ABD) ��zeltisi ile enzimatik reaksiyona maruz bırakıldı. DMEM + %10 FCS (Fetal Calf Serum, Biological Industries, ABD) + antibiyotik i�eren (Penisilin-Streptomisin, Sigma-Aldrich, ABD) glia k�lt�r besiyeri eklenerek tripsin n�tralize edildi ve ardından oda sıcaklığında 200 x g'de 6 dakika s�reyle santrif�j edildi. ��kelti sulandırılarak hemositometrede h�cre sayımı yapıldı, 2 x 105 yoğunlukta olacak şekilde tekrar sulandırıldı. Trypan blue ile boyanarak canlı h�cre oranı belirlendi ve 6 kuyulu steril h�cre k�lt�r� plağına ekim yapıldı. H�creler yukarıda belirtilen glia k�lt�r besiyeri i�inde, %5 CO2 ve %96 nemli hava i�eren ortamda �oğaltıldı. H�cre hatları canlılık, �oğalma ve enfeksiyon a�ısından inverted mikroskopta g�nl�k olarak izlendi ve 2-3 g�nde bir besiyerleri değiştirildi. Yaklaşık 7 g�nde t�m zemini kaplayacak kadar �oğalarak deney i�in uygun hale geldi.
Primer H�cre K�lt�r�n�n Leishmania tropica Promastigotları ile Enfeksiyonu
Yeterli yoğunluğa ulaşan astroglia h�creleri antimona diren�li L.tropica promastigotları ile enfekte edildi. Altı �ukurlu steril h�cre k�lt�r� plağında her bir �ukurun tabanını kaplamış olan glia h�creleri �zerine 2 x 106/�ukur sayıda olacak şekilde promastigotlar eklendi. Yirmi d�rt saat ink�basyondan sonra, h�crelerin �zerinde bulunan �st sıvı toplandı, 1500 rpm'de santrif�j edilerek dipteki ��keltiden yayma preparatlar hazırlanarak metil alkol ile fikse edildi ve Giemsa boyası ile boyanarak parazitin promastigot formu arandı. H�cre k�lt�r plağı oda sıcaklığında kurutulduktan sonra metil alkol ile fikse edildi ve Giemsa boyası ile boyanarak parazitin amastigot formu arandı.
BULGULAR
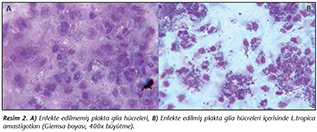
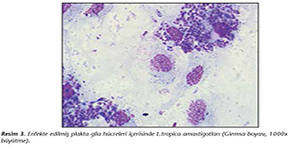
L.tropica promastigotları ile enfekte edilen primer h�cre k�lt�rlerinde glia h�creleri i�erisinde amastigotlar yoğun şekilde� tespit edilmiştir (Resim 2,3). Enfekte edilen plaklardan uzaklaştırılan sıvı besiyerinin santrif�j� sonrası dip ��keltiden hazırlanan yaymaların Giemsa boyalı preparatlarında promastigot forma rastlanmamıştır.
TARTIŞMA
Leyşmanyazisin konvansiyonel tedavisinde beş değerlikli antimon bileşikleri, pentamidin ve amfoterisin B olmak �zere �� se�enek bulunmaktadır. Beş değerlikli antimon bileşikleri d�ş�k maliyet ve y�ksek k�r oranları nedeniyle ciddi kardiyak, hepatik, pankreatik ve renal toksisitelerine rağmen halen tercih edilmektedirler. En az �� hafta s�reyle her g�n uygulanma gerekliliği ve kas i�i enjeksiyonlarında lokal ağrı, bulantı-kusma, ishal, halsizlik, kas ağrıları, deri d�k�nt�leri gibi yan etkilerin g�r�lmesi beş değerlikli antimon bileşiklerinin uygulanmasında sorunlar oluşturmaktadır10. Beş değerlikli antimonların yaygın kullanıldığı Hindistan, İran ve Peru gibi leyşmanyazisin endemik olduğu b�lgelerde diren�li� izolatların giderek daha �ok g�r�ld�ğ� bildirilmektedir11,12. Belirtilen nedenlerle leyşmanyazis tedavisinde yeni ajanların geliştirilmesi gerekmektedir.
Yeni tedavi se�enekleri in-vitro ortamda �retilen promastigotlar �zerinde, enfekte edilen deney hayvanlarında in-vivo ortamdaki amastigotlar �zerinde ve ex-vivo ortamda primer h�cre serilerinde oluşturulan amastigotlar �zerinde değerlendirilmektedir. İn-vitro y�ntem; parazitin promastigot formunun kullanılıyor olması nedeniyle insanda oluşan enfeksiyonu yansıtmada yetersiz kalmaktadır. İn-vivo y�ntemde parazitin amastigot formu kullanılmakla birlikte, konak fakt�r� ile ilişkili olarak uyumsuz sonu�lar alınabilmektedir. Farelerde ve insanlarda Leishmania t�rleri ile oluşan enfeksiyonlara karşı duyarlılık farklı genetik mekanizmalar ile d�zenlenmektedir13. Dolayısıyla fare modelleri ile kurgulanan modellerde farenin genetik alt yapısı deney sonu�larını etkileyebilmektedir.
Leishmania t�rlerine karşı ila� etkinliğinin değerlendirilmesinde bir ex-vivo y�ntem olan amastigot-makrofaj modeli altın standart olarak kabul edilmektedir5,6. Ancak bu y�ntemle yapılan �alışmalarda klinik yanıt ile uyumsuz sonu�lar elde edildiğine dair yayınlar mevcuttur. Soleimanifard ve arkadaşları7 tedaviye yanıtsız 10 olgudan elde edilen amastigotlar ile yaptıkları �alışmada olguların t�m�nde ex-vivo olarak tedaviye yanıt alındığını bildirmiş ve bu durumun olgularda tedavinin uygulanması sırasında meydana gelen eksikliklerden kaynaklandığını saptamıştır.
Klinik yanıt ile amastigot-makrofaj modeli arasındaki uyumsuzluk Leishmania t�rlerinin konak v�cudunda makrofaj dışında bir yerleşme alanının olabileceğini akla getirmektedir. Bu �alışmada beş değerlikli antimon tedavisine yanıt alınamayan bir kutan�z leyşmanyazisli hastadan elde edilen promastigotların sı�an glia h�crelerini enfekte ederek amastigot formuna d�n�şt�ğ� g�sterilmiştir. Oluşturulan bu amastigot-glia h�cre modeli bildiğimiz kadarıyla L.tropica ile� ilgili literat�rdeki ilk modeldir. Glia h�creleri i�erisinde L.tropica amastigot� formunun oluşabiliyor olması Leishmania t�rlerinin santral sinir sistemini enfekte edebileceğinin g�stergesi olabilir. Abreu-Silva ve arkadaşları14 yaptıkları �alışmada Leishmania amazonensis ile enfekte farelerin beyin parankimlerinde amastigot i�eren makrofajları g�stermiştir. Oliviera ve arkadaşları15 doğal olarak enfekte k�peklerde yaptıkları nekropsi �alışmasında santral sinir sisteminde Leishmania infantum varlığını tespit etmiştir. Bu �alışmalarda da kanıtlandığı gibi tedaviye yanıt alınamayan leyşmanyazis olgularında, santral sinir sistemi Leishmania amastigotlarının imm�n sistemden ka�ması i�in uygun bir alan olarak g�z�kmektedir.� Bu �alışma, glia h�crelerinin L.tropica amastigotları ile enfeksiyonunu g�steren ilk �alışma olması nedeniyle �nem arz etmektedir.
KAYNAKLAR
- Von Stebut E. Leishmaniasis. J Dtsch Dermatol Ges 2015; 13(3): 191-200.
- Oryan A, Akbari M. Worldwide risk factors in leishmaniasis. Asian Pac J Trop Med 2016; 9(10): 925-32.
- Savoia D. Recent updates and perspectives on leishmaniasis. J Infect Dev Ctries 2015; 9(6): 588-96.
- Copeland NK, Aronson NE. Leishmaniasis: treatment updates and clinical practice guidelines review. Curr Opin Infect Dis 2015; 28(5): 426-37.
- Hadighi R, Mohebali M, Boucher P, Hajjaran H, Khamesipour A, Ouellette M. Unresponsiveness to glucantime treatment in Iranian cutaneous leishmaniasis due to drug-resistant Leishmania tropica parasites. PLoS Med 2006; 3: e162.
- Berman JD, Chulay JD, Hendricks LD, Oster CN. Susceptibility of clinically sensitive and resistant Leishmania to pentavalent antimony in vitro. Am J Trop Med Hyg 1982; 31: 459-65.
- Soleimanifard S, Arjmand R, Saberi S, Salehi M, Hejazi SH. Treatment outcome of the drug-resistant zoonotic cutaneous leishmaniasis by glucantime. Adv Biomed Res 2017; 6: 17.
- McCarthy KD, de Vellis J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol 1980; 85 (3): 890-902.
- Yilmaz �A, Taşkıran D, Aydar S. Cytotoxicity in cytokine stimulated astrocyte cultures: role of IL-6 and nitric oxide. Neurosci Res Commun 2004; 34(2): 82-91.
- Zucca M, Scutera S, Savoia D. New chemotherapeutic strategies against malaria, leishmaniasis and trypanosomiases. Curr Med Chem 2013; 20(4): 502-26.
- Sundar S, More DK, Singh MK, et al. Failure of pentavalent antimony in visceral leishmaniasis in India: report from the center of the Indian epidemic. Clin Infect Dis 2000; 31(4): 1104-7.
- Le Pape P. Development of new antileishmanial drugs--current knowledge and future prospects. J Enzyme Inhib Med Chem 2008; 23(5): 708-18.
- Loeuillet C, Banuls AL, Hide M. Study of Leishmania pathogenesis in mice: experimental considerations. Parasit Vectors 2016; 9: 144.
- Abreu-Silva AL, Calabrese KS, Tedesco RC, Mortara RA, Gon�alves Da Costa SC. Central nervous system involvement in experimental infection with Leishmania (Leishmania) amazonensis. Am J Trop Med Hyg 2003; 68(6): 661-5.
- Oliveira VdC, Boechat VC, Mendes Junior AAV, et al. Occurrence of Leishmania infantum in the central nervous system of naturally infected dogs: Parasite load, viability, co-infections and histological alterations. PLoS ONE 2017; 12(4): e0175588.
İletişim (Correspondence):
Uzm. Dr. Or�un Zorbozan
Ege �niversitesi Tıp Fak�ltesi,
Tıbbi Parazitoloji Anabilim Dalı,
Bornova, İzmir, T�rkiye.
Tel (Phone): +90 232 390 4916,
E-posta (E-mail): orcun-zorbozan@hotmail.com