Kutanöz Leyşmanyazis Tanısında Alternatif Bifazik Nutrient Besiyeri*
An Alternative Biphasic Nutrient Medium for the Diagnosis of Cutaneous Leishmaniasis
Ayşegül AKSOY GÖKMEN1, Koray ÖNCEL2, Oğuz Alp ÖZDEMİR2, Bayram PEKTAŞ2, İbrahim ÇAVUŞ2, Serdar GÜNGÖR3, Berrin UZUN3, Selçuk KAYA1, Şemsettin KARACA4, Erkan YULA1, Mustafa DEMİRCİ1, Ahmet ÖZBİLGİN2
1 Katip Çelebi Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, İzmir.
1 Katip Celebi University Faculty of Medicine, Department of Medical Microbiology, Izmir, Turkey.
2 Celal Bayar Üniversitesi Tıp Fakültesi, Tıbbi Parazitoloji Anabilim Dalı, Manisa.
2 Celal Bayar University Faculty of Medicine, Department of Medical Parasitology, Manisa, Turkey.
3 Katip Çelebi Üniversitesi Tıp Fakültesi, Atatürk Eğitim Araştırma Hastanesi, Mikrobiyoloji Laboratuvarı, İzmir.
3 Katip Celebi University Faculty of Medicine, Ataturk Education and Research Hospital, Microbiology Laboratory,
Izmir, Turkey.
4 Katip Çelebi Üniversitesi Tıp Fakültesi, Dermatoloji Anabilim Dalı, İzmir.
4 Katip Celebi University Faculty of Medicine, Department of Dermatology, İzmir, Turkey.
* Bu çalışmanın bir bölümü, 2. Ulusal Klinik Mikrobiyoloji Kongresi (10-13 Kasım 2013, Antalya)'nde sunulmuş ve mansiyon ödülü almıştır.
ÖZ
Leishmania türü parazitlerin oluşturduğu kutanöz leyşmanyazis (KL), deride uzun süren nodüloülseratif yaralarla seyreden bir hastalık tablosudur. Enfekte tatarcıkların kan emmesi sırasında insanlara bulaşan hastalık, dünyada yaklaşık 98 ülkede endemiktir. Laboratuvar tanısında altın standart yöntemler, mikroskopik olarak amastigotların gösterilmesi ve NNN (Novy-MacNeal-Nicolle) besiyerinde promastigotların üretilmesidir. Bu çalışmada, promastigotların üretilmesinde rutin besiyeri olarak kullanılan bifazik NNN besiyeri ile mikrobiyoloji laboratuvarlarında kolaylıkla hazırlanabilen bifazik nutrient besiyerinin karşılaştırılması amaçlanmıştır. Çalışmada klinik örnek olarak, İzmir Katip Çelebi Üniversitesi Atatürk Eğitim Araştırma Hastanesi dermatoloji polikliniğine başvuran KL ön tanılı 47 yaşında kadın hastanın deri lezyonundan alınan aspirasyon sıvısı kullanılmıştır. Lezyon aspirat örneği, mikroskopi, iki ayrı besiyerinde kültür ve gerçek zamanlı polimeraz zincir reaksiyonu (Rt-PCR) yöntemleriyle değerlendirilmiştir. Örnekten hazırlanan yayma preparatın Giemsa ile boyalı mikroskopik incelemesinde Leishmania amastigotları görülmüştür. Rt-PCR ile, Leishmania parazitinin ITS1 bölgesine özgü tasarlanan primer ve problar ile L.tropica'ya uygun erime eğrisi saptanmıştır. Kültür için NNN (NNN + RPMI 1640 + %10 fetal dana serumu) ve bifazik nutrient (nutrient agar + nutrient buyyon + %10 fetal dana serumu) besiyerlerine üçer adet ekim yapılmış; kültürler 10 gün boyunca 27°C'de inkübe edilmiş ve üçüncü, yedinci ve onuncu günlerde üreyen promastigotlar sayılmıştır. NNN ve nutrient besiyerlerinde Leishmania promastigotları üçüncü günde saptanmaya başlanmıştır. NNN besiyerinde üçüncü, yedinci ve onuncu günlerde sırasıyla, 105/ml, 106/ml ve 108/ml yoğunlukta promastigot saptanmış, bu değerler nutrient besiyeri için sırasıyla, 106/ml, 107/ml ve 108/ml olarak belirlenmiştir. Promastigot sayısı üçüncü ve yedinci günlerde nutrient besiyerinde fazlayken, onuncu günde her iki besiyerinde üreyen promastigot sayıları eşitlenmiştir. Sonuç olarak KL tanısında nutrient besiyeri; rutinde kullanılan besiyerine alternatif, mikrobiyoloji ve parazitoloji laboratuvarlarında kolaylıkla temin edilebilen, raf ömrü uzun bir besiyeri olması açısından önemlidir. Bifazik nutrient besiyerinin, NNN besiyerinin bulunmadığı ya da temin edilemediği laboratuvarlarda tanıya yardımcı bir besiyeri olarak kullanılabileceği düşünülmüştür.
Anahtar sözcükler: Kutanöz leyşmanyazis; Leishmania; kültür; nutrient besiyeri; NNN besiyeri.
ABSTRACT
Cutaneous leishmaniasis (CL) caused by the Leishmania spp. parasites, is a disease characterized by nodulo-ulcerative lesions in the skin. CL is transmitted to humans by infected sandflies during blood sucking, and is endemic in about 98 countries over the world. The demonstration of amastigotes via microscopic examination, and the growth of promastigotes in NNN (Novy-MacNeal-Nicolle) medium are gold standard methods for laboratory diagnosis. The aim of this study was to compare the biphasic NNN medium that is frequently used in routine laboratories with the biphasic nutrient medium that can be prepared easily in microbiology laboratories, for the growth of promastigotes. In the study, the aspiration fluid sample was used as clinical sample which was obtained from the skin lesion of a 47-year-old female patient admitted to İzmir Katip Celebi Ataturk Education and Research Hospital dermatology outpatient clinic and pre-diagnosed as CL. The aspirate sample taken from the lesion was evaluated with microscopy, cultivation in two different media and real-time polymerase chain reaction (Rt-PCR) methods. In microscopic examination Leishmania amastigotes were observed in Giemsa-stained smears prepared from the aspiration fluid. In Rt-PCR performed by using specific primers and probes targeting ITS1 region of Leishmania parasite, a melting-curve compatible with L.tropica was detected. For cultivation, triple inoculations of the aspirate sample into NNN (NNN + RPMI 1640 + 10% fetal calf serum) and nutrient media (nutrient agar + nutrient broth + 10% fetal calf serum) were used. The cultures were incubated at 27°C for 10 days, and the number of propagated promastigotes were counted on the third, seventh and tenth days. The growth of Leishmania promastigotes was detected in both media on the third day. The number of promastigotes grown in NNN medium on the third, seventh and tenth days were 105/ml, 106/ml and 108/ml, respectively. Those values in nutrient medium were 106/ml, 107/ml and 108/ml on the third, seventh and tenth days, respectively. Although the number of promastigotes on the third and seventh days were higher in nutrient medium than NNN medium, the number of cultivated promastigotes were equal on the tenth day. As a result, nutrient medium is considered to have an impact in the diagnosis of CL, by providing an alternative to the routine medium used and can readily be available in microbiology and parasitology laboratories with long shelf-life. It was concluded that biphasic nutrient medium could be used as a supplementary medium for diagnosis in laboratories in the absence of NNN medium or can not be provided.
Keywords: Cutaneous leishmaniasis; Leishmania; nutrient medium; NNN medium.
Geliş Tarihi (Received): 30.05.2014 - Kabul Ediliş Tarihi (Accepted): 10.02.2015
GİRİŞ
Kutanöz leyşmanyazis (KL), deride uzun süren nodüloülseratif yaralarla seyredip atrofik skatrisle iyileşen, Leishmania türü protozoon parazitlerin oluşturduğu hastalık tablosudur1. Enfekte dişi tatarcıkların kan emmesi sırasında insanlara bulaştırdığı hastalık, dünyada yaklaşık 98 ülkede endemiktir. İnsidansının yılda 1.5 milyon yeni olgu olduğu tahmin edilmektedir2,3. KL olgularının %90'ından fazlası Afganistan, Cezayir, Brezilya, İran, Irak, Peru, Suudi Arabistan ve Suriye'de görülmektedir1,2. Ülkemizde KL olgularının neredeyse tamamına yakını Güney ve Güneydoğu Anadolu Bölgesi'yle Doğu Akdeniz Bölgesi'nden rapor edilmektedir. Türkiye'de çoğunlukla başta Leishmania tropica'nın etken olduğu antroponotik KL gözlenmektedir3.
KL'in endemik olduğu bölgelerde tanı klinik bulgulara göre yapılabilir. Laboratuvar tanısında boyalı mikroskopik inceleme, kültür yöntemleri ve moleküler yöntemler yer almaktadır4. Altın standart yöntem, mikroskopik incelemede amastigotların görülmesi ve NNN (Novy, MacNeal, Nicolle) besiyerinde promastigotların üremesidir. Leishmania promastigotları ilk olarak 1904 yılında NNN besiyerinde üretilmiş; o tarihten bu yana sıvı, katı ve bifazik olarak çok çeşitli besiyerleri geliştirilmiştir5,6,7,8,9. Günümüzde rutin laboratuvarlarda en sık kullanılan besiyeri NNN besiyeridir. Bifazik besiyerlerinde katı faz genellikle kan ile sağlanırken, sıvı faz fetal dana serumu (FCS), eritrosit lizatı ve ticari sıvı besiyerleriyle desteklenir5,6,7,8,9. Bu çalışmada, KL tanısında laboratuvarımızda rutin besiyeri olarak kullanılan NNN besiyeri ile kolay temin edilebilen maddeler (nutrient agar + nutrient buyyon + %10 FCS) ile hazırlanan bifazik nutrient besiyerinin karşılaştırılması amaçlanmıştır.
GEREÇ ve YÖNTEM
Hasta Örneğinin Alınması ve Direkt Mikroskopik İnceleme
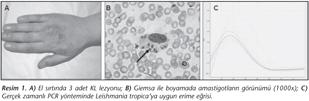
Bu çalışmada, İzmir Katip Çelebi Üniversitesi Atatürk Eğitim Araştırma Hastanesi dermatoloji polikliniğine başvuran, KL ön tanılı 47 yaşındaki kadın hastadan alınan deri lezyonu örneği kullanıldı. Hastanın İzmir'de ikamet ettiği, ancak yılda bir kez memleketi Mardin Savur ilçesine gidip geldiği öğrenildi. Hastanın dermatolojik muayenesinde sağ el sırtı proksimal metakarpafalangial eklem üzerine lokalize, boyutları 3x2 cm arasında değişen 3 adet etrafı viyolose, eritemli, ödemli ülsere plak izlendi (Resim 1-A). Lezyonun çevresindeki doku %70 alkol ile temizlendi; kuruduktan sonra lezyon ile sağlam dokunun birleşme sınırından 1 ml'lik insülin enjektörü ile 0.2-0.5 ml serum fizyolojik verilip tekrar geri çekilerek aspirasyon sıvısı alındı.
Lezyon aspirat örneğinden yayma preparatlar hazırlandı ve metil alkolle tespit sonrası Giemsa ile boyanarak, Leishmania amastigotlarının varlığı açısından mikroskopta değerlendirildi (Resim 1-B).
Kültür
Hastadan alınan aspirasyon sıvısı, rutin besiyeri olarak kullanılan NNN besiyerine ve çalışmada kullanılan nutrient besiyerine ekildi. Ekimler, her bir besiyerinden 3'er ml içeren üç tüpe yapıldı ve tüm tüpler 10 gün boyunca 27°C'de inkübe edildi. Besiyerlerinde üreyen promastigot sayıları 3., 7. ve 10. günlerde sayma kamarasında sayılarak not edildi.
NNN besiyerinin hazırlanması
Katı fazın hazırlanmasında; 500 ml'lik flask içinde 90 ml bidistile suya 0.6 gr NaCl ve 1.4 gr Bacto agar karıştırıldı ve ısıtılarak agarın tam olarak erimesi sağlandı. Besiyeri, otoklavda (121°C'de 15 dakika) sterilize edildikten sonra 50-55°C'ye soğutuldu ve içine 10 ml aseptik olarak alınmış defibrine tavşan kanı eklendi. Vida kapaklı tüplere (16x125 mm) 4'er ml aseptik olarak dağıtıldıktan sonra, 10° eğik pozisyonda agarın donması sağlandı. Daha sonra 4°C'ye alınan besiyerlerine 0.2 ml penisilin G ve streptomisin sülfat eklendi. Besiyerleri, kullanılacağı zaman buzdolabından çıkarıldı ve dip kısımlarında toplanan az miktarda yoğunlaşma sıvısı üzerine 1 ml %10 FCS içeren RPMI-1640 besiyeri eklendi. Bu şekilde sıvı fazı da hazırlanan besiyerleri ekim için kullanıldı.
Bifazik nutrient besiyerinin hazırlanması
Nutrient buyyon; 1 lt distile suda 1 gr Lab-Lemco tozu, 2 gr maya özütü, 5 gr pepton ve 5 gr NaCl olacak şekilde hazırlandı. Otoklavda sterilize edildikten sonra soğutularak içine 0.2 ml penisilin ve streptomisin eklendi; pH 7.4'e ayarlandı. Nutrient agar ise, bu karışıma 1.4 gr agar eklenerek hazırlandı. Otoklavda sterilize edildikten sonra 50°C'ye soğutuldu ve steril tüplere 4 ml hacminde dağıtıldı. Her bir steril tüpe 1 ml nutrient buyyon+%10 FCS eklenerek ekim için kullanıldı.
Gerçek Zamanlı Polimeraz Zincir Reaksiyonu (Rt-PCR)
Bu amaçla, Leishmania parazitlerinin SSU-rRNA ve 5.8S rRNA'sını kodlayan genleri ayıran ITS1 (Ribozomal Internal Transcribed Spacer 1) bölgesini hedefleyen primerler (F: 5'-GCCGATCGACGTTGTAG-3' ve R: 5'-GGAAGCCAAGTCATCCAT-3'), LightCycler- FastStart DNA Master karışımı (Lifescience, Roche, ABD) ile birlikte, özgün problar kullanılarak (Probe 1: LC Red 640-ACCGAAACGCCGTCTATTTTTTTG-Phosphate; Probe 2: CCTCTCTCTCCCTCCCGCCAA-Fluorescein) çoğaltıldı10,11,12 (Resim 1-C).
BULGULAR
Çalışmamızda, KL şüpheli olgunun lezyon aspiratından hazırlanan Giemsa boyalı preparatta Leishmania amastigotları görülmüş (Resim 1-B); NNN ve nutrient besiyerlerinde promastigotlar üretilmiş ve Rt-PCR ile elde edilen erime eğrisi sonucu izolat L.tropica olarak tanımlanmıştır (Resim 1-C).
Kültür sonuçları incelendiğinde; L.tropica promastigotlarının her iki besiyerinde de en erken üçüncü günde üremeye başladığı saptanmıştır. Sayma kamerasında 40x büyütmede NNN besiyerinde üreyen promastigot sayısı 3. günde 105/ml, 7. günde 106/ml, 10. günde 108/ml iken, nutrient besiyerinde 3. günde 106/ml, 7. günde 107/ml ve 10. günde 108/ml yoğunluğunda promastigot görülmüştür. Promastigot sayısı 3. ve 7. günlerde nutrient besiyerinde fazlayken, 10. günde her iki besiyerinde üreyen promastigot sayıları eşitlenmiştir.
TARTIŞMA
Kutanöz leyşmanyazisin (KL) tanısında altın standart yöntem; lezyondan alınan aspiras-yon sıvısından yapılan yayma preparatların Giemsa ile boyanarak mikroskopta Leishmania amastigotlarının varlığı açısından değerlendirmesi ve NNN besiyerinde Leishmania promastigotlarının gösterilmesidir8,9. Leyşmanyazis tanısında kültür yöntemleri, düşük oranda parazitemi durumunda boyama yöntemleri ile gözden kaçabilen parazitlerin çoğaltılması ile tanıyı kolaylaştırır. Ayrıca kültürde üreyen promastigotların izoenzim analizleri, metabolik aktivasyonları, antijenik ve biyokimyasal özellikleri belirlenebilmektedir. Tanıda en yaygın kullanılan besiyerleri agar ve fibrinsiz tavşan kanı içeren NNN, sığır eti, agar ve pepton içeren modifiye Tobie'nin besiyeridir. Promastigotların eldesinde ise Schneider'in Drosophila besiyeri, RPMI-1640 ve M199 en sık kullanılanlardır9,13,14,15.
NNN besiyerinin tavşan kanı gerektirmesi, kontaminasyon riski olması ve hazırlanmasının zor olması gibi dezavantajları bulunmaktadır. Ayrıca ticari besiyerlerinin raf ömürlerinin yaklaşık bir ay olması da bir diğer dezavantajdır. Buna karşın nutrient besiyerinin bu dezavantajları olmadığı gibi, hemen hazırlanıp kullanılabilme kolaylığına sahiptir. Nutrient besiyeri, mikrobiyoloji laboratuvarlarında kolayca temin edilen maddelerle basitçe hazırlanabilen temel bir besiyeridir9,13,14,15. Bu noktadan hareketle çalışmamızda, Leishmania promastigotlarının bifazik nutrient besiyerinde üreme özelliği araştırılmış ve NNN besiyeri ile benzer yoğunlukta (hatta 3. ve 7. günlerde daha yoğun) üremenin olduğu saptanmıştır. Özbilgin ve arkadaşlarının9 çalışmasında, Leishmania kültürü için tek fazlı sıvı besiyeri (nutrient buyyon) kullanılmış, ancak NNN ve RPMI-1640 besiyerlerine göre daha az başarılı olduğu bildirilmiştir. Bizim çalışmamızda ise, KL tanısında bifazik besiyerlerinin daha başarılı olduğu dikkate alınarak, bifazik nutrient besiyeri denenmiş ve rutinde kullanılan NNN besiyeri ile 10. günde eşit promastigot sayısı elde edilmiştir.
Sonuç olarak bu çalışmanın, leyşmanyazisin tanısında kolay ulaşılabilir ve raf ömrü uzun alternatif bir besiyerini önermesi açısından önemli olduğu düşünülmektedir. Mikrobiyoloji laboratuvarlarında kolaylıkla bulunabilecek ve hazırlanabilecek bifazik nutrient besiyeri, hastalık tanısının konulmasının yanı sıra, Leishmania türlerinin izolasyonu, aşı çalışmaları, tedavi takibi ve tedaviye direnç ile ilgili ileri araştırmalara da yardımcı olabilir. Ayrıca bu besiyeri, NNN besiyerinin bulunmadığı ortamlarda parazitin canlılığını sürdürme ve çoğaltılmasına da katkıda bulunacaktır.
KAYNAKLAR
- Gürel MS, Yeşilova Yavuz, Olgen MK, Ozbel Y. Cutaneous leishmaniasis in Turkey. Turkiye Parazitol Derg 2012; 36(2): 121-9.
- Atasoy A, Pasa S, Özensoy Töz S, Ertabaklar H. Seroprevalance of canine visceral leishmaniasis around the Aegean cost of Turkey. Kafkas Univ Vet Fak Derg 2010; 16(1): 1-6.
- Salman IS, Vural A, Unver A, Saçar S. Cutaneous leishmaniasis cases in Nizip, Turkey after the Syrian civil war. Mikrobiyol Bul 2014; 48(1): 106-13.
- Zeyrek YZ, Erdoğan DD, Uluca N, Tumer S, Korkmaz M. Kutanöz leishmaniasis tanısında serolojinin yeri. Kafkas Univ Vet Fak Derg 2012; 18 (Suppl A): A121-4.
- Marston AT. The examination of parasitic protozoa, pp: 1153-4. In: Belding DL (ed), Textbook of Parasitology. 1965, 3rd ed. Appleton Century Crofts, New York.
- Evans D (ed). Handbook on Isolation Characterization and Cryopreservation of Leishmania. 1989. UNDP/World Bank/WHO, Special Program for Research and Training in Tropical Diseases. WHO, Geneva
- Ihalamulla RL, Siriwardana HV, Karunaweera ND. Efficacy of RPMI 1640 and M 199 media in the isolation of Leishmania from cutaneous lesions. Ann Trop Med Parasitol 2008; 102(2): 173-5.
- Saki J, Akhlaghi L, Maraghi S, Meamar AR, Mohebali M. Evalution of modified Novy-MacNeal-Nicolle medium for isolation of Leishmania parasites from cutaneous lesions of patients in Iran. Res J Parasitol 2009; 4(2):56-62.
- Özbilgin A, Zeyrek F, Limoncu ME, et al. Comparison of culture media in the isolation and diagnosis of cutaneous leishmaniasis. Afr J Microbiol Res 2010; 4 (11): 1038-43.
- el Tai NO, Osman OF, el Fari M, Presber W, Schönian G. Genetic heterogeneity of ribosomal internal transcribed spacer in clinical samples of Leishmania donovanii spotted on filter paper as revealed by single-strand conformation polymorphisms and sequencing. Trans R Soc Trop Med Hyg 2000; 94(5): 575-9.
- El Tai NO, El Fari M, Mauricio I, et al. Leishmania donovanii: intraspecific polymorphisms of Sudanese isolates revealed by PCR-based analyses and DNA sequencing. Exp Parasitol 2001; 97(1): 35-44.
- Toz SO, Culha G, Zeyrek FY, et al. A real-time ITS1-PCR based method in the diagnosis and species identification of Leishmania parasite from human and dog clinical samples in Turkey. PLoS Negl Trop Dis 2013; 7(5): e2205.
- Ozbilgin A, Ozbel Y, Alkan MY, Atambay M, Ozcel MA. Cultivation of Leishmania spp. in nutrient broth. J Egypt Soc Parasitol 1995; 25(2): 437-40.
- Yereli K, Girginkardeşler N, Değerli K, Özbilgin A. A simple method for the cultivation of Leishmania infantum and Leishmania tropica strains in nutrient broth. Türkiye Parazitoloji Derg 1997; 21(2): 111-3.
- Limoncu ME, Özbilgin A, Balcıoğlu İC, Özbel Y. Evalution of three new culture media fort the cultivation and isolation of Leishmania parasites. J Basic Microbiol 2004; 44(3): 197-202.
İletişim (Correspondence):
Uzm. Dr. Ayşegül Aksoy Gökmen,
Katip Çelebi Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
Karabağlar 35000 İzmir, Türkiye.
Tel (Phone): +90 232 244 4444,
E-posta (E-mail): aaksoygokmen@hotmail.com