Klinik Örneklerden
İzole Edilen Staphylococcus aureus Suşlarında Makrolid, Linkozamid ve
Streptogramin B Direncinin Fenotipik ve Genotipik Yöntemlerle Araştırılması*
Investigation of
Macrolide, Lincosamide and Streptogramin B Resistance in Staphylococcus
aureus
Strains Isolated from Clinical Samples by Phenotypical and Genotypical Methods
Fatma AYDENİZ OZANSOY1, Nural CEVAHİR2, İlknur KALELİ2
1 Halk Sağlığı Laboratuvarı, Kütahya.
1 Public Health Laboratory, Kutahya, Turkey.
2 Pamukkale Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Denizli.
2 Pamukkale University Faculty of Medicine, Department of Medical Microbiology, Denizli, Turkey.
* Bu çalışma, Pamukkale Üniversitesi Bilimsel Araştırma Projeleri Koordinasyon Birimi tarafından desteklenmiştir (Proje No: 2011TPF012).
ÖZ
Staphylococcus aureus, toplum ve hastane kaynaklı enfeksiyon etkeni olarak en sık izole edilen mikroorganizmalardandır. Stafilokoklar geçmişten günümüze dek gelen süreçte önce penisilinlere ardından metisilin ve glikopeptidler olmak üzere çok sayıda antibiyotiğe direnç geliştirmelerinden ve epidemilere yol açabilmelerinden dolayı önemli bir sorun haline gelmiştir. Metisilin direnci, makrolidler gibi alternatif antibiyotiklerin kullanımına neden olmuş; ancak tüm dünyada gelişen makrolid direnci bu antibiyotiklerin kullanımını sınırlamıştır. Makrolid direnci, hedef bölge değişikliği (MLSB fenotipi, erm genleri tarafından kodlanır), aktif atım pompası (MS fenotipi, msrA/B genleri tarafından kodlanır) veya hücre duvar geçirgenliğinin azalması şeklinde oluşabilir. Bu çalışmada, klinik S.aureus suşlarında MLSB direncinin fenotipik ve genotipik yöntemlerle araştırılması amaçlanmıştır. Çalışmaya, ayaktan (%6.7) ve yatan (%93.3) hastaların yara (%50), trakeal aspirat (%15) ve diğer (%35) örneklerinden izole edilen toplam 404 S.aureus suşu alınmıştır. Suşlarda MLSB direncinin fenotipik olarak araştırılmasında çift disk sinerji testi (D-test), genotipik olarak araştırılmasında ise PCR yöntemi kullanılmıştır. S.aureus suşlarının 158 (%39.1)'i metisiline dirençli (MRSA), 246 (%60.9)'sı metisiline duyarlı (MSSA) olarak bulunmuştur. D-test ile 19 suşta yapısal (cMLSB) klindamisin direnci, 111 suşta indüklenebilir (iMLSB) klindamisin direnci, beş suşta MS fenotipi ve 268 suşta S fenotipi (eritromisin ve klindamisine duyarlı) saptanmıştır. Fenotipik olarak MLSB direnci bulunan 136 suşun direnç genleri genotipik olarak araştırıldığında, iMLSB fenotipi gösteren 111 suşun %81.9'unda (83 MRSA, 8 MSSA) ermA, %10.8'inde ermC (7 MRSA, 5 MSSA), %10.8'inde msrA (11 MRSA, 1 MSSA), %1.8'inde msrB (2 MRSA) ve %0.9'unda (1 MRSA) ermB; cMLSB fenotipi gösteren 19 suşun %57.9'unda (10 MRSA, 1 MSSA) ermA, %36.8'inde (6 MRSA, 1 MSSA) ermC ve %15.8'inde (3 MRSA) ermB; MS fenotipi gösteren beş suşun %80'inde (2 MRSA, 2 MSSA) ermA, %75'inde msrA (3 MSSA), %50'sinde (2 MSSA) msrB ve %25'inde (1 MSSA) ermC geni saptanmıştır. ermA ve ermC genleri 14 izolatta; ermA, ermC ve msrA genleri bir izolatta; ermA ve msrA genleri 11 izolatta; ermA, msrA ve msrB genleri üç izolatta; ermA ve ermB genleri üç izolatta birlikte saptanmıştır. Bu çalışmada farklı olarak D-testi negatif olan MS fenotipindeki iki MRSA suşunda tek başına ermA, iki MSSA suşunda ise msr genlerine ilaveten erm genleri de saptanmıştır. Çalışmamızda klonal benzerliğin araştırılmasında RAPD-PCR yöntemi kullanılmış ve direnç genleri saptanan suşlar arasında bir veya birkaç klonal tipin hakimiyeti gözlenmemiştir. Sonuç olarak, S.aureus izolatlarında MLSB direncinin araştırılmasının, bu bakteriyle gelişen enfeksiyonların tedavisinde antibiyotik seçimi yapılırken yönlendirici olacağı kanısına varılmıştır.
Anahtar sözcükler: Staphylococcus aureus; indüklenebilir klindamisin direnci; MLSB direnci; fenotip; genotip.
ABSTRACT
Staphylococcus aureus is one of the most common cause of both community and healthcare-associated infections. As staphylococci have developed resistance to various antibiotics, initially to penicillins then to methicillin and glycopeptides and have the ability to cause epidemics, they continue to be a major problem from past to present. Methicillin resistance gave rise to the use of alternative antibiotics such as macrolides, however worldwide development of macrolide resistance limited the use of these antibiotics. Macrolide resistance occurs either through target site modification (MLSB phenotype, encoded by erm genes), efflux pumps (MS phenotype, encoded by msrA/B genes) or decreased cell wall permeability. The aim of this study was to investigate the MLSB resistance of clinical S.aureus strains with phenotypic and genotypic methods. A total of 404 S.aureus strains isolated from different clinical samples (50% wound, 15% tracheal aspirate and 35% other samples) of inpatients (93.3%) and outpatients (6.7%) were included in the study. Double disc synergy test (D-test) was used for the phenotypical research and PCR was used for the genotypical research of MLSB resistance of isolates. One hundred fifty eight (39.1%) of the S.aureus isolates were methicillin-resistant (MRSA), and 246 (60.9%) were methicillin-susceptible (MSSA). By the use of D-test, constitutive (cMLSB) and inducible (iMLSB) clindamycin resistance were detected in 19 and 111 isolates, respectively, while five isolates were MS phenotype and 268 isolates were S phenotype (susceptible to erythromycin and clindamycin). The resistance genes of 136 isolates with MLSB resistance phenotype were determined genotypically and among 111 isolates showing iMLSB phenotype ermA gene was found in 81.9% (83 MRSA, 8 MSSA), ermC gene in 10.8% (7 MRSA, 5 MSSA), msrA gene in 10.8% (11 MRSA, 1 MSSA), msrB gene in 1.8% (2 MRSA) and ermB gene in 0.9% (1 MRSA). Among 19 strains with cMLSB phenotype, ermA was found in 57.9% (10 MRSA, 1 MSSA), ermC in 36.8% (6 MRSA, 1 MSSA) and ermB in 15.8% (3 MRSA). Among five strains with MS phenotype, ermA was found in 80% (2 MRSA, 2 MSSA), msrA in 75% (3 MSSA), msrB in 50% (2 MSSA) and ermC in 25% (1 MSSA) of the isolates. ErmA and ermC genes were detected together in 14 isolates, ermA, ermC and msrA genes in one isolate, ermA and msrA genes in 11 isolates, ermA, msrA and msrB genes in three isolates and ermA and ermB genes in three isolates, respectively. In this study, two MRSA isolates with MS phenotype and negative D-test had only ermA gene and among two MSSA strains, erm genes were also determined in addition to msr genes. In our study RAPD-PCR method was used to investigate the clonal similarity, however no dominance of one or a number of clonal type was observed among the isolates in which the resistance genes were identified. In conclusion, the detection of MLSB resistance in S.aureus isolates is likely to influence the selection of antibiotics in the treatment of the infections caused by this bacteria.
Keywords: Staphylococcus aureus; inducible clindamycin resistance; MLSB resistance; phenotype; genotype.
Geliş Tarihi (Received): 21.07.2014 • Kabul Ediliş Tarihi (Accepted): 23.12.2014
GİRİŞ
Staphylococcus aureus, gerek toplum gerekse hastane kökenli enfeksiyonlardan en sık soyutlanan etkenlerden biridir1,2. Günümüzde bu enfeksiyonların tedavisinde, mikroorganizmanın beta-laktam grubu antibiyotiklere karşı direnç geliştirmesi ve penisilin alerjisi olan hastalar nedeniyle, sıklıkla makrolid grubu antibiyotikler kullanılmaktadır. Makrolid grubu yeni antibiyotikler 1990'lı yılların başlarında, beta-laktam grubu antibiyotiklere alternatif olarak sunulmuş ve S.aureus enfeksiyonlarının tedavisinde yaygın biçimde kullanılmaya başlanmıştır. Ancak bu antibiyotiklerin yaygın ve düzensiz kullanımlarına bağlı olarak hızla direnç gelişmektedir. S.aureus suşlarında makrolidlere karşı gelişen dirençte rol oynayan mekanizmalar arasında; hücre duvarı geçirgenliğinin azalması, aktif atım pompa sistemi (efluks) ve hedef bölge değişikliği (50S ribozomal alt ünitesindeki 23S ribozomal RNA'da adenin metilasyonu) sayılabilir. En sık görülen direnç mekanizması hedef bölge değişikliğidir3,4,5. Makrolid, linkozamid, streptogramin B antibiyotiklere (MLSB) direnç olarak tanımlanan direnç profili, plazmid veya transpozonlarla aktarılır. MLSB direnç fenotipi indüklenebilir (iMLSB) veya yapısal (cMLSB) özellik gösterir. Yapısal olarak dirençli suşlar, MLSB grubundaki tüm antibiyotiklere dirençlidirler ve standart antibiyotik duyarlılık testleriyle kolayca saptanırlar. İndüklenebilir dirençte ise 14 ve 15 üyeli makrolidlerin metilaz sentezini kuvvetle indüklemeleri nedeniyle, sadece bu grupta yer alan makrolidlere karşı direnç gelişir; 16 üyeli makrolidler, linkozamid ve streptogramin B ise etkinliğini sürdürür. Bu dirençte erm geni (eritromisin ribozom metilaz) rol alır. Stafilokoklarda erm(A), erm(B), erm(C), erm(F), erm(G), erm(Q), erm(T), erm(Y), erm(32) ve erm(43) genleri tanımlanmış olup, MLSB direncinde en sık erm(A) ve erm(C) genleri saptanır3,5,6. Stafilokoklarda msrA ve msrB genleri tarafından kodlanan ATP'ye bağımlı aktif atım pompası, hücre içine giren makrolid ve streptogramin B'yi dışarı atarak dirence yol açarken, linkozamidlere karşı dirençte rol oynamaz7. Plazmidde kodlanan msrA geni bakteride 14,15 üyeli makrolidlere ve streptogramin B'ye indüklenebilir (MS fenotipli direnç) dirence yol açan protein pompasını kodlar5,7. MLSB grubu antibiyotikler, özellikle de klindamisin, stafilokok enfeksiyonlarında kemik ve dokuya penetrasyonunun iyi olması ve potansiyel antitoksin nedeniyle uzun süreli tedavi için iyi bir seçenektir; ancak indüklenebilir klindamisin direncinin gelişmesi bu etkinliği sınırlandırmıştır1,2. Bu çalışmada, çeşitli klinik örneklerden izole edilen S.aureus suşlarında, MLSB grubuna karşı gelişen direncin fenotipik karakterinin belirlenmesi ve dirençte rol alan genetik temelin saptanması amaçlanmıştır.
GEREÇ ve YÖNTEM
Bakteri Kökenleri ve Antibiyotik Duyarlılık Testleri
Çalışmaya, Ocak 2011-Ocak 2012 tarihleri arasında laboratuvarımızda çeşitli klinik örneklerden izole edilen 404 S.aureus suşu dahil edildi. Aynı hastadan alınan birden fazla örnekte üreyen izolatlar çalışma dışı bırakıldı.
Suşların eritromisin, telitromisin, klaritromisin, azitromisin, klindamisin, kinupristin- dalfopristin, oksasilin, penisilin G, sefoksitin, ampisilin-sulbaktam, linezolid, tetrasiklin, gentamisin, kloramfenikol, rifampisin, trimetoprim-sülfametoksazol (SXT), moksifloksasin ve siprofloksasine karşı duyarlılıkları, 2011 CLSI kriterlerine göre disk difüzyon yöntemi ile saptandı8. Tüm testlerde S.aureus ATCC 25923 kökeni kontrol olarak kullanıldı.
MLSB Direncinin D-test Yöntemi ile Araştırılması
Makrolid grubu antibiyotiklere direnç fenotipinin belirlenmesi için CLSI önerileri doğrultusunda çift disk sinerji testi (D-test) uygulandı8. Eritromisin ve klindamisine dirençli bulunan izolatlar yapısal MLSB fenotipi (cMLSB); klindamisin inhibisyon zonunun eritromisin diskine bakan tarafında küntleşme (D zonu) görülen izolatlar indüklenebilir MLSB fenotipi (iMLSB); eritromisine dirençli, klindamisine duyarlı olan izolatlar ise MS fenotipi olarak kabul edildi8. Eritromisin ve klindamisine duyarlı bulunan izolatlar duyarlı (S) fenotip olarak tanımlandı9.
Direnç Genotiplerinin Araştırılması
D-test ile dirençli bulunan S.aureus suşlarında ermA, ermB, ermC, msrA ve msrB genlerinin varlığı polimeraz zincir reaksiyonu (PCR) ile araştırıldı. Bakteri DNA'sının elde edilmesinde ticari bir izolasyon kiti (G-Spin TM for Bacteria; Intron Biotechnology, Inc. Güney Kore) kullanıldı. PCR işlemi, termal döngü cihazında (BIO-RAD MyCycler, ABD), kullanılan primerlere (Invitrogen, ABD) uygun reaksiyon koşullarında gerçekleştirildi. Çalışmada Lina ve arkadaşlarının10 kullandığı primer dizileri ve döngüleri kullanıldı (Tablo I). PCR ürünleri 10x TBE tamponu içinde 2.5 µl etidyum bromür içeren %1'lik agaroz jelde elektroforez cihazında (BIO-RAD, ABD) 150 voltta 25 dk yürütüldükten sonra DNA bantları Gel Logic 2200 Imaging System (Kodak, ABD) ile görüntülendi. Sonuçlar moleküler ağırlık standardı (100 bç; GeneOn, Almanya) ile karşılaştırmalı olarak değerlendirildi.
RAPD (Random Amplification of Polymorphic DNA) Analizi
Suşlar arasındaki klonal ilişkinin belirlenmesi amacıyla OLP6 (5'-GAGGGAAGAG-3'), OLP11 (5'-ACGATGAGCC-3') ve OLP13 (5'-ACCGCCTGCT-3') primerleri (Invitrogen, ABD) kullanılarak RAPD PCR uygulandı11. PCR ürünleri 10x TBE tamponu içinde 2.5 µl etidyum bromür içeren %1'lik agaroz jelde 150 voltta 25 dk yürütüldükten sonra Gel Logic 2200 Imaging System (Kodak, ABD) ile görüntülendi. Elde edilen bant paternleri, 100 bç'lik moleküler ağırlık standardı (GeneOn, Almanya) esas alınarak Syngene GeneDirectory ApplicationVer. 2.01.02 (İngiltere) kullanılarak değerlendirildi.
İstatistiksel Analiz
Verilerin istatistiksel analizi SPSS Ver.16.0 kullanılarak yapıldı. Gruplar arası değişkenleri test etmek amacıyla ki-kare testi kullanıldı; p< 0.05 değeri anlamlı kabul edildi. Fenotipik ve genotipik sonuçlar arasındaki uyum, Measure of Agreement-Kappa testi ile belirlendi.
BULGULAR
Çalışmaya alınan 404 S.aureus suşunun %6.7'si poliklinik, %93.3'ü yatan hastalara ait yara (%50), trakeal aspirat (%15) ve diğer (%35) örneklerden izole edilmiştir. İzolatların %42'si cerrahi, %37'si dahili, %11'i pediatri ve %10'u yoğun bakım bölümlerinden gönderilen örneklerden elde edilmiştir. S.aureus suşlarının 158 (%39.1)'i metisiline dirençli (MRSA), 246 (%60.9)'sı metisiline duyarlı (MSSA) olarak bulunmuş; izolatların antibiyotiklere duyarlılıkları Tablo II'de gösterilmiştir.
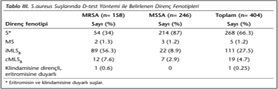
Makrolid direnci D-test yöntemi ile araştırıldığında, suşlarının %66.3'ü S; %27.5'i iMLS; %4.7'si cMLSB ve %1.2'si MS fenotipi olarak belirlenmiştir (Tablo III). Bir suş D-test ile sınıflandırılamayan direnç paterni göstermiştir. Bu suş eritromisine duyarlı, klindamisine dirençli olduğu tespit edilen bir MRSA suşudur. iMLSB direnci MRSA suşlarında, S fenotipi MSSA suşlarında anlamlı olarak yüksek bulunmuştur (p< 0.05).
D-test yöntemi ile dirençli saptanan, indüklenebilir klindamisin direnci pozitif 111 suş, klindamisin ve eritromisine dirençli 19 suş, eritromisine dirençli klindamisine duyarlı 5 suş ve eritromisine duyarlı klindamisine dirençli (sınıflandırılamayan) 1 suş olmak üzere toplam 136 S.aureus suşunda ermA, ermB, ermC, msrA ve msrB genlerinin varlığı PCR ile araştırılmıştır. Araştırılan gen bölgelerine ait bant görüntüleri Şekil 1'de sunulmuştur.
iMLSB fenotipi gösteren 83 MRSA ve 8 MSSA suşunda ermA, 1 MRSA suşunda ermB, 7 MRSA ve 5 MSSA suşunda ermC, 11 MRSA ve 1 MSSA suşunda msrA, 2 MRSA suşunda msrB direnç genleri saptanmıştır (Tablo IV). iMLSB fenotipi gösteren MRSA suşlarının 66'sında ve MSSA suşlarının 10'unda direnç genlerinin tek başına; 18 MRSA ve 2 MSSA suşunda ise birlikte bulunduğu izlenmiştir (Tablo IV). iMLSB fenotipi gösteren S.aureus suşlarında en sık ermA geni saptanmış ve bu ilişki istatistiksel olarak anlamlı bulunmuştur (p< 0.05).
cMLSB fenotipi gösteren 10 MRSA ve 1 MSSA suşunda ermA, 3 MRSA suşunda ermB, 6 MRSA ve 1 MSSA suşunda ermC genleri saptanmış; msrA ve msrB genlerine rastlanmamıştır (Tablo IV). Bu suşlarda izlenen gen birliktelikleri Tablo IV'te görülmektedir.
MS fenotipi gösteren 2 MRSA suşunda tek başına ermA genleri tespit edilmiş; 3 MSSA suşunda ise farklı gen birliktelikleri izlenmiştir (Tablo IV). MS fenotipi gösteren suşlarda ermB geni saptanmamıştır.
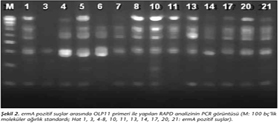
Suşlar arasındaki klonal ilişkinin belirlenmesi amacıyla RAPD-PCR uygulanmış (Şekil 2), OLP11 ve OLP13 primeri ile suşlar arasındaki benzerliğin daha iyi değerlendirildiği saptanmıştır. ermA pozitif 106 suş arasında OLP11 primeri ile yapılan RAPD analizinde 82 ve 86, 82 ve 83, 80 ve 87, 86 ve 83 no'lu suşlar arasında %99 oranında benzerlik olduğu saptanmıştır. 106 suş arasında 13 farklı RAPD tipinin olduğu belirlenmiştir (Şekil 3). Benzerlik oranının %98-99 olduğu suşların çoğu, kalp damar cerrahi, plastik cerrahi, beyin cerrahi ve göğüs cerrahi servislerinden gönderilen yara sürüntüsü ve trakeal aspirat örneklerinden izole edilen suşlardır. Kalp damar cerrahi servisinden gönderilen örneklerden izole edilen suşların kendi aralarındaki benzerlik oranları yüksek olarak saptanmış; bu suşların birbirine yakın 2 ay içinde izole edildikleri belirlenmiştir.
ermB pozitif 4 suştan 2'si arasında %95 oranında benzerlik olduğu, bir suş dışında diğer 3 suşun aynı ay içinde izole edildikleri görülmüştür. ermC pozitif 20 suştan 2'si arasında %97 oranında benzerlik olduğu saptanmıştır. msrA pozitif 15 suştan 8'i arasında %99 oranında benzerlik olduğu, benzerlik olan suşların aynı ay içinde izole edildikleri belirlenmiştir. msrB pozitif 4 suştan 2'si arasında %95 oranında benzerlik olduğu, bu suşların aynı ay içinde izole edildikleri saptanmıştır. RAPD analizi sonucunda, suşların dağılımı yönünden tek bir servis ve örnek tipi baskınlığı tespit edilmemiştir.
TARTIŞMA
Makrolidler, düşük yan etkiye sahip olmaları, geniş spektrumları, yüksek doku ve serum düzeyine ulaşmaları ile stafilokok enfeksiyonlarında alternatif tedavi seçeneği olarak kullanılan antibiyotiklerin başında yer almaktadır. MLSB grubu antibiyotikler içinde yer alan klindamisin, tolere edilebilirliği, maliyeti, oral yoldan kullanım avantajı ve yüksek doku konsantrasyonu nedeniyle MRSA ve MSSA kaynaklı deri, yumuşak doku ve kemik enfeksiyonlarının tedavisinde sıklıkla kullanılmaktadır. Bunun yanı sıra indüklenebilir klindamisin direnci ile ilişkili tedavi başarısızlıkları da bildirilmiştir12. MLSB direncinin sıklığı coğrafi olarak veya farklı hasta gruplarında ve farklı klinik örneklerden soyutlanan izolatlar arasında değişkenlik göstermektedir13,14. Dünya genelinde indüklenebilir klindamisin direnç prevalansı %3.6 ile %94 arasında değişmekte ve farklı coğrafi bölgelerde, ülkeden ülkeye ve hatta aynı ülkede farklı bölgelerdeki hastane ve hasta gruplarında farklılıklar göstermektedir15,16. Juyal ve arkadaşlarının9 yaptıkları çalışmada, MRSA izolatlarında cMLSB, iMLSB, MS ve duyarlı fenotipler sırasıyla %29, %19.4, %38.7 ve %12.9; MSSA izolatlarında ise sırasıyla %12.5, %6.3, %24.5 ve %56.7 oranında saptanmıştır. Bu araştırıcılar, MRSA suşlarında en sık MS fenotipinin görüldüğünü ve farklı coğrafi bölgelerde MLSB direnç paterninin değişebileceğini belirtmişlerdir9. Seifi ve arkadaşlarının17 çalışmasında, MRSA izolatlarında en sık cMLSB fenotipi (%52.3), MSSA izolatlarında ise en sık duyarlı fenotip (%73.9) tespit edilmiştir. Otsuka ve arkadaşları14ise, iMLSB fenotipini MSSA izolatlarında, MRSA kökenlerinden çok daha yaygın bulduklarını bildirmişler; S.aureus suşlarında fenotipik MLSB direnç insidansının ilaç kullanımına, enfeksiyon çeşidine ve ülkelere göre değişebileceğini vurgulamışlardır. Ülkemizde Sarıbaş ve arkadaşlarının18 yaptıkları çalışmada, eritromisine dirençli S.aureus suşlarının %56.2'sinin iMLSB, %40.2'sinin cMLSB fenotipi gösterdiği; eritromisine dirençli koagülaz-negatif stafilokok (KNS) suşlarının ise %41.4'ünün iMLSB, %34.5'inin cMLSB ve %24.1'inin MS fenotipi gösterdiği saptanmıştır. Bu araştırıcılar, daha önce yaptıkları çalışmada en sık saptanan yapısal direnç fenotipinin, indüklenebilir dirence değiştiğini belirlemişler; bunun nedeninin klindamisin kullanımının azalmasına bağlı olabileceğini ifade etmişlerdir18. Çolakoğlu ve arkadaşları15, 892 S.aureus suşu ile indüklenebilir klindamisin direnç prevalansını araştırdıkları çalışmada, suşların 226'sını eritromisine dirençli ve klindamisine duyarlı olarak bulmuşlar; eritromisine dirençli bu suşlar içerisinde iMLSB direnç oranını %76.5 olarak saptamışlardır. Bu oran tüm suşlar için %19.4 olarak belirlenmiş; standart duyarlılık testleri ile indüklenebilir klindamisin direncinin yanlış duyarlılık verebileceği, indüklenebilir direncin D-test ile belirlenmesinin tedavinin etkili ve güvenilir olması açısından önemli olduğu vurgulanmıştır15. Çalışmamızda, klinik örneklerden izole edilen S.aureus suşlarında toplam olarak indüklenebilir klindamisin direnç prevalansı %27.5 olarak bulunmuş; bu oran MRSA suşları için %56.3, MSSA suşları için %8.9 olarak saptanmıştır. MRSA suşlarında en sık indüklenebilir klindamisin direncinin saptanmasının sebeplerinden birisinin, hastanemizde yatan hastalarda klindamisin kullanımının kısıtlı olmasına bağlı olabileceği düşünülmüştür.
S.aureus izolatlarında makrolid, linkozamid, streptogramin B direnci, eritromisin ribozom metilasyon (erm) genleri tarafından kodlanmaktadır. Bu hem yapısal hem de indüklenebilir özellikte olabilir. Dirence neden olan diğer mekanizmalar arasında, msrA ve msrB tarafından kodlanan aktif atım pompası genleri de tanımlanmıştır. Antibiyotiğin enzimatik inaktivasyonu yoluyla oluşan direnç sadece yapısal olarak ana antibiyotiğe benzeyen antibiyotiklere dirence sebep olmaktadır3. Stafilokoklarda makrolid, linkozamid, streptogramin B grubu antibiyotiklere karşı direncin fenotipik ve genotipik olarak tanımlanmasına yönelik araştırmalarda, hangi tip fenotipik dirençten hangi gen ve gen gruplarının sorumlu olduğu belirlenmeye çalışılmıştır. Lina ve arkadaşlarının10yaptıkları çalışmada, MLSB grubu antibiyotiklerden en az bir tanesine dirençli toplam 144 S.aureus ve 150 KNS izolatında ermA, ermB, ermC, msrA, msrB, linA/linA', vga, vgb ve vat genlerinin varlığı araştırılmıştır. Bu çalışmada, S.aureus suşlarında ermA, erm, ermC ve msrA genlerinin bulunma sıklığı sırasıyla %63.2, %0.7, %25 ve %2.1 olarak saptanmış ve S.aureus suşlarında en sık ermA geninin bulunduğu belirtilmiştir10. Bir başka çalışmada da, 212 MSSA ve 314 MRSA izolatında ermA, ermC ve msrA genleri araştırılmış; toplam 129 suşta (17 MSSA, 112 MRSA) ermA geni tek başına ve en sık bulunan gen olarak saptanmış ve MRSA ve MSSA izolatlarında ermA ve ermC genlerinin MLSB direncindeki önemi vurgulanmıştır19. Ülkemizde 2010 yılında yapılan bir çalışmada, ermA, ermB, ermC ve msrA genlerinin varlığı araştırılmıştır18. Fenotipik profil ile birlikte değerlendirildiğinde, cMLSB fenotipine sahip izolatların %77.7 (35/45)'sinde ermA ve ermC genleri bir arada saptanmış, ancak msrA geni hiçbir izolatta tespit edilmemiştir18. Ülkemizde yapılmış başka bir çalışmada, eritromisine dirençli 24 S.aureus ve 78 KNS izolatında ermA, ermB ve ermC genlerinin bulunma sıklığı sırasıyla %50, %8.3 ve %62.5 olarak belirlenmiştir20. S.aureus suşlarında fenotipik olarak toplam beş izolatta MS fenotipi saptanmış olmasına rağmen üç izolatta msrA geni belirlenmiş; suşların %58.3'ünde cMLSB, %20.8'inde iMLSB fenotipi görülmüştür20. Bu çalışmada, S.aureus suşlarında ermA ve ermC geni birlikteliği %37.5 oranında tespit edilmiştir20. Bizim çalışmamızda, iMLSB fenotipi gösteren suşların %81.9'unda ermA, %10.8'inde ermC, %10.8'inde msrA, %1.8'inde msrB ve %0.9'unda ermB; cMLSB fenotipi gösteren suşların %57.9'unda ermA, %36.8'inde ermC ve %15.8'inde ermB; MS fenotipi gösteren suşların %80'inde ermA, %75'inde msrA, %50'sinde msrB ve %25'inde ermC geni saptanmıştır. ermA ve ermC genleri 14 izolatta; ermA, ermC ve msrA genleri bir izolatta; ermA ve msrA genleri 11 izolatta; ermA, msrA ve msrB genleri üç izolatta; ermA ve ermB genleri üç izolatta birlikte saptanmıştır. Fenotipik ve genotipik sonuçlar arasında %77.7 oranında uyum tespit edilmiştir. Moleküler olarak direnç genlerinin araştırıldığı pek çok çalışmada birden fazla gen kombinasyonları saptanmış; en sık ermA ve ermC gen birlikteliği bildirilmiştir18,20,21. Bizim çalışmamızda da ermA ve ermC genleri %10.3 oranında bir arada saptanmıştır. Yapılan çalışmalarda en sık rastlanan genin ermA olduğu bildirilmiştir10,19,21,22. Bu çalışmalarla uyumlu olarak bizim çalışmamızda da en sık ermA geni saptanmıştır.
Çalışmamızda, 23 S.aureus izolatı fenotipik olarak eritromisine dirençli saptanmasına rağmen, bu izolatlarda sorgulanan direnç genlerinden hiçbirisi belirlenememiştir. Benzer sonuçlar bu konuda yapılan diğer çalışmalarda da bildirilmiştir18,23. Bu izolatlarda araştırılan genlerin dışında, makrolid direncine neden olabilecek ereA/B, vat gibi genlerin bulunmasının olası olabileceği düşünülmüştür. Çalışmamızda ayrıca, klindamisine dirençli, eritromisine duyarlı olan bir MRSA suşunda direnç genleri saptanmamış; bu dirençten linA geninin sorumlu olabileceği düşünülmüştür. Çalışmamızda D-testi negatif olan MS fenotipindeki iki MRSA suşunda tek başına ermA, iki MSSA suşunda ise msr genlerine ilaveten erm genleri de saptanmıştır. Ülkemizde yapılan çalışmalarda, MS fenotipi gösteren S.aureus suşlarında msr genlerine ilaveten erm genleri bir arada bulunmamış; ancak MS fenotipi gösteren KNS izolatlarında msr genlerine ilaveten erm genleri bir arada saptanmıştır24,25. Bizim çalışmamızda, S.aureus suşlarında msr genlerine ilaveten erm genleri de bir arada saptanmıştır. Bu durum D-test sinerji testi negatif olsa bile bazı suşlarda erm genlerinin olabileceğini göstermektedir. Direnç genlerini taşıyan bu suşlarda gen ekspresyonunun hangi mekanizma ile gerçekleştiği henüz tam olarak bilinmediğinden, in vitro olarak duyarlı görünen suşlar in vivo şartlarda direnç geliştirebilmektedirler. Bu durumdan dolayı klindamisine duyarlı gözüken suşların neden olduğu enfeksiyonlarda tedavi başarısızlığı görülebilmektedir.
Klonal benzerliğin araştırıldığı çalışmalarda suşlar arasında tek bir klonal tip hakimiyeti saptanmamıştır5,7. Bu çalışmalardaki sonuçlara benzer şekilde, çalışmamızda da direnç genleri saptanan suşlar arasında tek bir klonal tipin hakimiyeti gözlenmemiştir.
S.aureus suşlarında makrolid direnç fenotip ve genotiplerinin belirlenmesi, bu suşların neden olduğu enfeksiyonların tedavisinde kullanılabilecek antibiyotiklerin seçimi açısından çok önemlidir. Stafilokokların neden olduğu enfeksiyonlarda önemli bir yeri olan klindamisinin direnç durumu bildirilmeden önce MLSB direnç fenotipi belirlenmelidir. Standart antibiyotik duyarlılık testleri ile iMLSB direnci gösteren stafilokok suşlarında klindamisin için yanlış duyarlı sonuç verilebileceği için, D-test ile iMLSB direnç varlığının araştırılması değer taşımaktadır. Direnç mekanizmasının bilinmesi, klindamisin ve diğer MLSB grubu antibiyotiklerin kullanılabilmesi açısından önemlidir. Ayrıca MLSB direncine neden olan genetik temelin belirlenmesi ile, klinik ve epidemiyolojik olarak önemli veriler elde edileceği ve ileriye dönük çalışmalarda da yönlendirici olacağı kanısındayız.
KAYNAKLAR
- Uyanık M, Yazgı H, Bilici D, Özden K, Karakoç E. Hastane kökenli Staphylococcus aureus türlerinde makrolid-linkozamid-streptogramin B direncinin araştırılması. ANKEM 2009; 23(2): 66-70.
- Gönüllü N, Karaköse A, Çatal F, Küçükbasmacı Ö, Altınkum S, Torun M. Klinik örneklerden izole edilen stafilokok suşlarının makrolid ve linkozamid direnç fenotipleri. Türk Mikrobiyol Cem Derg 2009; 39(1-2): 12-5.
- Duygu E. Streptokoklarda makrolid, linkozamid, streptogramin B direnci. 6. Antimikrobik ve Kemoterapi Günleri, 8-10 Nisan 2004, İstanbul. Türk Mikrobiyoloji Cemiyeti Yayını No: 47, s: 22-8.
- Fiebelkorn KR, Crawford SA, McElmeel ML, Jorgensen JH. Practical disk diffusion method for detection of inducible clindamycin resistance in Staphylococcus aureus and coagulase-negative staphylococci. J Clin Microbiol 2003; 41(10): 4740-4.
- Spiliopoulou I, Petinaki E, Papandreou P, Dimitracopoulos G. erm(C) is the predominant genetic determinant for the expression of resistance to macrolides among methicillin-resistant Staphylococcus aureus clinical isolates in Greece. J Antimicrob Chemother 2004; 53(5): 814-7.
- Schwendener S, Perreten V. New MLSB resistance gene erm(43) in Staphylococcus lentus. Antimicrob Agents Chemother 2012; 56(9): 4746-52.
- Janapatla R, Yan J, Huang A, Chen H, Wu H, Wu J. Inducible clindamycin resistance in Staphylococcus aureus isolates causing bacteremia at a university hospital in southern Taiwan. Diagn Microbiol Infect Dis 2007; 58(2): 203-9.
- Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. Twenty-First Informational Supplement, M100-S21, 2011. CLSI, Wayne, PA.
- Juyal D, Pal S, Sharma MK, Prakash R, Sharma N. The prevalence of inducible clindamycin resistance among staphylococci in a tertiary care hospital-a study from the Garhwal Hills of Uttarakhand, India. J Clin Diagn Res 2013; 7(1): 61-5.
- Lina G, Quaglia A, Reverdy ME, Leclercq R. Distribution of genes encoding resistance to macrolides, lincosamides, and streptogramins among staphylococci. Antimicrob Agents Chemother 1999; 43(5): 1062-6.
- Reinosoa E, Betteraa S, Frigerioa C, DiRenzob M, Calzolaria A, Bognia C. RAPD-PCR analysis of Staphylococcus aureus strains isolated from bovine and human hosts. Microbiol Res 2004; 159(3): 245-55.
- Levin TP, Suh B, Axelrod P, Truant AL, Fekete T. Potential clindamycin resistance in clindamycin-susceptible, erythromycin-resistant Staphylococcus aureus: report of a clinical failure. Antimicrob Agents Chemother 2005; 49(3): 1222-4.
- Schreckenberger PC, Ilendo E, Ristow KL. Incidence of constitutive and inducible clindamycin resistance in Staphylococcus aureus and coagulase-negative staphylococci in a community and a tertiary care hospital. J Clin Microbiol 2004; 42(6): 2777-9.
- Otsuka T, Zaraket H, Takano T, et al. Macrolidelincosamide-streptogramin B resistance phenotypes and genotypes among Staphylococcus aureus clinical isolates in Japan. Clin Microbiol Infect 2007; 13(3): 325-7.
- Çolakoğlu Ş, Alışkan H, Turunç T ve ark. Klinik örneklerden izole edilen Staphylococcus aureus suşlarında indüklenebilir klindamisin direnç prevalansı. Mikrobiyol Bul 2008; 42(3): 407-12.
- Siberry GK, Tekle T, Carroll K, Dick J. Failure of clindamycin treatment of methicilin-resistant Staphylococcus aureus expressing inducible clindamycin resistance in vitro. Clin Infect Dis 2003; 37(9): 1257-60.
- Seifi N, Kahani N, Askari E, Mahdipour S, Naderi Nasab M. Inducible clindamycin resistance in Staphylococcus aureus isolates recovered from Mashhad, Iran. Iran J Microbiol 2012; 4(2): 82-6.
- Sarıbaş Z, Tunçkanat F, Özçakır O, Ercis S. Stafilokok klinik izolatlarında makrolid-linkozamid-streptogramin B (MLSB) ve telitromisin direncinin araştırılması. Mikrobiyol Bul 2010; 44(2): 177-86.
- Vandendriessche S, Kadlec K, Schwarz S, Denis O. Methicillin-susceptible Staphylococcus aureus ST398-t571 harbouring the macrolide-lincosamide-streptogramin B resistance gene erm(T) in Belgian hospitals. J Antimicrob Chemother 2011; 66(11): 2455-9.
- Aktaş Z, Arıdoğan A, Kayacan CB, Aydin D. Resistance to macrolide, lincosamide and streptogramin antibiotics in staphylococci isolated in Istanbul, Turkey. J Microbiol 2007; 45(4): 286-90.
- Gül HC, Kılıc A, Guclu AU, Bedir O, Orhon M, Başustaoğlu AC. Macrolide-lincosamide-streptogramin B resistant phenotypes and genotypes for methicillin resistant Staphylococcus aureus in Turkey, from 2003 to 2006. Polish J Microbiol 2008; 57(4): 307-12.
- Çetin ES, Güneş H, Kaya S, Arıdoğan BC, Demirci M. Macrolide-lincosamide-streptogramin B resistance phenotypes in clinical staphylococcal isolates. Int J Antimicrob Agents 2008; 31(4): 364-8.
- 23. Eady EA, Ross JI, Tipper JL, Walters CE, Cove JH, Noble WC. Distribution of genes encoding erythromycin effluks pump in epidemiologicaly distinct groups of staphylococci. J Antimicrob Chemother 1993; 31(2): 211-7.
- Kaya I. Koagülaz pozitif ve koagülaz negatif stafilokok suşlarında makrolid, linkozamid, streptogramin B (MLSB) grubu antibiyotiklere direncin araştırılması. Yüksek Lisans Tezi, 2011. İstanbul Üniversitesi Sağlık Bilimleri Enstitüsü, İstanbul.
- Balaman N. Klinik materyallerden izole edilen stafilokoklarda makrolid, linkozamid ve streptogramin B direnci sıklığının disk yaklaştırma testi ve moleküler yöntemler kullanılarak araştırılması. (Doktora Tezi, 2008. Gazi Üniversitesi Sağlık Bilimleri Enstitüsü, Ankara.
İletişim (Correspondence):
Dr. Nural Cevahir,
Pamukkale Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı, Kınıklı,
Denizli, Türkiye.
Tel (Phone): +90 258 296 2467,
E-posta (E-mail): cevahir@pau.edu.tr