Klinik Örneklerde Çeşitli Yöntemlerle Pneumocystis jirovecii Araştırılması*
Investigation of Pneumocystis jirovecii in Clinical Specimens by Different Methods
F. Filiz TEKİNŞEN, A. Nedret KOÇ
Erciyes Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Kayseri.
Erciyes University Faculty of Medicine, Department of Medical Microbiology, Kayseri, Turkey.
* Bu çalışma, Erciyes Üniversitesi Bilimsel Araştırma Projeleri Birimi tarafından desteklenmiş (Proje No: TSD-09-1064) ve 1. Klinik Mikrobiyoloji Kongresi (12-16 Kasım 2011, Antalya)'nde poster olarak sunulmuştur.
ÖZET
Pneumocystis jirovecii, prematüre, yenidoğan ve kötü beslenen çocuklar ile kemoterapi alan, transplantasyon yapılan ve AIDS gibi immün sistemi baskılanmış hastalarda pnömoni etkenidir. Pneumocystis pnömonisi (PCP), bu hastalarda yüksek morbidite ve mortalite ile seyrettiğinden, etkenin hızlı ve doğru tanısı önem taşımaktadır. Bu çalışmada, PCP şüpheli hastalardan alınan klinik örneklerde Giemsa boyama (GB), direkt floresan antikor (DFA) testi, (1→3)--D-Glukan (BDG) testi ve gerçek zamanlı polimeraz zincir reaksiyonu (PCR) ile P.jirovecii varlığının araştırılması ve yöntemlerin karşılaştırılması amaçlanmıştır. Çalışmaya, Aralık 2008-Temmuz 2010 tarihleri arasında hastanemizin poliklinik ve kliniklerinde, altta yatan hastalıkları nedeniyle tedavi gören PCP şüpheli 100 hastaya ait solunum yolu [86 bronkoalveolar lavaj (BAL), 8 endotrakeal aspirat, 1 nazotrakeal aspirat, 3 plevra, 2 akciğer biyopsisi] ve serum örnekleri (n= 100) dahil edilmiştir. Çalışmaya alınan hastalar (66 erkek, 34 kadın; ortalama yaş: 42.04 yıl), hematolojik malignensi, böbrek transplantasyonu, nötropeni veya kronik hastalığı olan ve uzun süredir immünosüpresif ilaç kullanan hastalardır. Solunum yolu örnekleri GB (Merck, Almanya), DFA (Pneumo Cel, Cellabs, Avustralya) ve PCR (MSG genini hedefleyen primerler ile; LightCycler, Roche, ABD), serum örnekleri ise BDG (Fungitell, ACC Inc, ABD) ve PCR yöntemleri ile araştırılmıştır. Çalışmamızda, BAL örneklerinin ikisinde GB, DFA ve PCR ile, altısında sadece PCR ile olmak üzere toplam 8 (%8) örnekte pozitiflik tespit edilmiştir. Serum örneklerinin hepsi PCR ile negatif bulunurken; BDG testi ile 29'u pozitif (> 80 pg/ml), beşi şüpheli (61-79 pg/ml) ve 66'sı negatif (< 60 pg/ml) sonuç vermiştir. PCR ile P.jirovecii pozitif bulunan sekiz hastanın BDG sonuçları da pozitiftir. P.jirovecii saptanmasında yöntemler arasındaki uyum araştırıldığında; GB ile DFA arasında yüksek (κ= 1) uyum saptanmış; buna karşın PCR ile DFA (κ= 0.38), DFA ile BDG (κ= 0.07) ve BAL-PCR ile BDG (κ= 0.28) arasındaki uyumun düşük olduğu izlenmiştir. DFA testi altın standart olarak alındığında GB, PCR ve BDG yöntemlerinin duyarlılık ve özgüllük değerleri sırasıyla, %100 ve %100; %100 ve %93; %100 ve %67 olarak belirlenmiştir. DFA ve PCR altın standart alınarak BDG testi için yapılan ROC analizinde; BDG testinin duyarlılık, özgüllük, sınır (cut-off) değerleri sırasıyla %100, %93.9, 494 pg/ml ve %100, %72.8, 62 pg/ml olarak saptanmıştır. Verilerimiz, PCP şüpheli hastaların tanısında, klinik örneklerin GB ve DFA ile incelenmesinin yüksek özgüllüğe (%100) sahip olduğunu, buna karşın BAL-PCR ve BDG testlerinin eklenmesiyle duyarlılığın da yükseldiğini (%93) göstermektedir. Bu nedenle P.jirovecii'nin laboratuvar tanısında, tüm bu testlerinin birlikte çalışılmasının uygun olacağı düşünülmüştür.
Anahtar sözcükler: Pneumocystis jirovecii; beta-glukan; gerçek zamanlı polimeraz zincir reaksiyonu; Giemsa boyama; direkt floresan antikor testi.
ABSTRACT
Pneumocystis jirovecii causes pneumonia in premature, newborn or malnourished children, as well as in immunocompromised subjects such as chemotherapy receiving, transplant and AIDS patients. Since the mortality and morbidity rates of Pneumocystis pneumonia (PCP) in these patients were high, rapid and accurate diagnosis is important. The aim of this study was to evaluate the diagnostic value of Giemsa staining (GS), direct fluorescent antibody (DFA) assay, (1→3)-β-D-Glucan (BDG) test and real-time polymerase chain reaction (PCR) for the detection of P.jirovecii in clinical specimens. A total of 100 PCP-suspected patients with underlying diseases who were followed-up in outpatient and inpatient clinics of our hospital between December 2008-July 2010 were included in the study. All the patients (66 male, 34 female; mean age: 42.04 years) were under long-term immunosuppressive drug therapy due to their hematological malignancies, kidney transplantation, neutropenia or chronic diseases. Respiratory samples [86 bronchoalveolar lavage (BAL), 8 endotracheal aspirate, 1 nasotracheal aspirate, 3 pleural, 2 lung biopsy samples] obtained from the patients have been studied with GS (Merck, Germany), DFA (Pneumo Cel, Cellabs, Australia) and PCR (primers targeting MSG gene, LightCycler, Roche, USA), while serum samples (n= 100) with BDG (Fungitell, ACC Inc, USA) and PCR methods. In BAL samples two were found positive by GS, DFA and PCR, and six were positive only by PCR, yielding a total positivity in 8 (8%) samples. All of the sera were negative with PCR, however 29 of them were positive (> 80 pg/ml), five were equivocal (61-79 pg/ml) and 66 were negative (< 60 pg/ml) with BDG test. Eight patients with positive results in BAL-PCR were also positive with BDG test. Although the agreement between GS and DFA was high (κ= 1), it was observed as low between PCR and DFA (κ= 0.38), DFA and BDG (κ= 0.07), BAL-PCR and BDG (κ= 0.28). DFA taken as the gold standard, the sensitivity and specificity values of GS, PCR and BDG methods were calculated as 100% and 100%; 100% and 93%; 100% and 67%, respectively. In the ROC analysis performed for BDG test, with DFA and BAL-PCR taken as the gold standards, the sensitivity, specificity and cut-off values of BDG were estimated as 100%, 93.9% and 494 pg/ml, and 100%, 72.8% and 62 pg/ml, respectively. Our data indicated that, overall specificity was high (100%) when using GS and DFA tests together, while the sensitivity has been elevated to 93% with the additional use of PCR and BDG tests, in the diagnosis of PCP-suspected patients. In conclusion, combination of all these tests should be performed for the laboratory diagnosis of P.jirovecii.
Key words: Pneumocystis jirovecii, beta-glucan, real-time polymerase chain reaction, Giemsa staining, direct fluorescent antibody test.
Geliş Tarihi (Received): 16.08.2012 • Kabul Ediliş Tarihi (Accepted): 13.08.2013
GİRİŞ
Pneumocystis jirovecii, prematüre, yenidoğan, kötü beslenen çocuklarda ve immün sistemi baskılanmış hastalarda pnömoni etkenidir. Yapılan çalışmalar, birçok kişinin paraziti erken dönemlerde aldığını, ancak semptomların immün sistemin baskılanmasıyla ortaya çıktığını göstermiştir1. P.jirovecii'ye bağlı pnömoni, immün yetmezliği olan hastalarda yüksek morbidite ve mortalite ile seyretmektedir. Bu nedenle AIDS hastalarında ve immün sistem yetmezliği olan diğer hastalarda hızlı ve doğru tanı, akciğere yerleşen diğer mikroorganizmalardan ayırım ve tedavinin yönlendirilmesi açısından önem taşımaktadır1.
P.jirovecii enfeksiyonunun tanısında, hastaların tümünden örnek elde edilememesi ve kültür yapılamaması nedeniyle, kültür dışı erken sonuç verebilen laboratuvar testlerinin kullanılması gerekmektedir. Bunlar arasında ilk sırayı serolojik ve moleküler yöntemler almaktadır. Bu yöntemler; serumda çalışılabilmesi, örnek alınması için invazif işlemlere gerek olmaması ve kısa sürede (2-4 saat) sonuç verebilmesi nedeniyle tercih sebebi olmaktadır. Günümüzde, P.jirovecii hücre duvarında bulunan (1→3)-β-D-Glukan antijeninin aranmasına yönelik serolojik ve moleküler yöntemler ticari olarak geliştirilmiştir2. Bu çalışmada, Pneumocystis pnömonisi (PCP) şüpheli hastaların klinik örneklerinde P.jirovecii varlığı, Giemsa, direkt floresan antikor (DFA), (1→3)-β-D-Glukan (BDG) ve gerçek zamanlı polimeraz zincir reaksiyonu (PCR) yöntemleriyle araştırılarak bu yöntemlerin karşılaştırılması amaçlanmıştır.
GEREÇ ve YÖNTEM
Çalışmaya, Tıp Fakültesi Hastanesi poliklinik ve kliniklerinde Aralık 2008-Temmuz 2010 tarihleri arasında PCP şüpheli 100 hastadan alınarak, Tıbbi Mikrobiyoloji Anabilim Dalı Mikoloji Laboratuvarına gönderilen klinik örnekler dahil edildi. Çalışmaya alınan hastalar (66 erkek, 34 kadın; ortalama yaş: 42.04 yıl), hematolojik malignitesi olan, kemoterapötik ilaç kullanan, nötropenik veya kronik hastalığı olup uzun süredir immünosüpresif ilaç alan hastalardan oluşmakta idi. Çalışmaya alınan örneklerin 86'sı bronkoalveolar lavaj (BAL), 8'i endotrakeal aspirat (ETA), 3'ü plevra, 2'si akciğer biyopsisi ve 1'i nazotrakeal aspirat (NTA) olup, ayrıca tüm hastalardan kan örnekleri toplandı. Kan örnekleri, serumları ayrıldıktan sonra BDG testi için -20˚C'de, PCR testi için -70˚C'de mikrobanklarda, diğer örnekler ise Giemsa boyama, DFA ve PCR testleri çalışılmak üzere -20˚C'de mikrobanklarda saklandı.
Boyama Yöntemleri
Solunum yolu ve doku örneklerinden hazırlanan yaymalar metanol ile fikse edildikten sonra Giemsa (Merck, Almanya) ile boyanarak incelendi. DFA yöntemi, üretici firmanın (Pneumo Cel; Cellabs Pty Ltd, Avustralya) önerilerine göre uygulandı ve kırmızı zeminde elma yeşili renkte görünüm pozitif olarak değerlendirildi.
(1→3)-β-D-Glukan (BDG) Testi
BDG düzeyinin saptanması için Fungitell test kiti (ACC Inc, ABD) kullanıldı (analitik duyarlılık: min. 31 pg/ml, maks. 500 pg/ml). Örneklerden > 500 pg/ml sonuç elde edildiğinde sulandırılarak tekrar çalışıldı. Değerlendirmede, < 60 pg/ml olanlar negatif, > 80 pg/ml olanlar pozitif, 60-79 pg/ml olanlar ise olası bir fungal enfeksiyon olarak kabul edildi3,4.
PCR ile P.jirovecii Araştırılması
Hastaların kan ve diğer örneklerinden nükleik asit eldesi için Heliosis DNA izolasyon sistemi (Metis Biyoteknoloji, Türkiye) kullanıldı. Amplifikasyon karışımı 2 µl Mmix [1a solüsyon: Lightcycler Fast Start Enzyme, 1b solüsyon: Lightcycler Fast Start Reaction Mixt Hyb Probe (Fast Start Taq DNA Polymerase, Reaction Buffer dNTP mix with dUTP ya da dTTP, 10mM MgCl2)], 1.6 µl forward primer (5'-AgTgAAATACAAATCgggCTAg), 1.6 µl reverse primer (5'-ggCTgTTTCCAAgCCCA), 0.25 µl Prob fc (5'-gCgATAAggTAgTCgAAAgggAAAC--FL), 0.25 µl Prob lc (5'-LC640-gCCCAgAACAgTAATTAAAgCTCCCC--PH), 2.4 µl 25 mM MgCl2 ve 6.9 µl dH2O ile hazırlandı. Amplifikasyon karışımından her hasta için 15'er µl ve izole edilen DNA'lardan 5'er µl kullanılarak P.jirovecii MSG (Multicopy Surface Glycoprotein) geni 244 baz çiftlik hedefleri çoğaltmak üzere 95°C'de 10 dakika 1 döngü, 95°C'de 10 saniye ve 56°C'de 10 saniye (single read) ve 72°C'de 20 saniye 45 döngü, 95°C'de 20 saniye ve 40°C'de 2 dakika ve 85°C'de 00 saniye 1 döngü, 40°C'de 30 saniye 1 döngü gerçek zamanlı PCR (LightCycler, Roche, ABD) kullanıldı2.
Oluşan floresan eğrileri LightCycler software version 4 ile değerlendirildi. Floresan eğri; 10, 102, 103, 104, 105 ve 106 titrelerindeki 6 standarda göre çizildi. Negatif kontrol olarak su kullanılırken pozitif kontrol kullanılmadı.
İstatistiksel Analiz
Nitel veriler %100 olarak tanımlandı. Tanı kriteri olarak duyarlılık ve özgüllük hesaplamaları yapıldı. Testler arasındaki istatistiksel farklılığa McNemar testi ile, testler arasındaki uyuma ise kappa (κ) katsayısı hesaplanarak bakıldı. Anlamlılık seviyesi 0.05 olarak alındı. Pozitif hastalarda BDG ve BAL-PCR testlerinin sınır (cut-off) değerlerinin belirlenebilmesi için ROC (Receiver Operating Characteristic) analizi uygulandı.
BULGULAR
Çalışmaya alınan 100 hastadan 8 (%8)'inin BAL örneğinde PCR ile P.jirovecii pozitifliği saptanmıştır. Bu hastaların 7 (%87.5)'si erkek, 1 (%12.5)'i kadın olup, yaş ortalaması 37.25 yıldır. BAL-PCR pozitif 8 hastadan 2'sinin BAL örneği Giemsa ve DFA yöntemleriyle de pozitif sonuç vermiştir (Tablo I) (Şekil 1). Serum örnekleriyle yapılan PCR testinde ise hastaların hiçbirisinde pozitiflik belirlenmemiştir. BDG testi ile, 29 hastaya ait serum örneğinde pozitif (> 80 pg/ml), 5'inde olası (61-79 pg/ml) ve 66'sında negatif (< 60 pg/ml) sonuç tespit edilmiştir (Tablo II). PCR ile P.jirovecii pozitif bulunan hastaların BDG sonuçları da pozitiftir.
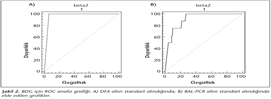
BDG testi için yapılan ROC analizinde; DFA altın standart olarak alındığında BDG testinin duyarlılık, özgüllük ve sınır değerleri sırasıyla %100, %93.9 ve 494 pg/ml olarak belirlenmiş (p< 0.001); BAL-PCR altın standart olarak alındığında ise bu değerler sırasıyla %100, %72.8 ve 62 pg/ml (p< 0.0001) olarak saptanmıştır (Şekil 2A, B).
Giemsa boyama ve DFA ile alınan sonuçlar karşılaştırıldığında, istatistiksel bir fark bulunmamış (p= 1.00), testler arası uyumun yüksek (κ= 1) olduğu belirlenmiştir (Tablo III). DFA ile PCR bulguları karşılaştırıldığında, istatistiksel olarak anlamlı bir fark (p< 0.05) ve düşük düzeyde uyum (κ= 0.38) saptanmıştır (Tablo III). DFA ile BDG testi sonuçları karşılaştırıldığında, istatistiksel olarak anlamlı farkın olduğu (p< 0.05) ve yöntemler arası uyumun düşük (κ= 0.07) olduğu izlenmiştir (Tablo III). BAL-PCR ile BDG testinin bulguları karşılaştırıldığında ise, sonuçlar arasında istatistiksel olarak anlamlı bir fark gözlenmiş (p< 0.05), testler arası uyumun düşük düzeyde (κ= 0.28) olduğu belirlenmiştir (Tablo III).
TARTIŞMA
Pneumocystis jirovecii pnömonisi (PCP), AIDS'in tanımlamasından önce sporadik olarak ortaya çıktığından tanı yöntemleri ile ilgili çalışmalar sınırlıdır. Tanıda genellikle, doğru sonuç veren ancak invazif bir yöntem olan açık akciğer biyopsisi ile alınan doku örnekleri ya da spontan çıkarılmış balgam örnekleri kullanılmıştır. Walzer ve arkadaşları5, 194 doğrulanmış ve 381 şüpheli PCP olgusunda balgamın tanı değerini yaklaşık %6 olarak bildirmişlerdir. Yapılan diğer çalışmalarda da, invazif tekniklerle alınan örneklerin tanıda daha değerli olduğu ifade edilmiş; HIV pozitif ve immün yetmezliği olan çocukların BAL örneklerinde Giemsa ile P.jirovecii saptanma oranı %70'in üzerinde oranlara ulaşmıştır6,7. BAL örneklerinde Giemsa boyama ile P.jirovecii'nin belirlenmesinde, Gomori-Grocott boyama yöntemi altın standart olarak alındığında, duyarlılık ve özgüllük sırasıyla %60 ve %100 olarak bildirilmektedir2,8. Bizim çalışmamızda, BAL örneklerinin ikisinde Giemsa boyama ile pozitiflik saptanmış; bu örneklerin BAL-PCR ve DFA ile de pozitif olduğu izlenmiştir. Giemsa boyama ve DFA ile alınan sonuçlar karşılaştırıldığında, testler arası uyumun yüksek olduğu belirlenmiştir (Tablo III).
P.jirovecii'nin kist ve trofozoitlerinin floresanla işaretli antikorlar kullanılarak saptanmasına olanak veren DFA testi sık kullanılmaktadır9. DFA testi ile P.jirovecii'nin araştırıldığı bir çalışmada, PCR referans yöntem olarak alındığında duyarlılık %93.8, özgüllük %100 olarak bildirilmiştir10. Linder ve arkadaşlarının11 çalışmasında, DFA yöntemiyle P.jirovecii saptanma oranı balgam, BAL ve biyopsi örnekleri için sırasıyla %6, %18 ve %11 olarak belirlenmiş; DFA testinin özgüllüğünün yüksek olduğu sonucuna varılmıştır. Diğer bir çalışmada ise, DFA ile 110 BAL örneğinde %18 oranında pozitiflik belirlenmiş ve duyarlılığın %93, özgüllüğün %100 olduğu rapor edilmiştir12. Bizim çalışmamızda, DFA ile iki BAL örneğinde P.jirovecii pozitifliği belirlenmiş; ancak PCR bulguları ile karşılaştırıldığında yöntemler arasındaki uyumun düşük olduğu görülmüştür (Tablo III).
P.jirovecii in vitro olarak kültürü yapılamayan bir mantar olduğu için, tanıda Giemsa ve DFA yöntemlerinin yanı sıra moleküler testler de yaygın olarak kullanılmaya başlanmıştır2,12,13,14,15. Flori ve arkadaşlarının2 çalışmasında, PCR'nin duyarlılığı %100, özgüllüğü %84.9 olarak tespit edilmiş; sınır değer (cut-off) 103 kopya olarak alındığında özgüllüğün %98.6'ya yükseldiği saptanmıştır. Yapılan diğer çalışmalarda da, BAL örneğinde DFA testi altın standart alındığında, PCR yönteminin duyarlılığı %93-100, özgüllüğü %79.3-99.1, pozitif ve negatif prediktif değeri ise sırasıyla %59-93.8 ve %99 olarak bildirilmiş; kısa sürede sonuç vermesi ve kolay uygulanabilirliği nedeniyle rutin tanı laboratuvarlarında kullanılabileceği vurgulanmıştır10,12,13. Bizim çalışmamızda, PCP şüpheli 100 hastadan alınan BAL örneklerinin %8'i PCR ile pozitif bulunmuş; kopya sayılarının 20.35 x 105-35.09 x 101 arasında olduğu saptanmış ve BAL-PCR'nin duyarlılık, özgüllük, pozitif ve negatif prediktif değerleri sırasıyla %100, %93, %25 ve %100 olarak hesaplanmıştır. Çalışmamızda sınır değer 103 kopya olarak alındığında özgüllüğün %93'den %98'e yükseldiği gözlenmiştir.
P.jirovecii enfeksiyonlarında, etkenin kanda saptanması oldukça nadirdir. Nitekim, HIV ile enfekte hastaların kan örneklerinde PCR ile P.jirovecii'nin araştırıldığı çalışmalarda hiç pozitiflik bildirilmemiştir16,17. Bizim çalışmamızda da, PCP şüpheli hastaların serum örneklerinin hiçbirisinde PCR ile pozitiflik saptanmamış; bu durumun, P.jirovecii enfeksiyonunun solunum yolu ile sınırlı kalmasından kaynaklandığı düşünülmüştür.
Beta-D-Glukan (BDG) testi, invazif fungal enfeksiyonların (İFE) tanısında kullanılan ve invazif olmayan bir yöntemdir18. Persat ve arkadaşlarının19 çalışmasında, İFE tespiti için 20 PCP hastasının da içinde olduğu 279 hastadan alınan serum örneği BDG testi ile çalışılmış; PCP'li hastalarda BDG pozitif olarak bulunmuş ve bu yöntemin tanıda kullanılmasının uygun olduğu ifade edilmiştir. Benzer olarak yapılan çalışmalarda; PCP için BDG testinin duyarlılığı %98-100, özgüllüğü %89.3-94 olarak saptanmış ve bu yöntemin PCP tanısında invazif olmayan kullanışlı ve güvenilir bir test olduğu belirtilmiştir20,21,22. Bizim çalışmamızda BDG testi ile, PCP şüpheli 100 hastanın 29'unda pozitif, beşinde şüpheli, 66'sında negatif sonuç alınmıştır. BAL-PCR ile pozitif bulunan sekiz hastanın tümünde BDG testinin pozitif olduğu gözlenmiş ve yöntemin duyarlılık, özgüllük, pozitif ve negatif prediktif değerleri sırasıyla %100, %67, %5.9 ve %100 olarak hesaplanmıştır. BDG testi ile pozitif sonuç alınan diğer 21 hasta değerlendirildiğinde, bu hastalardan 10'unun kültürlerinde Candida ve Aspergillus türlerinin üremiş olduğu belirlenmiş ve bu durumun BDG pozitifliğini etkilemiş olduğu düşünülmüştür.
PCP tanısında BDG testinin kullanımının araştırıldığı çalışmalarda, duyarlılık %92, özgüllük %65, pozitif ve negatif prediktif değerler sırasıyla %85 ve %80 olarak bildirilmiş; BDG pozitifliği ile PCP varlığı arasında istatistiksel olarak anlamlı bir ilişki olduğu sonucuna varılmıştır3,4. Araştırmacılar ayrıca, BDG için yaptıkları ROC analizlerinde sınır değerlerinin 31.1-80 pg/ml olduğunu bildirmişlerdir3,4. Bizim çalışmamızda, BDG ile BAL-PCR testlerinin ROC analizinde duyarlılık %100, özgüllük %72.8 ve sınır değeri 62 pg/ml olarak belirlenmiştir (p< 0.0001) (Şekil 2). BDG ile DFA testlerinin ROC analizinde ise duyarlılık, özgüllük ve sınır değerleri sırasıyla %100, %93.9 ve 494 pg/ml olarak saptanmıştır (p< 0.001) (Şekil 2).
P.jirovecii pnömonisi düşünülen hastalarda birden fazla yöntemin karşılaştırıldığı çeşitli çalışmalar mevcuttur16,23,24,25,26. İmmün yetmezlikli hastalardan alınan BAL ve indüklenmiş balgam örneklerinde PCR ve DFA testi ile P.jirovecii'nin araştırıldığı çalışmalarda; balgam örneklerinin %71'inde PCR ile, %50'sinde DFA testi ile organizma gösterilmiş; BAL-DFA testi negatif olanların beşinde PCR ile pozitiflik tespit edilmiş ve PCR'nin DFA testinden daha duyarlı olduğunu bildirilmiştir23,26. Roux ve arkadaşlarının16 BAL ve indüklenmiş balgam örneklerinde yaptıkları çalışmada, her iki testin de özgüllüğü %100 olarak saptanmış, duyarlılık değerleri ise DFA için %43, PCR için %86 olarak belirlenmiştir. İndüklenmiş balgam, ETA ve BAL örneklerinde yapılan diğer çalışmalarda da, DFA referans yöntem olarak alındığında PCR'nin duyarlılık, özgüllük, pozitif ve negatif prediktif değerleri sırasıyla %87.2-98.7, %92.2-94, %51.5-88.2 ve %96.9-9.7 olarak bildirilmektedir24,25. Bizim çalışmamızda ise DFA testi altın standart olarak alındığında; Giemsa boyama, PCR ve BDG yöntemlerinin duyarlılık ve özgüllük değerleri sırasıyla, %100 ve %100; %100 ve %93; %100 ve %67 olarak saptanmıştır.
Sonuç olarak, PCP ön tanılı hastaların laboratuvar tanısında, klinik örnekler Giemsa boyama ve DFA yöntemleri ile incelendiğinde özgüllük yüksek iken, BAL-PCR ve BDG testlerinin eklenmesiyle duyarlılık da yükselmektedir. Bu nedenle tanıda Giemsa boyama, DFA, PCR ve BDG testlerinin birlikte çalışılmasının uygun olacağı düşünülmüştür.
KAYNAKLAR
- Barlett MS, Smith JW. Pneumocystis carinii, an opportunist in immunocompromised patients. Clin Microbiol Rev 1991; 4(2): 137-49.
- Flori P, Bellete B, Durand F, et al. Comparison between real-time PCR, conventional PCR and different staining techniques for diagnosing Pneumocystis jirovecii pneumonia from bronchoalveolar lavage specimens. J Med Microbiol 2004; 53(7): 603-7.
- Sax PE, Komarow L, Finkelman MA, et al. Blood (1 → 3)--D-glucan as a diagnostic test for HIV-related Pneumocystis jirovecii pneumonia. Clin Infect Dis 2011; 53(2): 197-202.
- Tasaka S, Hasegawa N, Kobayashi S, et al. Serum indicators for the diagnosis of pneumocystis pneumonia. Chest 2007; 131(4): 1173-80.
- Walzer PD, Perl DP, Krogstad DJ, et al. Pneumocystis carinii pneumonia in the United States. Epidemiologic, diagnostic, and clinical features. Ann Intern Med 1974; 80(1): 83-93.
- Blic JD, Blanche S, Danel C, et al. Bronchoalveolar lavage in HIV infected patients with interstitial pneumonitis. Arch Dis Child 1989; 64(9): 1246-50.
- Pattishall EN, Noyes BE, Orentein DM. Use of bronchoalveolar lavage in immunocompromised children with pneumonia. Pediatr Pulmonol 1988; 5(1): 1-5.
- Rabodonirina M, Raffenot D, Cotte L, et al. Rapid detection of Pneumocystis carinii in bronchoalveolar lavage specimens from human immunodeficiency virus-infected patients: use of a simple DNA extraction procedure and nested PCR. J Clin Microbiol 1997; 35 (11): 2748-51.
- Kovacs JA, Allegra CJ, Beaver J, et al. Characterization of de novo folate synthesis in Pneumocystis carinii and Toxoplasma gondii: potential for screening therapetic agents. J Infect Dis 1989; 160(2): 312-20.
- Mathis A, Weber R, Kuster H, Speich R. Simplified sample processing combined with a sensitive one-tube nested PCR assay for detection of Pneumocystis carinii in respiratory specimens. J Clin Microbiol 1997; 35 (7): 1691-5.
- Elvin KM, Björkman A, Linder E, Heurlin N, Hjerpe A. Pneumocystis carinii pneumonia: detection of parasites in sputum and bronchoalveolar lavage fluid by monoclonal antibodies, BMJ 1988; 297 (6645): 381-4.
- Hauser PM, Bille J, Lass-Flörl C, et al. Multicenter, prospective clinical evaluation of respiratory samples from subjects at risk for Pneumocystis jirovecii infection by use of a commercial real-time PCR assay. J Clin Microbiol 2011; 49(5): 1872-8.
- Ribes JA, Limper AH, Espy MJ, Smith TF. PCR detection of Pneumocystis carinii in bronchoalveolar lavage specimens: analysis of sensitivity and specificity. J Clin Microbiol 1997; 35(4): 830-5.
- Caliendo AM, Hewitt PL, Allega JM, Keen A, Ruoff KL, Ferraro MJ. Performance of a PCR assay for detection of Pneumocystis carinii from respiratory specimens. J Clin Microbiol 1998; 36(4): 979-82.
- Sing A, Trebesius K, Roggenkamp A, et al. Evaluation of diagnostic value and epidemiological implications of PCR for Pneumocystis carinii in different immunosupressed and immunocompetent paient groups. J Clin Microbiol 2000; 38(4): 1461-7.
- Roux P, Lavrard I, Poirot JL, et al. Usefulness of PCR for detection of Pneumocystis carinii DNA. J Clin Microbiol 1994; 32(9): 2324-6.
- Tamburrini E, Mencarini P, Visconti E, et al. Detection of Pneumocystis carinii DNA in blood by PCR is not of value for diagnosis of P.carinii pneumonia. J Clin Microbiol. 1996; 34(6): 1586-8.
- Francisco MM, Koo S, Bryar J, Baden LR. (1→3)--D-Glucan assay positivity in patients with Pneumocystis carinii (jirovecii) pneumonia. Ann Int Med 2007; 147(1): 70-2.
- Persat F, Ranque S, Derouin F, Michel-Nguyen A, Picot S, Sulahian A. Contribution of the (1→3)--D-Glucan assay for diagnosis of invasive fungal infections. J Clin Microbiol 2008; 46(3): 1009-13.
- Bono VD, Mularoni A, Furfaro E, et al. Clinical evoluation of a (1→3)--D-Glucan assay for presumptive diagnosis of Pneumocystis jirovecii pneumonia in immunocompromised patients. Clin Vaccine Immunol 2009; 16(10): 1524-6.
- Desmet S, Van Wijngaerden E, Maertens J, et al. Serum (1→3)--D-Glucan as a tool for diagnosis of Pneumocystis jirovecii pneumonia in patients with human immunodeficiency virus infection or hematological malignancy. J Clin Microbiol 2009; 47(12): 3871-4.
- Held J, Koch MS, Reischl U, Danner T, Serr A. Serum (1→3)--D-glucan measurement as an early indicator of Pneumocystis jirovecii pneumonia and evaluation of its prognostic value. Clin Microbiol Infect 2011; 17(4): 595-602.
- Olsson M, Evlin K, Löfdahl S, Linder E. Detection of Pneumocystis carinii DNA in sputum and bronchoalveolar lavage samples by polymerase chain reaction. J Clin Microbiol 1993; 31(2):221-6.
- Chawla K, Martena S, Gurung B, Mukhopadhyay C, Varghese GK, Bairy I. Role of PCR for diagnosing Pneumocystis jirovecii pneumonia in HIV-infected individuals in a tertiary care hospital in India. Indian J Pathol Microbiol 2011; 54(2): 326-9.
- Azoulay E, Bergeron A, Chevret S, Bele N, Schlemmer B, Menotti J. Polymerase chain reaction for diagnosing pneumocystis pneumonia in non-HIV immunocompromised patients with pulmonary infiltrates. Chest 2009; 135(3): 655-61.
- Tamburini E, Mencarini P, Luca AD, et al. Diagnosis of Pneumocystis carinii pneumonia: specificity and sensitivity of polymerase chain reaction in comparison with immunofluorescence in bronchoalveolar lavage specimens. J Med Microbiol 1993; 38(6): 449-53.
İletişim (Correspondence):
Prof. Dr. A. Nedret Koç,
Erciyes Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
38039 Talas, Kayseri,
Türkiye. Tel (Phone): +90 352 437 4901-23379/20204,
E-posta (E-mail): anedret@erciyes.edu.tr