Yayma Negatif Tüberküloz Olgularının Tanısında MTD
Gen-Probe® Testi, BACTEC 960 Sistemi ve
Löwenstein-Jensen Kültür Yöntemlerinin Performansının Karşılaştırılması
Comparison
of Performances of MTD Gene-Probe® Test, BACTEC 960 System and
Löwenstein-Jensen
Culture Methods in the Diagnosis of Smear-Negative Tuberculosis Cases
Ayperen KUNDURACIOĞLU1, Işıl KARASU1, Can BİÇMEN2, Ayşe ÖZSÖZ1, Ahmet Emin ERBAYCU1
1 Dr. Suat Seren Göğüs Hastalıkları ve Cerrahisi Eğitim ve Araştırma Hastanesi, Göğüs Hastalıkları Kliniği, İzmir.
1 Dr. Suat Seren Chest Diseases and Surgery, Education and Research Hospital, Chest Diseases Clinic, Izmir, Turkey.
2 Dr. Suat Seren Göğüs Hastalıkları ve Cerrahisi Eğitim ve Araştırma Hastanesi, Mikrobiyoloji Laboratuvarı, İzmir.
2 Dr. Suat Seren Chest Diseases and Surgery, Education and Research Hospital, Microbiology Laboratory, Izmir, Turkey.
ÖZET
Bu çalışmada, tüberküloz (TB) şüpheli ve aside dirençli basil (ARB) yayma negatif hasta örneklerinde nükleik asit amplifikasyon temelli MTD (Mycobacterium tuberculosis direct test) Gen-Probe® sonuçlarının, otomatize BACTEC 960 (MGIT) sistemi ve Löwenstein-Jensen (LJ) besiyerinde kültür sonuçlarıyla karşılaştırılması amaçlanmıştır. Çalışmamızda ayrıca, akciğer TB'de moleküler yöntemin erken tanıya katkısı, hastalığın radyolojik yaygınlığının ve kaviteli/kavitesiz oluşunun moleküler tanı ve/veya kültürde üreme sürelerine etkisi değerlendirilmiştir. Çalışmaya, klinik ve radyolojik olarak akciğer TB ve/veya TB plörezi kuşkusu taşıyan, boyalı mikroskobik incelemesinde ARB negatif bulunan 107 hasta (86 erkek, 21 kadın; yaş ortalaması: 49.89 ± 17.1 yıl, yaş aralığı: 18-81 yıl) dahil edilmiştir. Örneklerin 65 (%60.7)'i balgam, 32 (%29.9)'si bronş aspirasyon sıvısı, 5 (%4.7)'i plevral sıvı ve 5 (%4.7)'i transtorasik ince iğne aspirasyon biyopsi materyalidir. Hasta örnekleri, aynı iş günü içerisinde sıvı otomatize BACTEC 960 (Becton Dickinson Co., ABD) sistemi ve katı LJ besiyerine ekilmiştir. MTD Gen-Probe testi (Gen-Probe Inc., ABD) ise laboratuvar tarafından belirlenen haftada iki ayrı iş gününde çalışılmıştır. Örnekler, BACTEC 960 cihazında pozitiflik saptanıncaya ve/veya LJ'de üreme görülünceye kadar, negatif kültürlerde ise 42 güne kadar inkübe edilmiştir. Kültürde üreme saptandığında, M.tuberculosis kompleks (MTBC)'in bakteriyolojik olarak tanımlanması ve TB dışı mikobakterilerden ayrımı, geleneksel yöntemler ve BACTEC 460 NAP testi ile yapılmıştır. Kırk beş (%42) hasta akciğer parankim TB (40 aktif akciğer TB, 1 miliyer TB ve 4 kültür negatif akciğer TB) tanısı alırken, 4 (%3.7) hastaya akciğer dışı TB ve 58 (%57.9) hastaya akciğer TB ile ilişkisiz diğer hastalıklara ait tanılar konulmuştur. Çalışmada, LJ kültür yöntemi ile akciğer TB'li 45 hastanın 32 (%71)'sinde, BACTEC 960 sistemiyle ise 38 (%84.4)'inde pozitif sonuç alınmıştır. Diğer taraftan MTD Gen-Probe yöntemiyle pozitiflik oranı %37.4 (40/107) olarak saptanmıştır. MTD Gen-Probe testinin duyarlılık, özgüllük, pozitif ve negatif prediktif değerleri sırasıyla %89, %100, %100 ve %93 olarak saptanmıştır. Bu değerler BACTEC 960 sistemi için sırasıyla %82, %98, %97 ve %88; LJ kültür yöntemi için ise sırasıyla %71, %100, %100 ve %83 olarak tespit edilmiştir. MTD Gen-Probe, BACTEC 960 ve LJ kültür yöntemleriyle tüberküloz tanısı konma süreleri sırasıyla; 2.36 gün, 20.11 gün ve 32.49 gün olarak belirlenmiştir. Sonuç verme süresi açısından karşılaştırma yapıldığında; MTD Gen-probe yöntemi LJ kültüründen üstün bulunmuş, BACTEC 960 sisteminin ise LJ kültürü ile benzer süreye sahip olduğu izlenmiştir. Klinik veriler değerlendirildiğinde, lezyonların radyolojik yoğunluğunun MTD Gen-Probe, BACTEC sistemi ve LJ kültür yöntemlerinin tanı süreleri üzerine etkisi saptanmamış; ancak kaviter lezyonlu hastalarda LJ kültürünün daha erken sürede pozitif sonuç verdiği izlenmiştir. Sonuç olarak, akciğer TB'nin erken tanısı, tedaviye erken başlanması, hastalığın ilerlemesinin önlenmesi ve toplum sağlığı açısından bulaşmanın engellenmesinde MTD Gen-Probe yönteminin, güvenilir ve hızlı bir tanı yöntemi olduğu kanısına varılmıştır.
Anahtar sözcükler: Tüberküloz; tanı; kültür; Löwenstein-Jensen; BACTEC 960; MTD Gen-Probe.
ABSTRACT
The aim of this study was to compare the results of nucleic acid amplification-based MTD (Mycobacterium tuberculosis direct test) Gene-Probe® method in samples obtained from acid-fast bacilli (ARB) smear-negative patients with suspected tuberculosis (TB), with the culture results obtained from automated BACTEC 960 (MGIT) system and Löwenstein-Jensen (LJ) medium. In addition, the contribution of molecular methods in early diagnosis of pulmonary TB and the effect of radiological prevalence of the disease associated with or without cavity to the molecular diagnosis and/or growth time in culture media have been evaluated. A total of 107 patients (86 male, 21 female; mean age: 49.89 ± 17.1 years, age range: 18-81 years) who were clinically and radiologically suspected of having pulmonary TB and/or TB pleurisy, were included in the study. Of the samples 65 (60.7%) were sputum, 32 (29.9%) were bronchial aspiration, 5 (4.7%) were pleural fluid, and 5 (4.7%) were transthoracic fine needle aspiration biopsy materials. Patient samples were cultured in solid LJ media and liquid-based BACTEC 960 system (Becton Dickinson Co., USA) in the same working day. Meanwhile, MTD Gen-Probe test (Gen-Probe Inc., USA) was studied in two separate working days of the week as specified by the laboratory. The samples were incubated until positivity was determined in BACTEC 960 system and/or growth was detected in LJ medium. Negative cultures were incubated for 42 days and were finalized. When mycobacterial growth was determined in the culture, identification of M.tuberculosis complex (MTBC) and differentiation from nontuberculous mycobacteria were performed by conventional methods and BACTEC 460 NAP test. Forty five (42%) patients were diagnosed as pulmonary paranchimal TB (40 were active pulmonary TB, 1 was miliary TB and 4 were culture-negative pulmonary TB), while 4 (3.7%) patients diagnosed as extrapulmonary TB and 58 (57.9%) patients were diagnosed as other pulmonary diseases unrelated with TB. LJ cultures yielded positive results in 32 of 45 (71%) pulmonary TB patients, and BACTEC 960 were found positive in 84.4% (38/45) of those patients. On the other hand the positivity rate of MTD Gen-Probe test was detected as 37.4% (40/107). The sensitivity, specificity, positive and negative predictive values for MTD Gen-Probe test were estimated as 89%, 100%, 100% and 93%, respectively. Those values for BACTEC 960 system were found as 82%, 98%, 97% and 88%, and for LJ culture method as 71%, 100%, 100% and 83%, respectively. Average periods to make a decision for diagnosis of TB by MTD Gen-Probe, BACTEC 960 (MGIT) and LJ culture methods were calculated as 2.36 days, 20.11 days and 32.49 days, respectively. In comparison of the methods in terms of turnaround times, MTD Gen-Probe test was found superior to LJ culture method, however the turnaround times for BACTEC 960 and LJ culture methods were similar. When the clinical data were evaluated, no effect of radiological density of lesion was identified on the diagnosis time of molecular test and time of growth in liquid based automated BACTEC system and/or LJ culture method. However, LJ culture demonstrated earlier reactivity in patients with cavitary lesions. As a result, MTD Gene-Probe test was observed as a reliable and rapid method for the early diagnosis of pulmonary TB patients, early initiation of therapy, prevention of disease progression and transmission.
Key words: Tuberculosis; diagnosis; culture; Löwenstein-Jensen; BACTEC 960; MTD Gen-Probe.
Geliş Tarihi (Received): 04.03.2013 • Kabul Ediliş Tarihi (Accepted): 25.06.2013
GİRİŞ
Akciğer tüberkülozunun tanısında en yaygın kullanılan ve hızlı sonuç veren yöntem, aside dirençli basil (ARB) boyama olmakla birlikte sıklıkla balgam olarak alınan klinik örnek, basil miktarı az ise negatif sonuç vermektedir1. Tüberküloz (TB) tanısında altın standart kültürdür. Klinik laboratuvarlarda en sık kullanılan Löwenstein-Jensen (LJ) besiyeri kullanılır, ancak besiyerinin opak görünümü nedeniyle görsel olarak üremenin fark edilmesi daha zordur ve inkübasyon zamanı (ortalama 4-8 hafta) daha uzundur. Duyarlılığı %92.7, kontaminasyon oranı %4 olarak belirtilmekle birlikte, kullanılan besiyeri ve klinik örneğin tipine göre büyük değişim göstermektedir2. Boyalı preparatlarda bakterilerin görülebilmesi için örnekte 5000-10.000 basil/ml, pozitif kültür için ise 10-100 basil/ml bulunması gereklidir3. Tüm örnekler (solunum ve solunum yolu dışı) göz önüne alındığında, sıvı besiyeri bazlı otomatize sistemler ve LJ besiyerinde Mycobacterium tuberculosis izolasyon oranları %74-98 arasında değişmektedir4. Ancak, solunum yolu dışındaki örneklerin kültüründe izolasyon oranları düşmekte; bu oranlar plevra sıvılarda %12-70, ince iğne aspirasyon biyopsi örneğinde %39-80, beyin omurilik sıvısı (BOS)'nda %39-90, sinovyal sıvıda < %80 ve üç sabah idrar örneğinde < %90 olarak bildirilmektedir5,6,7.
Günümüzde TB tanısında, geleneksel katı bazlı besiyerlerinin yanı sıra hazır ticari otomatize sıvı bazlı sistemler kullanılmaktadır. Bactec 960 (MGIT) tam otomatize bir sistem olmakla birlikte, ultraviyole ışığı altında makroskobik olarak da değerlendirme yapılabildiğinden manüel olarak kullanılmaya da uygundur. Kan dışındaki diğer tüm klinik örnekler için kullanılabilmektedir. Sıvı bazlı otomatize sistemler ile daha hızlı, standart ve otomasyona dayalı sonuçlar alınabilmektedir8.
Moleküler yöntemler de, mikobakterilerin klinik örnekten tanısında, tür düzeyinde tanımlanmasında, ilaç direncinin belirlenmesinde ve epidemiyolojik araştırmalarda geniş uygulama alanı bulmuştur. İzotermal bir amplifikasyon yöntemi olan MTD (Mycobacterium tuberculosis direct test; Gen-Probe), transkripsiyon aracılı çoğaltma temeline dayanan bir testtir9. MTD Gen Probe testi, canlı ve cansız hücrelerdeki rRNA'yı ayıramadığından tedavi almış hasta örneklerinde kullanılamamaktadır. Zira antitüberküloz tedavi sırasında kültürde üretilemeyen mikroorganizmalar solunum yolu sekresyonlarında yerleşmiş olabilir. Pozitif bir MTD sonucunun mikroorganizmanın canlılığı ile uyumlu olmaması nedeniyle tedavinin izlenmesinde kullanılması yararlı olmayacaktır10.
Direkt muayenede ARB pozitifliği ile birlikte bu testlerin pozitif bulunması TB tanısını desteklerken, her iki test sonucunun negatif olması, kültürde M.tuberculosis üreme olasılığından uzaklaştırmaktadır9. Direkt muayene ve moleküler yöntemlerin birbirlerini desteklemesi klinik tanıyı kolaylaştırırken, sonuçların farklı olması durumunda, klinik tabloya göre tanı konulmakta veya testin tekrarlanması gerekmektedir9. Tanısı kesinleşmemiş ancak aktif TB hastalığı semptomları gösteren hastalarda algoritmalar nükleik asit amplifikasyon (NAA) testinin kullanılmasını önermektedir11. Bu test TB hastalarının %20-50'sinde tedavi başlama kararını verdirmekte ya da gereksiz tedaviyi engellemektedir12,13.
Bu çalışmada, klinik ve radyolojik olarak TB kuşkusu olan, ancak ARB yayması negatif hastaların pulmoner örneklerinde MTD Gen-Probe® testinin, akciğer TB tanısındaki duyarlılık ve özgüllüğünün araştırması, sonuç raporlama sürelerinin BACTEC 960 (MGIT) sistemi ve LJ kültür sonuç süreleriyle karşılaştırılması amaçlanmıştır. Ayrıca, kültür pozitif hastalarda moleküler yöntemin erken tanıya katkı ve avantajı, hastalığın radyolojik yaygınlığının ve kaviteli/kavitesiz oluşunun moleküler tanı ve/veya kültürde üreme sürelerine etkisi değerlendirilmiştir.
GEREÇ ve YÖNTEM
Hastalar
Çalışmaya, klinik ve radyolojik olarak akciğer TB ve/veya TB plörezi kuşkusu taşıyan, boyalı mikroskobik incelemesinde ARB negatif bulunan hastalar dahil edildi. Hastalardan alınan örnekler (balgam, bronş aspirasyonu, plevral sıvı, transtorasik iğne aspirasyon biyopsisi) boyalı mikroskobik inceleme sonrasında LJ katı besiyeri kültürü, BACTEC 960 (MGIT) sıvı besiyeri kültürü ve MTD Gen-Probe moleküler tanı yöntemleriyle değerlendirildi. Akciğer parankim TB tanısı alan hastaların akciğer grafileri yaygınlık derecesine, ayrıca kaviteli/kavitesiz oluşuna göre gruplandırıldı. Eski lezyonlar ve/veya bir bronkopulmoner segmente eşit ya da daha az alanda aktif görünümlü lezyonlar "hafif", bir bronkopulmoner segmentten daha fazla fakat bir lobtan daha az veya eşit alan kaplayan lezyonlar "orta", bir lobtan daha fazla tutulum gösteren lezyonlar "yaygın" olarak değerlendirildi. Lezyonların yaygınlık derecesinin tanı süresine etkisi ve lezyonda kavite varlığının tanı süresine etkisi ayrı ayrı değerlendirildi.
Örnek Toplanması ve Mikrobiyolojik İnceleme
Hastaların sabah ağız temizliği yapıldıktan sonra öksürülerek çıkarılan balgam örneği steril kaplarda, diğer örnekler ya enjektörde ya da steril cam veya polietilen düz tüplerde laboratuvara ulaştırıldı. Örnekler, yayma ve kültür için hazırlandıktan sonra, gerekli miktarda örnek ependorflara alınarak moleküler tanı amaçlı olarak -20°C'de saklandı ve biriktirilerek haftada iki gün olacak şekilde çalışıldı.
Çalışmaya alınan tüm örneklerden aside dirençli boyama için preparat hazırlandı. Balgam örneğinde partiküllü, varsa nekroze doku içeren koyu renkli bölgelerinden yaymalar hazırlandı. Havada kurutularak tesbit edildi ve Kinyoun boyama yöntemiyle boyandı14. Mavi zeminde pembe-kırmızı basiller ARB pozitif olarak kabul edildi ve basil izlenmeyen örneklerde çalışma sürdürüldü.
Tüm örneklere (steril vücut boşluklarından alınan örnekler hariç) ekim işlemine geçilmeden önce ticari olarak sağlanan kit (MycoProsafe, Salubris AŞ, Türkiye) ile N-asetil-L-sistein-sodyum hidroksit yöntemiyle homojenizasyon ve dekontaminasyon işlemi uygulandı. İşlemlenen örneğin 0.5 ml'si MGIT tüplerine ekilerek BACTEC 960 cihazına (Becton Dickinson Co., ABD) yüklendi. Örneklerin 0.1 ml'si aynı zamanda LJ besiyerine de ekildi. LJ besiyerleri haftada iki gün TB basili üremesi yönünden görsel olarak değerlendirildi. Örnekler, BACTEC cihazında pozitiflik saptanıncaya ve/veya LJ'de üreme görülünceye kadar, negatif kültürlerde ise 42 güne kadar inkübe edildi. Kültürde üreme saptandığında, atipik mikobakterilerin ayrımı için geleneksel yöntemler (mikroskopide kord oluşumu, üreme zamanı, pigment oluşumu, koloni morfolojisi vb.) ve BACTEC 460 NAP (p-nitro-a-acetylamino-b-hydroxypropiophenone) testi kullanıldı.
Moleküler Tanı
Bu amaçla kullanılan MTD (M.tuberculosis direct test) yöntemi, M.tuberculosis kompleks (MTBC) rRNA'sını kalitatif olarak araştıran ve transkripsiyon bazlı amplifikasyon (Transcription-Mediated Amplification; TMA) ile hibridizasyon bazlı selektif tanı yöntemi (Hibridization Protection Assay; HPA) prosedürlerinin birleştirildiği bir testtir.
Klinik örnekler çalışmaya alınmadan önce modifiye bir NALC-NaOH dekontaminasyon işleminden (%1-1.5 NaOH kullanılır) geçirildi ve sonra santrifüj edildi. Örneğin miktarına göre, dipten yaklaşık 500-1000 µl sediment ependorf tüplere alınarak çalışılıncaya kadar -20°C'de bekletildi ve 450 µl'si çalışmaya alındı. Moleküler çalışmada üretici firmanın önerileri doğrultusunda "Amplified Mycobacterium tuberculosis Direct Test" kiti (AMTDT) (Gen-Probe Inc., ABD) kullanıldı. Prosedürde, lizis, amplifikasyon, hibridizasyon, seleksiyon ve tanı basamakları uygulandı. Gen-Probe Leader lüminometre kullanılarak kemilüminesan yöntem ile ölçüm yapıldı. Sonuçlar bağıl ışık birimi (relative light unit, RLU) cinsinden saptandı. MTBC rRNA varlığı için, 30000-499999 RLU arasındaki değerler kuşkulu sınır; < 30000 RLU olan değerler negatif; ≥ 500000 RLU olan değerler ise pozitif olarak kabul edildi. Tüm kuşkulu sonuçlar yinelendi ve ≥ 30000 RLU bulunanlar pozitif, < 30000 RLU bulunanlar negatif olarak değerlendirildi15. Bu sonuçlar, diğer mikrobiyolojik tetkik sonuçları, klinik, radyolojik ve histopatolojik bulgularla birleştirilerek irdelendi.
İstatistiksel Analiz
Veriler SPSS 15.0 ve MedCalc 9.5.2.0 istatistik programlarıyla değerlendirildi. Yöntemlerin duyarlılık, özgüllük, pozitif ve negatif prediktif değerleri saptandı. Testlerin tanısal değeri için ROC eğrileri çizilip eğrinin altında kalan alanları karşılaştırıldı. Verilerin dağılımı Kolmogorov Smirnov testi ile değerlendirildi; normal dağılıma uyan verilere tek yönlü varyans analizi, uymayanlara Kruskal Wallis varyans analizi uygulandı. Kruskal Wallis testinde belirlenen farklılıkları saptamak için ikili gruplar Mann-Whitney U testi ile değerlendirilip, sonuçlar Bonferroni düzeltmesi uygulanarak yorumlandı. p< 0.05 değeri anlamlı olarak kabul edildi.
BULGULAR
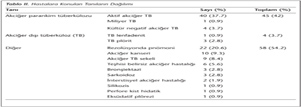
Çalışmaya ARB negatif 107 hasta dahil edilmiş ve hastaların demografik ve klinik özellikleri Tablo I'de verilmiştir. Hastaların 30 (%28)'unda tek, 77 (%72)'sinde birden fazla semptom mevcut olup, 43 (%40.2) hastada altta yatan hastalık varlığı tespit edilmiştir (Tablo I). Hastalara konulan tanıların dağılımı Tablo II'de görülmektedir. Hastalardan alınan örneklerin 65 (%60.7)'i balgam, 32 (%29.9)'si bronş aspirasyon sıvısı, 5 (%4.7)'i plevral sıvı ve 5 (%4.7)'i transtorasik ince iğne aspirasyon biyopsi materyalidir.
TB plörezi tanılı hastalarda plevral sıvı bakteriyolojik incelemelerinde kültür ve MTD Gen-probe negatif bulunmuştur. Histopatolojik olarak TB lenfadenit tanısı alan bir hastada lenf bezi örneğinin bakteriyolojik incelemesi yapılamamıştır. Kültür negatif akciğer TB olan dört hastadan ikisinin tanısı histopatolojik inceleme ile, ikisinin tanısı ise klinik ve radyolojik bulgulara göre konulmuş; bu hastalarda MTD Gen-probe testi ile de negatif sonuç alınmıştır.
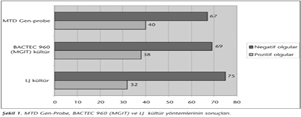
Akciğer TB'li 45 hastanın 32 (%71)'sinde LJ kültürü pozitif, 13 (%29)'ünde negatif bulunmuş; buna karşın BACTEC 960 ile 38 (%84.4) hastada pozitif, 7 (%15.6) hastada negatif sonuç alınmıştır. MTD Gen-Probe 40 (%37.4) hastada pozitif, 67 (%62.6) hastada negatif sonuç vermiştir (Şekil 1).
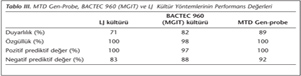
Tüm yöntemlerin akciğer TB için tanısal değeri ROC eğri analiziyle değerlendirildiğinde, her bir yöntemin tanısal açıdan değerli olduğu saptanmıştır (her biri için p= 0.001) (Şekil 2). Yöntemlerin, hesaplanan duyarlılık, özgüllük, negatif ve pozitif prediktif değerleri Tablo III'te gösterilmiştir. Sonuç verme süresi açısından karşılaştırma yapıldığında; MTD Gen-probe yöntemi LJ kültüründen üstün bulunmuş, BACTEC 960 sisteminin ise LJ kültürü ile benzer süreye sahip olduğu izlenmiştir (Tablo IV).
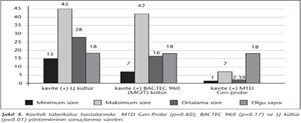
Akciğer grafisinde lezyonların dağılımının TB tanısı alan hastalarda süreye etkisi değerlendirilmiş, iki hasta eşlik eden plevral sıvı nedeniyle değerlendirme dışı bırakılmıştır. Belirlenen lezyonların yaygınlık derecesine göre kültür yöntemlerinde pozitiflik elde etme süreleri karşılaştırıldığında, lezyonların dağılım yoğunluğunun kültür pozitifliğine etkisi bulunmamıştır (Kruskal Wallis, p> 0.05) (Şekil 3).
Akciğer parankim TB tanısı alan 45 hastadan 18 (%40)'inde akciğer grafisinde kaviter lezyon izlenmiştir. Kavite varlığının tanı yöntemlerinde pozitifleşme süresine katkısı değerlendirildiğinde, kaviter lezyonlu hastalarda LJ kültürü, kaviter lezyonu olmayanlara göre daha erken sürede pozitif sonuç vermiştir (p= 0.01). Kaviter lezyon varlığı BACTEC 960 ve MTD Gen-Probe pozitifleşme süresine etki etmemiştir (sırasıyla; p= 0.17 ve p= 0.60) (Şekil 4).
TARTIŞMA
Dünya genelinde 2007 yılında yeni yayma pozitif hastalar için olgu saptama oranı (%70) ve tedavi başarısı oranı (%85) hedeflerine 36 ülke ve Batı Pasifik Bölgesi ulaşmıştır. Türkiye, hem olgu saptama hem de tedavi başarısında Dünya Sağlık Asamblesinin hedeflerini geçerek, hedeflenen bölgeye ulaşmış 36 ülkeden birisi olmuştur16. TB şüphesi olup balgam ARB boyaması negatif olan hastalarda ileri tetkikler önerilmektedir. Günümüzde TB teşhisi için altın standart kültürdür. LJ besiyerinde mikobakterilerin büyük çoğunluğunun, MTBC de dahil olmak üzere bölünme zamanı uzundur17. Bu nedenle mikobakterilerin klasik yöntemlerle üretilmesi, tür düzeyinde tanımlanması ve duyarlılık testlerinin sonuçlanması için ortalama 45-60 günlük süreye gereksinim duyulur18. Erken tanının sağlanabilmesi amacıyla son 10 yıl içinde özgüllük ve duyarlılığı yüksek, güvenilir ve hızlı sonuç verebilen, kolay uygulanabilir yeni yöntemler üzerinde çalışılarak otomasyona uygun birçok sistem geliştirilmiştir18.
Önceki yıllarda TB tanısında kullanılan NAA testlerinden ikisi FDA tarafından onay almıştır. Bunlardan otomatize PCR yöntemi sadece yayma pozitif solunum yolu örneklerinde onaylanmışken, MTD Gen-Probe testi hem yayma pozitif hem de negatif solunum yolu örneklerinde onay almıştır19,20. Günümüzde ise çok sayıda ticari olarak sağlanan farklı CE ve/veya FDA onaylı NAA testi rutin kullanıma sunulmuştur21,22,23. Ancak moleküler yöntem tanı amaçlı kullanılacak ise mutlaka kültür metodları ile desteklenmelidir. Katı ve sıvı bazlı kültür ortamlarının birlikte kullanılması TB tanı duyarlılığını artırmaktadır. Hastanın kliniği üçüncü bir parametre olarak değerlendirilebilir18. Bizim çalışmamızda da, tüm hasta örneklerinde, katı LJ ve sıvı otomatize BACTEC 960 (MGIT) kültür ortamları ile moleküler yöntem olarak MTD Gen-Probe testi birlikte kullanılmış; tüm hastaların TB tanısı, laboratuvar sonuçlarının klinik ve radyolojik bulgular ile birlikte değerlendirilmesiyle doğrulanmıştır.
Moleküler yöntem sonuçları; örnek cinsi, hasta popülasyonu, hasta özellikleri (örn. TB tedavisi uygulanması), teknik personelin deneyimi, laboratuvarın alt yapısı ve seçilen yöntemin teknik özellikleri gibi nedenlere bağlı olarak değişkenlik gösterebilmektedir. MTD'nin duyarlılık ve özgüllüğü yayma pozitif örnekler için %100, negatifler için %91.7'dir24. Genel olarak tüm pulmoner örneklerde yapılan çalışmalarda duyarlılık, özgüllük, pozitif prediktif değer (PPD) ve negatif prediktif değerler (NPD) sırasıyla %88-97, %90.4-100, %93.9-99.1 ve %90-99.2 arasındadır24,25,26. Coll ve arkadaşları27, TB tanısı alan yayma negatif hastalarda duyarlılığı %69.7, özgüllüğü %99.9, PPD'yi %96 ve NPD'yi %97.9 olarak bildirmiştir. Otuz bir ekstrapulmoner ve 56 pulmoner yayma pozitif ve negatif, toplam 87 hasta ile yapılmış bir klinik çalışmada, TB ön tanılı hastaların pulmoner örneklerinde ARB mikroskopi, kültür ve MTD yöntemlerinde duyarlılık sırasıyla %62.8, %82.8 ve %97.1; özgüllük sırasıyla %90.4, %100 ve %90.4; PPD %91.6, %100 ve %94.4; NPD ise %59.3, %77.7 ve %95 olarak bulunmuştur26. Çalışmamızda elde edilen duyarlılık, özgüllük, PPD ve NPD sırasıyla MTD Gen-Probe testi için %89, %100, %100 ve %93; BACTEC 960 kültürü için %82, %98, %97 ve %88; LJ kültürü için ise %71, %100, %100 ve %83 olarak saptanmış ve sonuçlar literatürle uyumlu bulunmuştur. Yapılan araştırmalarda, MGIT ve LJ yöntemlerinin benzer sonuçlar verdiği belirtilmektedir28,29. Çalışmamızın verileri de bu sonuçlarla uyumludur.
Moleküler yöntemlerin geleneksel yöntemlerden daha duyarlı olması nedeniyle daha az basil yükünün bulunduğu örneklerde geleneksel yöntemlerle yayma negatif bulunmasına rağmen moleküler yöntemler pozitif bulunabilmektedir26,30,31. Coll ve arkadaşları27, beş yıllık periyotta 3308 pulmoner ve 1350 ekstrapulmoner örnekte MTD Gen-Probe yöntemini yayma negatif ve pozitif hastalarda rutin olarak kullanmışlardır. TB tanısı alan yayma negatif 53 hasta MTD ve kültür pozitif bulunmuş, yayma negatif, MTD negatif 23 hasta kültür pozitifliği ile TB tanısı almıştır27. Yayma negatif-MTD negatif-kültür negatif iki hasta klinik olarak TB tanısı almış olup yayma-MTD-kültür negatif 2993 hastada TB tanısı dışlanmıştır. Yüz seksen beş hastanın kültüründe MTBC üremiş ve üreme olan bu hastaların 184'ünde MTD pozitif bulunmuştur27. Bizim çalışmamızda klinik son tanı olarak TB tanısı alan 45 hastanın 40'ında MTD pozitif, 38'inde BACTEC 960 pozitif, 32'sinde LJ pozitif bulunmuştur. Çalışmamızda yüksek olasılıkla TB kuşkusu devam eden, kültürleri ve MTD negatif olan hastalarda invazif tanı yöntemleri de kullanılmış ve iki hasta operasyonla histopatolojik olarak akciğer parankim TB tanısı almıştır. İki hasta radyolojik ve klinik olarak yüksek olasılık bulundurduğundan radyolojik akciğer TB ve bir hasta miliyer akciğer TB tanısı almıştır.
TB'de tanı süresinin önemi ile ilgili olarak, hasta, doktor ve kurum gecikmesini değerlendiren çalışmalar yapılmış olup gecikme süreleri oldukça yüksek bulunmuştur. Özellikle atipik bulguları olan hastalarda laboratuvar sonuçlarının uzun sürede çıkması tanıyı geciktirmektedir32,33. Test süresini kısaltmak için geliştirilen hızlı kültür yöntemleri ile süre ancak yarıya indirilebilmiştir. LJ ile MTD Gen-Probe arasındaki tanıya ulaşmadaki süre farkı anlamlıdır. Çeşitli çalışmalarda, hem yayma pozitif hem de yayma negatiflerde MGIT besiyerinde üreme süresi LJ'ye göre anlamlı derecede kısa bulunmuştur28,29,34. Moore ve arkadaşlarının35 MTD Gen-Probe testini rutin kullandıkları çalışmada ARB yayma, MTD Gen-Probe, BACTEC 460, LJ ve Middlebrook 7H11S besiyerlerinde üreme için geçen süre sırasıyla 1, 2, 19, 32, 35 gün olarak bulunmuştur. Çalışmamızda MTD Gen-Probe, BACTEC 960 ve LJ ile TB tanısı koyma süreleri sırasıyla 2.36, 20.11 ve 32.49 gün olarak saptanmıştır.
Moore ve arkadaşları35 TB şüphesi taşıyan hastaların %75'inde raporlama zamanını MTD Gen-Probe ile dört gün, BACTEC 460 ile 22 gün olarak bildirmişlerdir. Gen-Probe testinin sonuçlanma süresi ortalama 3.5 saat olmasına karşılık, maliyet-etkin olabilmesi ve örnek sirkülasyonuna göre çalışılabilmesi için laboratuvarımızda çalışma günleri haftada iki gün olarak sınırlandırılmıştır. MTD Gen-Probe sonuç raporlama süresi TB tanısı alan ve almayan hastalarda sırasıyla 2.36 ve 2.31 gün olarak bulunmuştur. Testin çalışıldığı gün sonuçlanma süresinin saatler ile sınırlı olmasına karşılık bizim çalışmamızdaki sürenin 2-3 gün arasında bulunmasının nedeni laboratuvarda her gün çalışma yapılmıyor olmasına bağlanmıştır. Literatürde daha önce MTD tanı süresi konusunda yapılmış klinik çalışması bulunmadığından daha fazla çalışma ile karşılaştırma yapılamamıştır. Moleküler yöntemlerle ilgili yapılan maliyet-etkinlik analizleri, hasta popülasyonu, örnek sirkülasyonu, bölgesel özellikler gibi nedenlerle değişmekte olup her kurum ve laboratuvarın kendi koşullarını belirleyerek buna göre bir algoritma oluşturması gerekmektedir. Rutin pratikte uygulanan testler TB'li hastalarda tedavi başlama kararını %20-50 oranında verdirmekte veya yanlış tedavi oranını azaltmaktadır. Bu nedenle, uygun şekilde ve standardı kanıtlanmış yöntemlerin kullanılması uzun dönemde maliyetlerin düşmesini sağlamaktadır12,13.
Dowdy ve arkadaşlarının36 yayma pozitif 852 hastada MTD Gen-Probe tekniği ile yapılan maliyet analizi çalışmasında duyarlılık, özgüllük, PPD ve NPD literatür ile benzerdir. Ancak yayma pozitif hastalarda haftada altı gün çalışılan MTD Gen-Probe ile maliyetin yüksek olduğu, bu nedenle yayma pozitif hastalarda rutin kullanımına gerek olmadığı belirtilmiştir36. MTD testinin rutin kullanımında dört faktörün göz önünde bulundurulması önerilmiş; test edilecek popülasyonda rölatif TB prevalansı, bir yılda işlemlenen yayma pozitif örneklerin sayısı, bir hastanın hastanede izole edilerek yatırılmasının maliyeti ve test reaktiflerinin maliyeti gibi değerler ele alındığında, bu faktörlerden ikisi MTD testinin yapılmasını destekliyorsa TB'nin standart tanısal değerlendirmesinde maliyet-etkin bir seçenek olarak kullanılabileceği düşünülmüştür36. Atipik mikobakteri enfeksiyonunun sık karşılaşıldığı bölgelerde klinik ve radyolojik olarak yüksek olasılıkla TB enfeksiyonu düşünülen yüksek riskli hastalarda günler içerisinde tanıya ulaşılabilmesi açısından testin kullanımı önerilmiştir36. Bizim çalışmamızda da, maliyetin yüksek olmaması için sadece klinik ve radyolojik olarak yüksek olasılıkla akciğer TB düşünülen yayma negatif hastalar araştırmaya dahil edilmiştir.
Ateş ve arkadaşlarının37 çalışmasında, radyolojik olarak kavite varlığının olması ve eşlik eden ek hastalığın bulunması ile balgam ARB pozitifliği arasında korelasyon olduğu saptanmıştır. Diğer bir çalışmada ise, radyolojik bulguların yaygınlığının, kavite varlığı ve kültür sonuçları ile ilişkisi olmadığı gösterilmiştir34. Bizim çalışmamızda, radyolojik yaygınlığın tanı yöntemlerinin sonuçlarına ve sürelerine etkisinin olmadığı, kaviteli hastalarda sadece LJ kültür sonucunun daha erken pozitif saptandığı belirlenmiştir.
Sonuç olarak, akciğer TB'li hastaların erken tanısı, tedavinin erken başlaması, hastalığın ilerlemesinin önlenmesi ve toplum sağlığı açısından bulaşın engellenmesinde MTD Gen-Probe yöntemi, literatüre paralel olarak güvenilir hızlı bir tanı yöntemi olarak bulunmuştur. TB tanısında kullanılan yöntemler mutlaka klinik verilerle beraber değerlendirilmeli, kurumsal ve bölgesel koşullar, örnek ve hasta özellikleri değerlendirilerek maliyet-etkinlik analizleri yapılmalı, erken ve hızlı tanının sağlanabilmesi için katı ve sıvı bazlı besiyerlerinin beraber kullanımının yanı sıra moleküler yöntemler için uygun algoritmaların geliştirilmesi ve güncellenmesi gerekmektedir.
KAYNAKLAR
- Özdemir Ö. Tüberkülozda tanı yöntemleri. Turkiye Klinikleri J Med Sci 1994; 14(6): 420-4.
- Ceyhan İ, Şimşek H, Tarhan G. Tüberkülozun tanısında %2 ogawa besiyerinin löwenstein-jensen besiyeri ile karşılaştırılması ve değerlendirilmesi. Mikrobiyol Bul 2012; 46(1): 33-8.
- Pyffer GE, Brown-Elliot BA, Wallace RJ Jr. Mycobacterium: general characteristics, isolation and staining procedures, pp: 532-59. In: Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH (eds), Manual of Clinical Microbiology. 2003, 8th ed. ASM Press, Washington, DC.
- Drobniewski FA, Caws M, Gibson A, Young D. Modern laboratory diagnosis of tuberculosis. Lancet Infect Dis 2003; 3(3): 141-7.
- Chakravorty S, Sen MK, Tyagi JS. Diagnosis of extrapulmonary tuberculosis by smear, culture and PCR using universal sample processing technology. J Clin Microbiol 2005; 43(9): 4357-62.
- Golden MP, Vikram HR. Extrapulmonary tuberculosis: an overview. Am Fam Physician 2005; 72(9): 1761-8.
- Portillo-Gómez L, Morris SL, Panduro A. Rapid and efficient detection of extra-pulmonary Mycobacterium tuberculosis by PCR analysis. Int J Tuberc Lung Dis 2000; 4(4): 361-70.
- Kurtoğlu MG, Özdemir M, Keşli R, Özkalp B, Baysal B. Tüberküloz şüpheli hastalardan Mycobacterium tuberculosis kompleks izolasyon oranı ve suşların BACTEC NAP ve immünokromatografik TB Ag MPT64 Rapid testleri ile tanımlanması. Mikrobiyol Bul 2011; 45(2): 266-73.
- Esen N. Tanı ve ilaç duyarlılık testlerinde moleküler yöntemlerin değeri. 21. Yüzyılda Tüberküloz Sempozyumu, 11-12 Haziran 2003, Samsun. Sempozyum Kitabı, s: 402-8.
- Gen-Probe Inc. Amplified Mycobacterium tuberculosis Direct Test. Gen-Probe7 Package Insert (IN0014 Rev L.) 2001, San Diego, CA. Available at: http://www.gen-probe.com/pdfs/pi/IN0014.pdf
- Centers for Disease Control and Prevention. Updated guidelines for the use of nucleic acid amplification tests in the diagnosis of tuberculosis. MMWR Morb Mortal Wkly Rep 2009; 58(1): 7-10.
- Guerra RL, Hooper NM, Baker JF, et al. Use of the amplified Mycobacterium tuberculosis direct test in a public health laboratory: test performance and impact on clinical care. Chest 2007; 132(3): 946-51.
- Taegtmeyer M, Beeching NJ, Scott J, et al. The clinical impact of nucleic acid amplification tests on the diagnosis and management of tuberculosis in a British hospital. Thorax 2008; 63(4): 317-21.
- Zhao D, Yang XM, Chen QY, Zhang XS, Guo CJ, Che XY. A modified acid-fast staining method for rapid detection of Mycobacterium tuberculosis. J Microbiol Methods 2012; 91(1): 128-32.
- U.S. Food and Drug Administration. Approval Order, 1999. Available at: http://www.fda.gov/ohrms/dockets/dailys/00/feb00/021700/aav1.pdf
- T.C. Sağlık Bakanlığı. Dünya Sağlık Örgütü "Küresel TB Raporu, 2009"da Dünya ve Türkiye. Erişim: http://verem.org.tr/pdf/DSO_2009_raporunda_TB.pdf
- Palomino JC. Nonconventional and new methods in the diagnosis of tuberculosis: feasibility and applicability in the field. Eur Respir J 2005; 26(2): 339-50.
- Saniç A. Tüberküloz tanısında moleküler yöntemlerin yeri. ANKEM Derg 2007; 21(Ek 2): 81-5.
- Centers for Disease Control and Prevention. Nucleic acid amplification tests for tuberculosis. MMWR Morb Mortal Wkly Rep 1996; 45(43): 950-2.
- Centers for Disease Control and Prevention. Update: Nucleic acid amplification tests for tuberculosis. MMWR Morb Mortal Wkly Rep 2000; 49(26): 593-4.
- Madhukar PM, Minion J, Sohn H, Zwerling A, Perkins MD. Novel and improved technologies for tuberculosis diagnosis: progress and challenges. Clin Chest Med 2009; 30(4): 701-16.
- Sharma N, Sharma V, Singh PR, et al. Tuberculosis and molecular diagnosis. Article ID: WMC003992. Available at: http://www.webmedcentral.com/wmcpdf/Article_WMC003992.pdf
- Centers for Disease Control and Prevention. Report of an expert consultation on the uses of nucleic acid amplification tests for the diagnosis of tuberculosis. 2008. Available at: http://www.cdc.gov/tb/publications/guidelines/amplification_tests/amplification_tests.pdf
- Biçmen C, Coşkun M, Gündüz AT ve ark. Klinik örneklerden Mycobacterium tuberculosis kompleks tanısında MTD (Gen-Probe) sonuçlarının değerlendirilmesi. İzmir Göğüs Hastanesi Derg 2006; 20(3): 61-9.
- Dorronso I, Navascues A, Gastesi C, et al. Evaluation of the MTD2 test for the direct detection of Mycobacterium tuberculosis in specimens. An Sist Sanit Navar 2005; 28(3): 351-6.
- Artan MO, Kılıç H, Özbal Y, Gülmez İ. Tüberkülozun tanısında kullanılan amplified Mycobacterium tuberculosis direct testin uygulanması ve konvansiyonel yöntemlerle karşılaştırılması. CÜ Tıp Fakültesi Derg 2005; 27(1): 5-10.
- Coll P, Garrigo M, Moreno C, et al. Routine use of Gen-Probe Amplified Mycobacterium tuberculosis Direct (MTD) test for detection of Mycobacterium tuberculosis with smear-positive and smear-negative specimens. Int J Tuberc Lung Dis 2003; 7(9): 886-91.
- Phyffer GE, Welscher HM, Kissling P, et al. Comparison of Mycobacteria Growth Indicator Tube (MGIT) with radiometric and solid culture for recovery of acid-fast bacilli. J Clin Microbiol 1997; 35(2): 364-8.
- Levidiotou S, Papamichael D, Gessouli E, et al. Detection of mycobacteria in clinical specimen using the mycobacteria growth indicator tube (MGIT) and the Lowenstein Jensen medium. Microbiol Res 1999; 154(2): 151-5.
- Uzun M. Tüberküloz tanısında Erlich-Ziehl-Neelsen, florokrom boyama yöntemleri ile Bactec ve Löwenstein Jensen kültür yöntemlerinin değerlendirilmesi. Doktora Tezi, 1994. İstanbul Üniversitesi Tıp Fakültesi Mikrobiyoloji Anabilim Dalı, İstanbul.
- Woods GL, Bergmans JS, Williams-Bouyer N. Clinical evaluation of the Gen-Probe amplified Mycobacterium tuberculosis direct test for rapid detection of Mycobacterium tuberculosis in select nonrespiratory specimens. J Clin Microbiol 2001; 39(2): 747-9.
- Özkara Ş, Aktaş Z, Özkan S ve ark. Türkiye'de Tüberkülozun Kontrolü İçin Başvuru Kitabı. T.C Sağlık Bakanlığı Verem Savaşı Daire Başkanlığı, 2003. Rekmay, Ankara.
- Yarkın T, Altınöz H, Köse E, et al. Yayma pozitif akciğer tüberkülozlu hastaların yaşam koşullarının ve tanı sürecinin değerlendirilmesi. Solunum Derg 2003; 5(1): 30-6.
- Ataş E, Dursun AB, Güler ZM, et al. Akciğer tüberkülozunun tanısında Löwenstein Jensen besiyeri ile Mycobacteria Growth Indicator Tube (MGIT) yöntemlerinin karşılaştırılması. Toraks Derg 2003; 4(2): 138-42.
- Moore DF, Guzman JA, Mikhail LT. Reduction in turnaround time for laboratory diagnosis of pulmonary tuberculosis by routine use of a nucleic acid amplification test. Diagn Microbiol Infect Dis 2005; 52(3): 247-54.
- Dowdy DW, Maters A, Paris N, et al. Cost-effectiveness analysis of the gen-probe amplified Mycobacterium tuberculosis direct test as used routinely on smear-positive respiratory specimens. J Clin Microbiol 2003; 41(3): 948-53.
- Ateş G, Akyıldız L, Yıldız T. Akciğer tüberkülozlu 117 hastanın tanısında balgam yaymasının kullanımı. Dicle Tıp Derg 2007; 34(1): 33-7.
İletişim (Correspondence):
Doç. Dr. Ahmet Emin Erbaycu,
Dr. Suat Seren Göğüs Hastalıkları ve
Cerrahisi Eğitim ve Araştırma Hastanesi,
Göğüs Hastalıkları Kliniği,
Yenişehir 35110, İzmir, Türkiye.
Tel (Phone): +90 232 433 3333,
E-posta (E-mail): drerbaycu@yahoo.com