Riskli
Hastaların Periferal Kan Örneklerinde Sitomegalovirus Varlığının Shell Vial
Hücre Kültürü,
Antijenemi Testi ve Gerçek Zamanlı Polimeraz Zincir Reaksiyonu ile
Araştırılması
Investigation
of Cytomegalovirus Positivity in the Peripheral Blood Samples of Risky Patients
by Shell-Vial Cell Culture, Antigenemia Test and Real-Time Polymerase Chain
Reaction
Selma GÖKAHMETOĞLU1, Gülhan YAĞMUR2, Fatma MUTLU SARIGÜZEL3, Esma DENİZ4
1 Erciyes Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Kayseri.
1 Erciyes University Faculty of Medicine, Department of Medical Microbiology, Kayseri, Turkey.
2 Kayseri Kadın Doğum ve Çocuk Hastalıkları Hastanesi, Kayseri.
2 Kayseri Gynecology, Obstetric and Pediatric Diseases Hospital, Kayseri, Turkey
3 Kayseri Eğitim ve Araştırma Hastanesi, Kayseri.
3 Kayseri Training and Research Hospital, Kayseri, Turkey.
4 Nuh Naci Yazgan Göğüs Hastalıkları Hastanesi, Kayseri.
4 Nuh Naci Yazgan Chest Diseases Hospital, Kayseri, Turkey.
ÖZET
Sitomegalovirus (CMV), immün sistemi normal kişilerde genellikle belirtisiz enfeksiyonlara yol açarken, konjenital enfeksiyonu olan yenidoğanlarda ve immün sistemi baskılanmış hastalarda ciddi morbidite ve mortalite nedeni olmaktadır. CMV enfeksiyonlarının laboratuvar tanısında, hücre kültüründe izolasyon, pp65 antijenemi testi, serolojik ve moleküler yöntemler uygulanmaktadır. Bu çalışmada, CMV hastalığı için risk grubunda olan hastalardan alınan kan örneklerinde antijenemi testi, shell vial hücre kültürü ve gerçek zamanlı polimeraz zincir reaksiyonu (RT-PCR) yöntemleriyle CMV varlığının araştırılması amaçlanmıştır. Çalışmaya, CMV hastalığı ön tanısıyla viroloji laboratuvarımıza gönderilen 91 hastaya (33 kadın, 58 erkek) ait 141 periferal kan örneği dahil edilmiştir. Hastaların beşi yenidoğan olup, erişkin hastaların (yaş aralığı 17-79 yıl) 81i kemik iliği, dördü böbrek, biri karaciğer transplant alıcısıdır. Örneklerden CMV izolasyonu için shell vial hücre kültürü yöntemi (Vircell, İspanya); kan lökositlerinde pp65 antijen varlığının tespiti için indirekt immünfloresans yöntemi (CINAkit Argene, Biosoft, Fransa) ve plazma örneklerinde CMV DNA saptanması için RT-PCR (CMV QNP 2.0; Fluorion, İontek, Türkiye) yöntemi kullanılmıştır. Çalışmaya dahil edilen 141 örneğin 72 (%51)sinde shell vial hücre kültürü yöntemiyle, 82 (%58.2)sinde antijenemi testiyle, 49 (%34.8)unda ise RT-PCR ile pozitif sonuç alınmıştır. Hücre kültürü yöntemi altın standart kabul edildiğinde, antijenemi testinin duyarlılık ve özgüllüğü sırasıyla %81.9 ve %66.6; RT-PCR yönteminin duyarlılık ve özgüllüğü ise sırasıyla %43 ve %73.9 olarak bulunmuştur. Hücre kültürü ve antijenemi yöntemleriyle pozitif bulunduğu halde RT-PCR ile CMV DNAsı saptanamayan 15 olgudan rastgele seçilen üçüne ait örneklere DNA dizi analizi (ABI Prism 310 Genetic Analyzer; Perkin Elmer, ABD) uygulanmıştır. Dizi analizi sonuçlarına göre, bu üç örnekte CMV DNAnın pozitif olduğu, ancak CMV QNP 2.0 kitinde hedef alınan prob (gB) bölgesinde mutasyonların bulunduğu saptanmıştır. Sonuç olarak, CMV hastalığının hayati önem taşıdığı hastalarda, viremi ve viral yükün tespit edilmesi amacıyla antijenemi ve PCR yöntemlerinin kullanılabileceği; ancak CMV gB genini hedef alan PCR çalışmalarında beklenmeyen negatif sonuçlar elde edildiğinde mutasyon varlığının akılda tutulması ve gereğinde dizi analizi yapılmasının yararlı olacağı kanısına varılmıştır.
Anahtar sözcükler: Sitomegalovirus; CMV; shell vial yöntemi; antijenemi testi; PCR; DNA dizi analizi.
ABSTRACT
Cytomegalovirus (CMV) infections in immunocompromised patients and congenital infections in infants have high morbidity and mortality while it may lead to asymptomatic infections in immunocompetent subjects. Serological tests, culture methods, antigenemia tests and molecular methods are applied in the diagnosis of CMV infection. The aim of this study was to investigate the presence of CMV in peripheral blood samples of patients who were at risk for CMV disease by shell vial cell culture, antigenemia test and real-time polymerase chain reaction (RT-PCR) methods. A total of 141 blood specimens obtained from 91 patients (33 female, 58 male) with suspected CMV disease were included to the study. Five of the patients were newborns and the others aged between 17-79 years old were bone morrow (n= 81), kidney (n= 4) and liver (n= 1) transplantation patients. Shell vial (Vircell, Spain) cell culture method was applied for CMV isolation from the samples, while the detection of pp65 antigen in blood leukocytes was investigated by indirect immunofluorescence method (CINAkit Argene, Biosoft, France). The presence of CMV DNA in plasma samples was detected by RT-PCR (CMV QNP 2.0 kit; Fluorion, Iontek, Turkey) method. CMV was found positive in 72 (51%) of 141 samples by shell vial, 82 (58.2%) by antigenemia test and 49 (34.8%) by RT-PCR. Considering cell culture as the gold standard, the sensitivity and specificity of antigenemia test were calculated as 81.9% and 66.6%, respectively; and for PCR those rates were 43% and 73.9%, respectively. In addition DNA sequencing (ABI Prism 310 Genetic Analyzer; Perkin Elmer, USA) was performed for the samples of randomly selected three patients out of 15, who were yielded positive results with cell culture and antigenemia tests but negative CMV DNA by RT-PCR. In this analysis CMV DNA was found positive in three of the samples that were found negative by RT-PCR in spite of CMV isolation and positive antigenemia. DNA sequencing of those samples revealed multiple mutations in the probe binding region (gB) of CMV QNP 2.0 kit. It was concluded that for the detection of CMV viremia and viral load in patients under risk for CMV disease, antigenemia and PCR based methods could be applied, however, negative results obtained by PCR targeting CMV gB gene, should remind the possible presence of mutations in the related site and the results should be confirmed by sequence analysis.
Key words: Cytomegalovirus; CMV; shell vial method; antigenemia test; PCR; DNA sequencing.
Geliş Tarihi (Received): 07.09.2010 • Kabul Ediliş Tarihi (Accepted): 10.01.2011
GİRİŞ
Herpesviridae ailesinde sınıflandırılan sitomegalovirus (CMV), tüm dünyada yaygın olarak görülen ve genellikle asemptomatik enfeksiyonlara neden olan bir DNA virusudur. Buna karşın CMV enfeksiyonları, gebe kadınlarda, intrauterin enfeksiyon sonrası yenidoğanlarda ve immün sistemi baskılanmış hastalarda (böbrek ve kemik iliği transplantasyonu yapılan, kanserli ve AIDSli hastalar) yüksek morbidite ve mortalite nedenidir1.
CMV enfeksiyonlarının tanısında; serolojik testler, kültür yöntemleri, antijenemi testi ve nükleik asit saptama yöntemleri kullanılmaktadır. Ancak immün sistemi baskılanmış hastalarda antikor yanıtının eksik ya da bozuk olması, serolojik yöntemlerin geçerliliğini sınırlandırmaktadır. Konvansiyonel hücre kültürü ile CMVnin izolasyonu ise zahmetli ve zaman alıcıdır. Buna karşın shell vial sistemi, kısa zamanda sonuç veren hızlı bir hücre kültürü yöntemidir. Vireminin ve viral yükün tespitinde en güvenilir yöntemlerin, kanda CMV pp65 antijenemi testi ve moleküler yöntemlerle CMV DNA saptanması olduğu bildirilmektedir2. Son yıllarda yaygın uygulama alanı bulan gerçek zamanlı (real-time) polimeraz zincir reaksiyonu (RT-PCR) yönteminin, CMV DNAnın araştırılmasında diğer moleküler yöntemlere kıyasla daha duyarlı olduğu da rapor edilmektedir3,4.
Bu çalışmada, CMV hastalığı için risk grubunda olan hastalardan alınan kan örneklerinde antijenemi testi, shell vial hücre kültürü ve RT-PCR yöntemleriyle CMV varlığının araştırılması amaçlanmıştır.
GEREÇ ve YÖNTEM
Hastalar ve Örnekler
Çalışmaya, Erciyes Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı Viroloji Laboratuvarına CMV hastalığı ön tanısıyla gönderilen 91 hastaya (33 kadın, 58 erkek) ait 141 kan örneği dahil edildi. Hastaların beşi yenidoğan olup, erişkin hastaların (yaş aralığı 17-79 yıl) 81i kemik iliği, dördü böbrek, biri karaciğer transplant alıcısı idi. Transplantasyon yapılan hastalardan alınan örnekler transplantasyon sonrası 1-3 ay dönemine aitti. Antijenemi ve shell vial yöntemleri, kan örneklerinden elde edilen lökositlerde gerçekleştirilirken, CMV DNA plazma örneklerinde araştırıldı.
CMV Antijenemi Testi
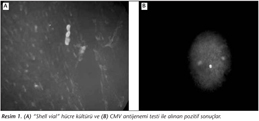
Lökositlerde CMVye özgül pp65 (matriks proteini) antijen varlığı, indirekt immünfloresan yöntemiyle (CiNAkit, Argene-Biosoft, Fransa) kit prosedürüne uygun olarak araştırıldı. Bu amaçla kan örnekleri eritrosit lizis ile işleme alındı ve elde edilen lökositler yaklaşık 2 x 105 hücre/spot olacak şekilde sitosantrifüj kullanılarak lama yapıştırıldı. Formaldehid fiksasyonu ve membran permeabilizasyonu uygulandıktan sonra hücreler anti-CMV pp65 monoklonal antikoru ile 30 dakika 37°Cde inkübe edildi. Fosfat tamponu ile yıkama işleminden sonra floresan izotiyosiyonat ile işaretli anti-fare IgM + IgG F(ab)2 ile 30 dakika 37°Cde inkübe edildi. Preparatlar x400 büyütme ile floresan mikroskobunda incelenerek parlak yeşil renkte nükleer olarak boyanmış polimorf çekirdekli lökositler sayıldı. Tüm alanda ≥ 1 yeşil floresan veren hücrelerin görüldüğü örnekler pozitif olarak değerlendirildi (Resim 1).
CMV RT-PCR
Bu amaçla, CMV glikoprotein B (gB)yi hedef alan CMV QNP 2.0 kiti (Fluorion, İontek, Türkiye) kullanıldı. Plazma örneklerinden DNA izolasyonu, QIAmp MinElute (Qiagen, Almanya) kiti ile üreticinin önerilerine uygun olarak yapıldı. 15.25 µl amplifikasyon karışımına 0.25 µl internal kontrol eklendi ve karışım üzerine 10 µl DNA konuldu. Amplifikasyon işlemi Icycler (BIO-RAD, ABD) cihazında gerçekleştirildi. RT-PCR yönteminin dinamik aralığı 5 x 103-106 kopya/ml idi.
Shell Vial Hücre Kültüründe İzolasyon
CMV izolasyonu için kan örneklerindeki lökositler dekstranla ayrıştırıldı5. Virus izolasyonu için lamellerde MRC-5 hücre kültürü üretilmiş olan shell vial tüpleri (Vircell, İspanya) kullanıldı. En fazla 15 gün saklanabilen shell vialler, çalışma gününe kadar 37°Cde muhafaza edildi. Ekim yapılacağı zaman shell vialdeki idame besiyeri dökülerek önceden hazırlanmış hasta örneklerinden 200 µl eklendi ve 700 gde 45 dakika santrifüj edildi. 37°Cde bir saat inkübasyondan sonra inokülum dökülerek, tüplere 1 ml %2 fetal sığır serumu içeren RPMI 1640 besiyerinden eklendi ve 24 saat süreyle 37°Cde inkübe edildi. İnkübasyon sonunda tüplerdeki besiyeri döküldü ve metanol eklenerek 10 dakika tesbit işlemi yapıldı. Daha sonra tüplerin içindeki lameller çıkarılarak lama yapıştırıldı ve hücreler CMVye özgül floresanla işaretli antikorlar kullanılarak immünfloresan yöntemle (Vircell, İspanya) test prosedürüne uygun olarak boyandı (Resim 1).
DNA Dizi Analizi
Antijenemi ve shell vial hücre kültürü yöntemleriyle pozitif sonuç alındığı halde CMV DNAsı negatif bulunan örneklerden üçüne, İstanbulda bulunan İontek Laboratuvarında ABI Prism 310 Genetic Analyzer cihazında (Perkin Elmer, ABD) DNA dizi analizi (hedef bölge: gB) yapıldı.
BULGULAR
Çalışmaya dahil edilen 141 örneğin 72 (%51)sinde shell vial hücre kültürü yöntemiyle, 82 (%58.2)sinde antijenemi testiyle, 49 (%34.8)unda ise RT-PCR ile pozitif sonuç alınmıştır (Tablo I).
Shell vial hücre kültürü yöntemi altın standart kabul edilerek, antijenemi ve PCR yöntemlerinin duyarlılık ve özgüllüğü hesaplanmış; buna göre antijenemi testinin duyarlılığı %81.9, özgüllüğü %66.6; RT-PCR yönteminin duyarlılığı %43, özgüllüğü %73.9 olarak bulunmuştur.
Çalışmada, her üç testin eş zamanlı pozitifliği, 27 hastadan elde edilen 28 örnekte; her üç testin aynı anda negatifliği ise 31 hastadan elde edilen 35 örnekte saptanmıştır. Tüm testler ile pozitif bulunan hastalardan birinin yenidoğan, diğerlerinin ise kemik iliği transplant alıcısı olduğu belirlenmiştir.
Takipler esnasında test pozitifliklerinde değişmelerin olduğu gözlenmiştir. Hücre kültürü ve antijenemi testleri ile pozitif bulunan ancak CMV DNAsı negatif olan 20 hastadan beşinin test takipleri sırasında bir veya birkaç kez CMV DNA pozitifliğinin mevcut olduğu izlenmiştir. Buna karşın hücre kültürü ve antijenemi testi pozitif olduğu halde takipler esnasında RT-PCR ile hiçbir zaman pozitif sonuç vermeyen 15 hastanın rastgele seçilen üçüne ait örneklere CMV DNA dizi analizi uygulanmıştır. Dizi analizi sonuçlarına göre, bu üç örnekte CMV DNAnın pozitif olduğu, ancak CMV QNP 2.0 kitinde kullanılan prob (gB) bölgesinde mutasyonların bulunduğu saptanmıştır (Şekil 1).
TARTIŞMA
CMV hastalığı açısından risk altında olan hastalarda virusun erken dönemde saptanması, ölüm ve ciddi komplikasyonların önlenmesi ve etkili antiviral tedaviye başlanması için gereklidir6,7,8. Bu amaçla en yaygın olarak kullanılan yöntemler CMV antijenemi testi, CMV PCR ve hızlı kültür yöntemleridir. Yapılan çalışmalarda, hastanın gansiklovir tedavisi aldığı durumlarda CMVnin kültürde üretilememesine rağmen antijenemi testi ile pozitif sonucun alınabildiği bildirilmektedir9. Buna karşın vireminin düşük olduğu durumlarda da CMV antijenemi testi ile negatif sonuç alınırken, CMV DNAnın gösterildiği çalışmalar mevcuttur10. Konjenital CMV enfeksiyonu olan yenidoğanlarda veya transplantasyondan sonra lökopenik olan olgularda CMV antijenemi testi negatif sonuç verebilir. Bu durumda CMV DNAnın PCR ile çalışılması önerilmektedir11.
Transplantasyon yapılan hastalarda CMV antijenemi ve CMV DNA testlerinin birlikte çalışıldığı birçok çalışma mevcuttur4,12,13,14,15,16. Aitken ve arkadaşları12, 52 renal transplant alıcısında hibrid yakalama (HC) testi, shell vial yöntemi ve PCR bazlı amplicor CMV monitor testi ile CMVyi araştırmışlardır. Aynı çalışmada, CMV hastalığı gelişen 14 hastanın hepsinde HC ve amplicor CMV monitor testi pozitif olarak bulunurken, shell vial yöntemiyle sadece 10 hastada pozitiflik bulunmuştur. Buna göre araştırmacılar, CMV hastalığının tespiti için amplicor CMV ve HC testlerinin, shell vial yöntemine üstün olduğunu ifade etmişlerdir12. Transplantasyon yapılmış ve insan immünyetmezlik virüsü (HIV) ile enfekte kişilerin dahil edildiği başka bir çalışmada, CMV tespitinde HC yöntemi, antijenemi testi, shell vial ve konvansiyonel tüp kültürü yöntemi kullanılmış ve yöntemlerin duyarlılıkları sırasıyla %95, %94, %43 ve %46 olarak bulunmuştur13. Alice ve arkadaşları4 solid organ transplantasyonu yapılan hastaları içeren çalışmalarında, CMVnin saptanmasında antijenemi ve PCR yöntemleri arasında iyi bir korelasyon bulmuşlardır. Piiparinen ve arkadaşları14 da, renal transplant alıcılarına ait 342 kan örneğinde CMV pozitiflik oranlarını, PCR ile %35, antijenemi testiyle %40 ve shell vial yöntemiyle %17 olarak belirlemişlerdir. Bu oranlar, kemik iliği transplant alıcılarına ait 415 kan örneği ile yapılan diğer bir çalışmada, RT-PCR için %22, antijenemi testiyle ise %9 olarak bildirilmektedir15. Griscelli ve arkadaşları16, 16 kemik iliği transplant alıcısından elde ettikleri 197 örnekte RT-PCR ve CMV antijenemi testi ile yaptıkları çalışmada, PCR pozitif buldukları örneklerin %51.5 (66/128)inde antijenemi testini negatif bulmuşlardır.
Ülkemizde yapılan bir çalışmada, immünyetmezliği olan hastalarda antijenemi ve HC yöntemleriyle CMV araştırılmış ve 56 kan örneğinin 11 (%19.6)inde her iki testle pozitif sonuç bulunmuştur17. Aynı çalışmada antijenemi testi pozitif olan dokuz kan örneğinde CMV DNA saptanamamıştır17. Özkan ve arkadaşlarının18 çalışmasında, toplam 13 örnekten dokuzunda antijenemi ve CMV DNA testleri uyumlu bulunmuş; dört örnekte ise antijenemi testinin negatif, CMV DNA testinin pozitif olduğu bildirilmiştir. Başka bir çalışmada ise, CMV hastalığı tanısı alan hastalarda antijenemi, lökosit DNA ve plazma DNA testi sonuçları arasında orta derecede korelasyon saptanmıştır19.
Sunulan bu çalışmada, 86sı transplant alıcısı, beşi yenidoğan olmak üzere 91 hastaya ait toplam 141 örneğin %58.2sinde CMV pp65 antijenemi testi, %51inde shell vial hücre kültürü ve %34.8inde CMV RT-PCR yöntemi ile pozitif sonuç alınmıştır (Tablo I). Hücre kültürü yöntemi referans olarak alındığında; antijenemi testinin duyarlılık ve özgüllüğü sırasıyla %81.9 ve %66.6, RT-PCR yönteminin duyarlılık ve özgüllüğü ise sırasıyla %43 ve %73.9 olarak saptanmıştır. Bu sonuçlar irdelendiğinde, antijenemi ve hücre kültürü yöntemlerinin sonuçları diğer çalışmalarla uyumlu bulunmuş; ancak hedef bölgesi gB olan RT-PCR yönteminin duyarlılığının oldukça düşük olduğu gözlenmiştir. Bu durumun, klinik CMV suşlarının gB bölgesindeki olası mutasyonlardan kaynaklanabileceği düşünülmüş ve bunu araştırmak amacıyla, antijenemi ve kültür yöntemleriyle pozitif bulunan ancak CMV DNAsı negatif olan 15 örneğin -ekonomik olanaksızlıklar nedeniyle- üçüne DNA dizi analizi uygulanmıştır. Dizi analizi sonucunda örneklerin hepsinde, RT-PCR kitinde kullanılan prob bağlanma bölgesinde mutasyon olduğu belirlenmiştir (Şekil 1). Nitekim bazı çalışmalarda, gB bölgesini hedef alan PCR kitleri ile CMV DNA saptanmasında, prob bağlanma bölgesindeki mutasyonlara bağlı olarak yalancı negatif sonuçlar alınabileceği vurgulanmaktadır20,21. Nye ve arkadaşları21, CMV gB geninin hedef bölge olduğu RT-PCR kiti ile yaptıkları çalışmada, viral genomun prob bağlanma bölgesinde mutasyon varlığını saptamışlar ve bu durumun yöntem için bir komplikasyon yaratacağını belirtmişlerdir.
Sonuç olarak çalışmamızda, CMV hastalığının büyük öneme sahip olduğu hasta gruplarında, viremi ve viral yükün tespit edilmesi amacıyla antijenemi ve PCR yöntemlerinin kullanılabileceği; ancak CMV gB genini hedef alan PCR çalışmalarında beklenmeyen negatif sonuçlar elde edildiğinde mutasyon varlığının akılda tutulması ve gereğinde dizi analizi yapılmasının yararlı olacağı kanısına varılmıştır.
KAYNAKLAR
- Crumpacker CS, Wadhwa S. Cytomegalovirus, pp: 1787-89. In: Mandell GL, Bennett JE, Dolin R (eds), Mandell, Douglas and Bennetts Principles and Practice of Infectious Diseases. 2005, 6th ed. Churcill Livingstone, Philadelphia.
- Hodinka RL. Human cytomegalovirus, pp: 1549-63. In: Murray PR, Baron EJ, Pfaller MA, Tenover FC, Yolken RH (eds), Manual of Clinical Microbiology. 2007, ASM Press, Washington DC.
- Piiparinen H, Höckerstedt K, Grönhagen-Riska C, Lautenschlager I. Comparison of two quantitative CMV PCR tests, Cobas Amplicor CMV Monitor and Taqman assay, and pp65-antigenemia assay in the determination of viral loads from peripheral blood of organ transplant patients. J Clin Virol 2004; 30(3): 258-66. [Özet]
- Alice T, Enrietto M, Pittaluga F, et al. Quantitation of cytomegalovirus DNA by real-time polymerase chain reaction in peripheral blood specimens of patients with solid organ transplants: comparison with end-point PCR and pp65 antigen test. J Med Virol 2006; 78(7): 915-22. [Özet]
- Reina J, Saurina J, Fernandez Baca V, Blanco I, Munar M. An increase in the number of polymorphonuclear leukocytes inoculated on shell-vial culture increases the sensitivity of this assay in detection of cytomegalovirus in the blood of immunocompromised patients. Diagn Microbiol Infect Dis 1998; 31(3): 425-8. [Özet]
- Britt WJ, Alford CA. Cytomegalovirus, pp: 2493-523. In: Fields BN, Knipe DM, Howley PM (eds), Fields Virology. 1996, 3rd ed. Lippincott-Raven Publishers, Philadelphia.
- Çolak D, Öğünç D. Sitomegalovirus infeksiyonlarında tanı yöntemleri. FLORA 1999; 4(2): 82-9. [Özet]
- Sayıner A. Cytomegalovirus infeksiyonu tanısında serolojik testler. I. Ulusal CMV Sempozyumu Tanı ve Tedavi Yaklaşımları: Sorunlar ve Çözümleri. 30 Kasım-02 Aralık 2001, Antalya. Sempozyum Kitabı, s: 33-9.
- Niubo J, Perez JL, Martínez-Lacasa JT, et al. Association of quantitative cytomegalovirus antigenemia with symptomatic infection in solid organ transplant patients. Diagn Microbiol Infect Dis 1996; 24(1): 19-24. [Özet]
- Weinberg A, Hodges TN, Cai G, Zamoa MR. Comparison of PCR, antigenemia assay, and rapid blood culture for detection and prevention of cytomegalovirus disease after lung transplantation. J Clin Microbiol 2000; 38(2): 768-72. [Özet] [Tam Metin] [PDF]
- Boeckh M, Boivin G. Quantitation of cytomegalovirus: methodologic aspects and clinical applications. Clin Microbiol Rev 1998; 11(3): 533-54. [Özet] [Tam Metin] [PDF]
- Aitken C, Barrett-Muir W, Millar C, et al. Use of molecular assay in diagnosis and monitoring of cytomegalovirus disease following renal transplantation. J Clin Microbiol 1999; 37(9): 2804-7. [Özet] [Tam Metin] [PDF]
- Mazzulli T, Drew LW, Yen-Lieberman B, et al. Multicenter comparison of the digene hybrid capture CMV DNA assay (version 2.0), the pp65 antigenemia assay, and cell culture for detection of cytomegalovirus viremia. J Clin Microbiol 1999; 37(4): 958-63. [Özet] [Tam Metin] [PDF]
- Piiparinen H, Helantera I, Lappalainen M, et al. Quantitative PCR in the diagnosis of CMV infection and in the monitoring of viral load during the antiviral treatment in renal transplant patients. J Med Virol 2005; 76(3): 367-72. [Özet]
- Ghaffari HS, Obeidi N, Dehghan M, Alimoghaddam K, Gharehbaghian A, Ghavamzadeh A. Monitoring of cytomegalovirus reactivation in bone marrow transplant recipients by real-time PCR. Pathol Oncol Res 2008; 14(4): 399-409. [Özet]
- Griscelli F, Barrois M, Chauvin S, et al. Quantification of human cytomegalovirus DNA in bone marrow transplant recipients by real-time PCR. J Clin Microbiol 2001; 39(12): 4362-9. [Özet] [Tam Metin] [PDF]
- Çolak D, Öğünç D, Tuncer D, Mutlu G. CMV saptanmasında CMV antijenemi ve hybrid capture CMV DNA hibridizasyon testlerinin karşılaştırılması. 8. Türk Mikrobiyoloji ve İnfeksiyon Hastalıkları Kongresi. 6-10 Ekim 1997, Antalya. Kongre Kitabı, Poster no: D-35.
- Özkan E, Önal D, Çiftçi S, Beşışık SK, Yılmaz G, Badur S. Cytomegalovirus pp65 antijenemi testi ile pozitiflik saptanan allogenik kök hücre nakilli hastalardaki sonuçların murex hybrid capture CMV DNA assay ile karşılaştırılması. 9. Türk Mikrobiyoloji ve İnfeksiyon Hastalıkları Kongresi. 3-8 Ekim 1999, Antalya. Kongre Kitabı, T 015.
- Zeytinoğlu A, Erensoy S, Göksel S, Töz H, Yapar N, Bilgiç A. Sitomegalovirüs hastalığında antijenemi testi ile kantitatif DNA testinin karşılaştırılması. FLORA 2002; 7(4): 241-5. [Özet]
- Gökahmetoğlu S, Deniz E. Comparison of real-time, and qualitative polymerase chain reaction assays in detection of cytomegalovirus DNA in clinical specimens. Saudi Med J 2007; 28(11): 1658-61. [Özet]
- Nye MB, Leman AR, Meyer ME, Menegeus MA, Rothberg PG. Sequence diversity in the glycoprotein B gene complicates real-time PCR assays for detection and quantification of cytomegalovirus. J Clin Microbiol 2005; 43(10): 4968-71. [Özet] [Tam Metin] [PDF]
İletişim (Correspondence):
Prof. Dr. Selma Gökahmetoğlu,
Erciyes Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
Kayseri, Türkiye.
Tel (Phone): +90 533 353 3105,
E-posta (E-mail): selmagk@gmail.com