Taramada Treponemal Test Kullanan Bir Sifiliz Tanı Algoritmasının Değerlendirilmesi
Evaluation of a Syphilis Testing Algorithm Using a Treponemal Test for Screening
Ö. Alpay ÖZBEK, Yavuz DOĞAN
Dokuz Eylül Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, İzmir.
Dokuz Eylul University Faculty of Medicine, Department of Medical Microbiology, Izmir, Turkey.
ÖZET
Sifilizin tanısında kullanılan geleneksel algoritma, taramanın önce nontreponemal bir testle yapılması, pozitif çıkan sonuçların daha sonra özgül bir treponemal testle doğrulanmasıdır. Günümüzde sifiliz taraması için nontreponemal testlerden daha duyarlı ve otomasyona uygun ticari testler kullanıma girmiştir. Sifiliz serolojisi ile ilgili bazı rehberlerde tarama için treponemal testler ilk seçenek olarak önerilmektedir; ancak öneriyi yapan rehberler arasında tarama sonrası çalışılacak testler için bir fikir birliği bugüne kadar oluşmamıştır. Bu çalışmada, ilk tarama testi olarak kemilüminesan mikropartikül enzim immünoassay (CMIA) temeline dayalı bir treponemal testin (Architect Syphilis TP; Abbott Japan Co, Japonya) kullanıldığı tanısal algoritma, laboratuvar verilerinin geriye dönük olarak incelenmesi ile değerlendirilmiştir. Çalışmada, Ocak 2007-Şubat 2010 tarihleri arasında sifiliz taraması yapılan 7104'ü kadın toplam 10.878 hastaya ait 12.195 örnek incelenmiştir. Algoritmaya göre, CMIA negatif örneklerle ek bir test çalışılmazken, pozitif örneklerde RPR (Rapid Plasma Reagin; Omega Diagnostics, İngiltere) çalışılmış ve her iki test sonucu pozitif bulunan örnekler rapor edilmiştir. Sonuçlar arasında uyumsuzluk saptandığında, pozitif CMIA sonucu TPHA (Treponema pallidum hemagglutination; Omega Diagnostics, İngiltere) testi ile doğrulanmıştır. Çalışmada ayrıca, CMIA pozitif örneklerin kantitatif değerleri (örnek/eşik değer absorbansı; s/co) ile TPHA ve RPR testlerinin sonuçları karşılaştırılmıştır. Tarama sonucunda hastaların %1.1 (120/10.878)'i, örneklerin ise %2 (206/12.195)'si pozitif olarak saptanmıştır. CMIA testinde s/co değeri < 12 olan örneklerin %19.1'inin, s/co > 12 olan örneklerin ise %100'ünün TPHA ile doğrulandığı gözlenmiştir. RPR testi ile ≥ 1/32 titrede pozitif bulunan örneklerin tümünde CMIA s/co değerlerinin > 21 olduğu izlenmiştir. Çalışmamızda, CMIA testinin düşük s/co oranlarında yalancı pozitif sonuç verebildiği, bu nedenle CMIA pozitif sonuçların bir başka treponemal testle doğrulandıktan sonra RPR çalışılması gerektiği kanısına varılmıştır. Sonuç olarak, çalışmamızda elde edilen veriler ve son yıllarda yayınlanmış rehberlerde yer alan öneriler ile uyumlu yeni bir algoritma oluşturulmuştur.
Anahtar sözcükler: Sifiliz; seroloji; tanı algoritması; Architect Syphilis.
ABSTRACT
Traditional testing algorithm for syphilis is initial screening with nontreponemal tests, then retesting positive samples for confirmation using a specific treponemal test. Commercial treponemal tests those are more sensitive than nontreponemal tests and suitable for automation are now commercially available to screen syphilis. Although the treponemal tests are offered as the first choice for syphilis screening by some of the guidelines, to date there is no consensus on recommendations in guidelines for follow-up testing. As some of the guidelines recommend to perform a nontreponemal test for persons with a positive treponemal screening test, the others recommend to confirm the result by another treponemal test. In this study, a testing algorithm using treponemal chemiluminescence microparticle enzyme immunoassay (CMIA; Architect Syphilis TP; Abbott Japan Co, Japan) for primary screening were retrospectively evaluated by reviewing laboratory data. A total of 12.195 serum samples obtained from 10.878 patients (7104 of them were female) who were screened by means of syphilis, between January 2007- February 2010 period have been included to the study. According to this algorithm, no further test was performed for CMIA negative samples. Samples positive by CMIA were retested by RPR (Rapid Plasma Reagin; Omega Diagnostics, UK) test. The test results of both CMIA and RPR positive samples were reported, while positive CMIA results were confirmed by TPHA (Treponema pallidum hemagglutination; Omega Diagnostics, UK) if any discrepancy in the results were identified. Screen test revealed positive results in 1.1% (120/10.878) of the patients and 2% (206/12.195) of the samples. In this study, quantitative values (sample/cut-off absorbance ratio; s/co) of positive CMIA samples were also compared with TPHA and RPR test results. It was observed that while 19.1% of CMIA positive samples with s/co ratios less than 12 were confirmed by TPHA, the confirmation rate was 100% with s/co ratios above 12. Additionally, RPR positive samples with a titer of ≥ 1/32 yielded CMIA s/co ratios above 21. As low s/co levels detected with CMIA may lead to false-positive results for syphilis, it was concluded that CMIA positive results should be confirmed by another treponemal test before RPR testing. A new syphilis testing algorithm in accordance with the results of this review and recommendations in new guidelines were established in the light of this study.
Key words: Syphilis; serology; testing algorithm; Architect Syphilis.
Geliş Tarihi (Received): 06.04.2010 • Kabul Ediliş Tarihi (Accepted): 24.09.2010
GİRİŞ
Sifiliz, bir spiroket olan Treponema pallidum'un neden olduğu ve sıklıkla cinsel yolla olmak üzere, maternal yolla, kan nakli ile primer ve sekonder dönemlerdeki lezyonlardan direkt temasla bulaşabilen bir hastalıktır1. Hastalığın laboratuvar tanısında kardiyolipinlere karşı oluşmuş antikorları saptayan nontreponemal ve T.pallidum antijenlerine karşı oluşmuş özgül antikorları saptamayı amaçlayan treponemal esaslı serolojik testler kullanılmaktadır2. Hastalığın tanısında kullanılan geleneksel algoritma; taramanın nontreponemal bir testle yapılması, pozitif çıkan sonuçların daha sonra treponemal bir testle doğrulanmasıdır3. Ancak treponemal antijenlere karşı özgül antikorları saptayan testlerin nontreponemal testlere göre duyarlılıklarının yüksek olması ve enzim "immünoassay" (EIA) prensibi ile çalışan testlerin otomasyona uygun olması, geleneksel yaklaşımda değişiklik yapılmasını gündeme getirmiştir4,5.
Yeni yaklaşımda sifiliz taramasında ilk adım treponemal bir testin çalışılmasıdır. Dokuz Eylül Üniversitesi Hastanesi Seroloji Laboratuvarı, Ocak 2007 tarihine kadar sifiliz taramasında RPR (Rapid Plasma Reagin) testini kullanırken, bu tarihten sonra T.pallidum'a özgül antikorları saptayan ve kemilüminesan mikropartikül EIA (CMIA) prensibi ile çalışan "Architect Syphilis TP" (Architect i2000; Abbott Japan Co., Tokyo, Japonya) testini kullanmıştır. Yapılan bu değişiklikten sonra CMIA testi pozitif çıkan örnekler için uygulanacak yeni bir tanısal algoritma literatür desteğinde oluşturulmuştur. Bu çalışmanın amacı, yaklaşık üç yıl boyunca kullanılan tanısal algoritmanın elde edilen veriler doğrultusunda ve literatür eşliğinde gözden geçirilmesidir.
GEREÇ ve YÖNTEM
Çalışma Grubu ve Tasarımı
Bu çalışmada, seropozitiflik oranlarında meydana gelen değişimi belirleyebilmek amacıyla, Ocak 2007-Şubat 2010 tarihlerine ait seroloji laboratuvarı kayıtları geriye dönük olarak incelendi. İncelemede sifiliz tarama testi çalışılan örnek sayısı, hasta sayısı, bu hastaların kadın/erkek oranları, pozitif ve negatif örneklerin cinsiyete göre dağılımları belirlendi.
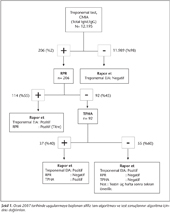
Çalışmanın ikinci bölümünde, Aralık 2007-Şubat 2010 tarihleri arasında sifiliz tanı testlerinde uygulanan tanısal algoritma (Şekil 1) ile elde edilen test sonuçları incelendi. Uygulanan refleks tanısal algoritma, "Centers for Disease Control and Prevention (CDC)" tarafından 2006 yılında yayınlanan "Sexually Transmitted Diseases Treatment Guidelines, 2006" adlı rehberinde yer alan öneriler doğrultusunda oluşturulmuştu2. Bu algoritmaya uygun olarak, CMIA pozitif her örnekte, aktif sifiliz enfeksiyonu varlığını araştırmak ve klinisyenin tedavi takibine yardımcı olmak için, semikantitatif olarak RPR çalışıldı. CMIA ile birlikte RPR pozitifliği saptandığında sonuç raporunda RPR'nin pozitif saptandığı en son titre ile birlikte her iki testin pozitif olduğu bildirildi. CMIA pozitif olmasına karşın RPR negatif saptanan örneklerle semikantitatif olarak T.pallidum hemaglütinasyon (TPHA) testi çalışıldı. TPHA testinin seçilmesindeki amaç, özgül antikorların farklı bir yöntemle saptanması, aynı zamanda ucuz olması ve ek cihaz gerektirmemesi idi. CMIA pozitifliği ile birlikte TPHA testinde de pozitif saptanan örnekler gerçek pozitif (doğrulanmış) olarak kabul edildi. Buna karşın, CMIA pozitif, RPR ve TPHA negatif örneklerin sonuç raporunda testlerin üç hafta sonra tekrarlanması önerildi. Böyle bir önerinin yapılmasının nedeni, primer sifiliz enfeksiyonlarında EIA yönteminin nontreponemal testlere ve TPHA'ya göre daha duyarlı olma olasılığıdır4,5. Önerilen süre sonunda EIA'nın yakalayıp, TPHA'nın kaçırdığı primer enfeksiyon olgularında antikor düzeyinin TPHA için yeterli düzeye ulaşabileceği varsayıldı6.
Uygulanan algoritmanın sonuçlarını gözden geçirmek amacıyla, CMIA testi ile pozitif saptanan örneklerin örnek/eşik değer (s/co) oranları ile aynı örneklerin RPR ve TPHA test sonuçları karşılaştırıldı. Ayrıca, CMIA pozitif, RPR ve TPHA negatif hastalar için yapılan üç hafta sonra test tekrarı önerisinin uygulanma oranları ve bu hastaların izlem sonuçları değerlendirildi.
Laboratuvar Testleri
RPR testi, ticari bir kit ile (Immuntrep RPR, Omega Diagnostics, İngiltere) üreticinin önerisi doğrultusunda çalışıldı. Bu test, insan serum veya plazmasında bulunan reagin antikorlarını flokülasyon yöntemi ile saptamak amacına yöneliktir. Testin prensibi; hasta örneği ile kolesterol/kardiyolipin/lesitin içeren bir reaktifin karşılaştırılması sonunda, reaginlere karşı antikor içeren örneklerde agregasyonun saptanmasına dayanmaktadır. Pozitif örnekler, 1/2 ve katları oranlarında sulandırılarak yeniden çalışıldı. Pozitiflik saptanan en yüksek dilüsyon oranı sonuç raporunda bildirildi.
"Architect Syphilis TP" testi; insan serum veya plazmasında rekombinant T.pallidum antijenlerine (TpN15, TpN17 ve TpN47) karşı oluşmuş özgül antikorları, kemilüminesan reaksiyonu yardımı ile saptamaktadır. Bu test üretici firmanın önerileri doğrultusunda çalışıldı ve değerlendirildi. Test sonuçlarının değerlendirilmesinde, çalışma örnekleri ve kontrol serumlarına ait ölçüm değerlerinin eşik değerine (cut-off) bölünmesi ile ortaya çıkan oran (s/co) esas alındı. Bu oranın 1.00'dan yüksek olması pozitif, küçük olması negatif olarak kabul edildi.
TPHA testi, ticari bir kit ile (Immutrep TPHA, Omega Diagnostics, İngiltere) üretici firmanın önerilerine göre çalışıldı. Testin prensibi; hasta serumlarının duyarlılaştırılmış eritrositlerle U tabanlı mikroplak çukurlarında karşılaştırması esasına dayanmakta ve örneklerde özgül T.pallidum antikor varlığında duyarlılaştırılmış eritrositlerin aglütinasyonu gözlenmektedir. Hasta serumlarının 1/80 sulandırımında aglütinasyonun gözlenmesi pozitif olarak değerlendirildi ve pozitif örnekler ileri sulandırımlarda yeniden çalışılarak saptanan en son titre sonuç raporunda bildirildi.
BULGULAR
Çalışmada, Ocak 2007-Şubat 2010 tarihleri arasında toplam 10.878 hastaya (7104 kadın, 3774 erkek) ait 12.195 örnekten sifiliz taraması istendiği belirlenmiştir. Tarama sonucunda hastaların %1.1 (120/10.878)'i, örneklerin ise %2 (206/12.195)'si pozitif olarak saptanmıştır. Treponemal test pozitifliğinin, kadınlarda %0.6 (42/7104), erkeklerde ise %2 (78/3774) olduğu izlenmiştir. Test sonuçlarının uygulanan algoritmaya göre dağılımları Şekil 1'de gösterilmiştir.
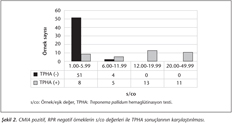
CMIA yöntemi ile pozitif bulunan örneklerin s/co değerleri ile TPHA karşılaştırılması Şekil 2'de verilmiştir. Uygulanan algoritmaya göre, CMIA pozitif, RPR negatif saptanan örneklerde TPHA çalışılmıştır; bu nedenle şekilde verilen örneklerin tümü aynı zamanda RPR negatiftir. TPHA sonuçları incelendiğinde, negatif sonuçların düşük düzey s/co oranları ile birlikte görüldüğü anlaşılmaktadır. Özellikle eşik değere çok yakın olan 1.00-2.00 s/co değerleri arasında TPHA negatifliği %94 (32/34)'e ulaşmaktadır. TPHA sonuçlarında dikkati çeken bir başka konu da, 12.00 s/co değerinin bir sınır değer oluşturmasıdır. Bu sınır değerin üzerinde olan örneklerde TPHA testinin %100 oranında pozitif olduğu, altında ise pozitiflik oranının %19.1'e düştüğü görülmektedir.
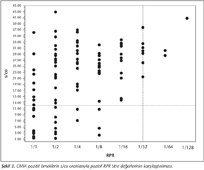
Algoritmaya göre, CMIA yöntemi ile pozitif bulunan her örnekte RPR testi çalışılmıştır. CMIA ve RPR test sonuçları pozitif saptanan örneklerin s/co değerleri ve titreleri Şekil 3'te karşılaştırmalı olarak görülmektedir. Şekil incelendiğinde, ≥ 1/32 titrelerde pozitiflik saptanan örneklerin aynı zamanda s/co değerlerinin de yüksek ve 21'in üzerinde olduğu görülmektedir. Bu örneklerin s/co değerlerinin ortalaması 30.95, en düşük değeri 21.55 olarak saptanmıştır. Buna karşın, düşük titrede (1/1,1/2) RPR pozitif saptanan örneklerin s/co değerlerinin dağılımında bir özellik gözlenmemiştir.
CMIA pozitif, RPR ve TPHA negatif örnekler için yapılan testin üç hafta sonra tekrarı önerisinin toplam 39 hastaya yapıldığı, bu hastaların 15 (%38.5)'i için öneriye uyulduğu, 24 (%61.5)'ü için uyulmadığı belirlenmiştir. Üç hafta sonra tarama testi istenen 15 hastanın 13 (%86.7)'ünde test sonuçlarında bir değişiklik olmadığı ve ikinci örneklerde de CMIA pozitif, RPR ve TPHA negatif bulunduğu görülmüş; geriye kalan 2 (%13.3) hastanın ikinci örneklerinde CMIA testinin negatifleştiği saptanmıştır.
TARTIŞMA
Sifiliz tanısında ticari otomatize treponemal testlerin hizmete sunulması ve bu testlerin yüksek test kapasitesine sahip laboratuvarlarca tarama amaçlı kullanılmaya başlanması, treponemal testi pozitif saptanan örneklerin nasıl yorumlanacağına ve buna bağlı olarak hastaların nasıl yönlendirileceğine ilişkin yeni soruların ortaya çıkmasına neden olmuştur. Bu soruların yanıtlanmasına yardımcı olmak için literatürde farklı tanı algoritmaları önerilmiştir2,3,7,8,9,10. Laboratuvar alanında dünyada kabul görmüş yönlendirici kuruluşların konu ile ilgili yaptıkları yayınlar incelendiğinde, sifiliz taramasında yaşanan geçiş sürecinin sürmekte olduğu ve bir fikir birliğine henüz varılamadığı anlaşılmaktadır.
Konu ile ilgili ulaşılabilen ilk algoritma önerisi "Food and Drug Administration (FDA)" tarafından 2003 yılında endüstri kuruluşları için taslak olarak yayınlanan bir rehber içinde yer almaktadır7. Bu rehberde, treponemal esaslı bir testle yapılan taramada pozitif çıkan sonuçların, floresan treponemal antikor absorbsiyon (FTA-ABS) testi gibi, treponemal esaslı bir başka testle doğrulanması ve doğrulanan örneklerle de nontreponemal testlerden birisinin çalışılması önerilmektedir. Treponemal testlerle yapılan taramalar için CDC'nin 2006 yılında yapmış olduğu önerileri içeren rehber ise halen güncelliğini korumaktadır2. CDC, taramada treponemal testle pozitif saptanan örneklerle önce nontreponemal bir testin çalışılmasını önermektedir. Bu adımda negatif sonuç elde edildiğinde, treponemal ilk testin sonucunu doğrulamak için farklı yöntem kullanan bir başka treponemal test çalışılması, ikinci treponemal testin de pozitif çıkması halinde klinisyenle konsültasyona gidilmesi önerilmektedir. Rehberde her iki treponemal test sonuçlarının uyumsuz çıktığı durumlar için bir öneri bulunmamaktadır2.
CDC tarafından 2008 yılında yayınlanan bir başka raporda, sifiliz tanı algoritmalarına treponemal EIA testleri ile başlayan dört laboratuvarın uygulamaları tanıtılmıştır3. Laboratuvarların tümünde negatif treponemal test sonuçları ek bir test çalışılmadan rapor edilirken, treponemal testi pozitif çıkan örneklerle RPR çalışılmaktadır. Ancak bu adımdan sonra laboratuvarların uygulamalarında farklılık olduğu belirtilmiştir. İki laboratuvarda EIA pozitif, RPR negatif örneklerle T.pallidum partikül aglütinasyon (TP-PA) veya FTA-ABS gibi ek bir treponemal test çalışılmaktadır. Üçüncü laboratuvarda EIA ve RPR pozitif saptanan örneklerle ek treponemal test çalışılırken, dördüncü laboratuvarda EIA ve RPR testlerinden sonra hiçbir ek test çalışılmamaktadır. Ayrıca, laboratuvarların sifiliz test sonuçlarını raporlarında belirtme biçimlerinde de bir birlik olmadığı vurgulanmaktadır. Bu raporun sonunda, treponemal ve RPR testleri pozitif hastaların tedavi yönünden değerlendirilmesi; treponemal test pozitifken RPR negatif bulunduğunda ikinci bir treponemal testin çalışılması gerektiği yorumu yapılmaktadır3.
Yukarıda özetlenen iki rehberde de, sifiliz taramasının treponemal ve nontreponemal testlerden herhangi birisi ile yapılması konusunda yönlendirici bir cümle kullanılmamıştır. Buna karşın Dünya Sağlık Örgütü (DSÖ)'nün 2009 yılında yayınladığı rehberde, kan merkezlerinde sifiliz taramasının, yüksek duyarlılık ve özgüllük oranlarına sahip TPHA ve EIA yöntemleri ile yapılması gerektiği belirtilmektedir8. Nontreponemal testlerin ise, tarama amacıyla yalnızca sifiliz insidansının yüksek olduğu toplumlarda kullanılabileceği vurgulanmıştır. Aynı rehberde pozitif çıkan sonuçların doğrulanması önerilirken, doğrulama yöntemine ilişkin bir yorum verilmemiştir8.
Tarama testinin treponemal esaslı olması gerektiğini belirten 2008 ve 2009 tarihli diğer rehberlerde de, taramada saptanan pozitifliğin farklı yöntem kullanan treponemal bir testle doğrulanması; sonuçlar arasında uyumsuzluk görüldüğünde, rekombinant antijen kullanan "immünoblot" esaslı üçüncü bir testin doğrulama amacıyla çalışılması önerilmektedir9,10. Her iki rehberde vurgulanan bir başka konu, FTA-ABS testinin standart bir doğrulama testi olarak kullanılmamasıdır. Bu testin yalnızca bu konuda uzmanlaşmış, kalite güvencesinin ve tekrarlanabilirliğin sağlandığı laboratuvarlarda kullanılabileceği belirtilmektedir. Yine aynı rehberlerde treponemal test sonucu doğrulanmış örneklerle semikantitatif nontreponemal bir test çalışılarak enfeksiyonun aktivitesi ve tedavi izlemi için veri oluşturulması önerilmektedir9,10.
Laboratuvarımızda uygulanan tanı algoritmasına göre, taramada CMIA pozitif, RPR negatif bulunan örneklerle TPHA çalışılmıştır. TPHA pozitif çıkan örneklerin CMIA sonuçları doğrulanmış kabul edilirken, negatif çıkan örneklerin CMIA sonuçlarının yalancı pozitif olabileceği düşünülerek testin üç hafta sonra tekrarı önerilmiştir. Çalışmamızda, TPHA sonuçları ile CMIA değerleri arasında bir ilişkinin varlığı da araştırılmış ve 12 s/co değerinin bir sınır oluşturduğu ve bunun üzerinde CMIA pozitifliği saptanan örneklerde TPHA testinin %100 oranında pozitif bulunduğu görülmüştür. Bu değerin altında TPHA pozitifliği %19.1'e düşmektedir. Bu sonuç, her ne kadar "Western Blot (WB)" ya da FTA-ABS gibi altın standart kabul edilen bir yöntemle doğrulanmamış olsa da, CMIA testinin düşük s/co değerlerinde yalancı pozitif sonuç verebileceğini düşündürmektedir. Bu düşünceyi destekleyen bir başka veri, CMIA pozitif, TPHA negatif 15 hastanın üç hafta sonra yapılan taramalarında TPHA'nın hiç pozitifleşmemesi, buna karşılık iki hastada CMIA sonucunun negatifleşmesidir. Düşük s/co değerlerinde CMIA testinin yalancı pozitif sonuç verebildiği, Young ve arkadaşlarının5 çalışmasında da belirtilmiştir. Bu araştırıcılar, yalancı pozitif olduğu belirtilen örneklerin s/co değerlerinin ≤ 5 olduğunu rapor etmişlerdir5.
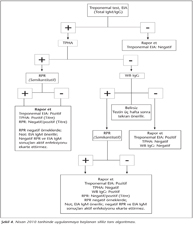
Elde ettiğimiz veriler doğrultusunda, uygulanan algoritmanın yüksek s/co değerlerinde başarılı olduğu, ancak düşük değerlerde yalancı pozitiflik yönünden risk taşıdığı sonucuna varılmıştır. Eğer bir örnek hem CMIA hem de RPR'de, literatürde sıralanan nedenlerle, yalancı pozitif sonuç verirse algoritma ile bunun fark edilme olasılığı bulunmamaktadır11. Bu nedenle tanı algoritması, yeni yayınlanmış rehberlerde9,10 belirtilen esaslar göz önünde bulundurularak tarafımızdan modifiye edilmiştir. Yeni algoritmada tarama yine özgül IgM ve IgG antikorlarını birlikte araştıran bir EIA yöntemi ile yapılmaktadır (Şekil 4). Pozitif çıkan örneklerle TPHA çalışılmakta, bu testin de pozitif saptanması durumunda, hastanın aktif sifiliz yönünden değerlendirilmesine ve olası bir tedavi izleminin yapılabilmesine katkıda bulunmak amacıyla RPR çalışılmaktadır. RPR testi, prezon fenomenini de yakalayabilmek amacıyla, 1/16 titreyi de içerecek biçimde, semikantitatif olarak çalışılmaktadır11. Rehberlerde, RPR testinin negatif bulunmasının aktif enfeksiyonu ekarte ettirmeyeceği, bu nedenle antitreponemal IgM EIA çalışılmasının uygun olacağı belirtilmektedir9,10. Ancak, bizim laboratuvarımızda üç yıl içinde CMIA ve TPHA pozitif, RPR negatif saptanan hasta sayısı yalnızca 23'tür ve EIA IgM testinin sürdürülebilirliği bulunmamaktadır. Bu nedenle, rehberlerin bu önerisi uygulamaya konamamıştır. Treponemal testleri pozitif, RPR negatif hastaların sonuç raporlarına eklenen bir notla, primer enfeksiyon düşünülüyorsa hastadan antitreponemal IgM EIA testinin istenmesi önerilmekte, bununla birlikte RPR ve IgM EIA negatif hastalarda aktif enfeksiyonun ekarte edilemeyeceği belirtilmektedir.
Yeni algoritmaya göre, EIA pozitif, TPHA negatif örneklerde, doğrulama amacıyla, hastadan yeni bir örnek alınmakta ve WB ile IgG varlığı araştırılmaktadır. Ancak bu adımdan önce, TPHA testi negatif bir örneğin CMIA s/co değeri > 12 ise, TPHA'nın semikantitatif olarak tekrar edilmesinin uygun olacağını düşünmekteyiz. Böylece, daha pahalı olan WB testinden önce TPHA'da oluşabilecek prezon fenomeni ekarte edilmiş olacaktır. Algoritmada, pozitif WB IgG sonucu CMIA pozitifliğini doğrulamakta, daha sonra semi-kantitatif RPR çalışılmaktadır. WB IgG sonucu belirsiz (indeterminate) saptanırsa, testlerin üç hafta sonra tekrarı önerilmekte; negatif çıkan örneklerde CMIA sonucu yalancı pozitif olarak kabul edilmektedir. Ancak tarama testinin tek başına özgül IgM pozitifliğini de yakalayabildiği düşünülerek, klinik olarak primer sifiliz düşünülen olgularda testin iki hafta sonra tekrar edilmesi uygun olacaktır (Şekil 4).
Sonuç olarak, sifiliz serolojisinde başvurulacak ilk test olma özelliği nontreponemal testlerden treponemal testlere doğru kaymaktadır. Bu durum, yeni tanı algoritmalarının oluşturulmasını gerekli kılmıştır. Ancak önerilen algoritmalar arasında fikir birliği henüz oluşmamıştır. Bu nedenle, her laboratuvarın önerilen algoritmalar arasında kendine uygun olanı kullanması ve süreç içinde algoritmayı yeniden sorgulaması gerektiğini düşünmekteyiz. Ayrıca bu çalışmada, CMIA testinde > 12 s/co ile pozitif saptanan örneklerin tümünün TPHA ile doğrulandığı gözlenmiş ve bu gözlemin daha büyük çalışma gruplarında ve altın standart yöntemlerle karşılaştırılarak yeniden değerlendirilmesi gerektiği kanısına varılmıştır.
TEŞEKKÜR
Dr. Emrah Başkaya'ya veri incelemesinde vermiş olduğu destek için teşekkür ederiz.
KAYNAKLAR
- Peeling RW, Mabey DC. Syphilis. Nat Rev Microbiol 2004; 2(6): 448-9.
- Centers for Disease Control and Prevention. Sexually transmitted diseases treatment guidelines, 2006. MMWR Morb Mortal Wkly Rep 2006; 55(RR-11): 22-35.
- Centers for Disease Control and Prevention. Syphilis testing algorithms using treponemal tests for initial screening-four laboratories, New York City, 2005-2006. MMWR Morb Mortal Wkly Rep 2008; 57: 872-5. [Özet] [Tam Metin]
- Schmidt BL, Edjlalipour M, Luger A. Comparative evaluation of nine different enzyme-linked immunosorbent assays for determination of antibodies against Treponema pallidum in patients with primary syphilis. J Clin Microbiol 2000; 38(3): 1279-82. [Özet] [Tam Metin] [PDF]
- Young H, Pryde J, Duncan L, Dave J. The Architect Syphilis assay for antibodies to Treponema pallidum: an automated screening assay with high sensitivity in primary syphilis. Sex Transm Infect 2009; 85(1): 19-23. [Özet]
- Manavi K, Young H, McMillan A. The sensitivity of syphilis assays in detecting different stages of early syphilis. Int J STD AIDS 2006; 17(11): 768-71. [Özet]
- U.S.Food and Drug Administration. Guidance for Industry. Revised recommendations for donor and product management based on screening tests for syphilis (Draft Guidance). 2003. http://www.fda.gov/downloads/BiologicsBloodVaccines/ GuidanceComplianceRegulatoryInformation/Guidances/Blood/ucm080314.pdf
- World Health Organization. Screening donated blood for transfusion-transmissible infections: recommendations. WHO, 2009. http://www.who.int/bloodsafety/ScreeningTTI.pdf
- Kingston M, French P, Goh B, et al; Syphilis Guidelines Revision Group 2008, Clinical Effectiveness Group. UK National Guidelines on the Management of Syphilis 2008. Int J STD AIDS 2008; 19(11): 729-40.
- French P, Gomberg M, Janier M, Schmidt B, van Voorst Vader P, Young H. IUSTI: 2008 European Guidelines on the Management of Syphilis. Int J STD AIDS 2009; 20(5): 300-9. [Tam Metin] [PDF]
- Larsen SA, Steiner BM, Rudolph AH. Laboratory diagnosis and interpretation of tests for syphilis. Clin Microbiol Rev 1995; 8(1): 1-21. [Özet] [PDF]
İletişim (Correspondence):
Yrd. Doç. Dr. Alpay Özbek,
Dokuz Eylül Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
İnciraltı 35340, İzmir, Türkiye.
Tel (Phone): +90 232 412 4512,
E-posta (E-mail): alpay.ozbek@deu.edu.tr