COVID-19 Pandemisinde SARS-CoV-2 ve Mikrobiyolojik Tanı Dinamikleri
SARS-CoV-2 and Microbiological Diagnostic Dynamics in COVID-19 Pandemic
Selda ERENSOY1
1Ege Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, İzmir.
1Ege University Faculty of Medicine, Department of Medical Microbiology, Izmir, Turkey
Makale Atıfı: Erensoy S. COVID-19 pandemisinde SARS-CoV-2 ve mikrobiyolojik tanı dinamikleri. Mikrobiyol Bul 2020;54(3):497-509.
ÖZ
Yeni bir insan koronavirüsünün etken olduğu ölümcül ağır pnömoni ile seyreden ve hızla yayılan “Coronavirus Disease 2019 (COVID-19)” hastalığı ile Aralık 2019 tarihinde tanıştığımızdan beri, enfeksiyonun mikrobiyolojik tanısı, pandemi ile mücadelede ön plana çıkmış, hatta odak noktası olmuştur. Ağır akut solunum yolu sendromu (SARS) ile ilişkili koronavirüs türleri arasında, SARS koronavirüsü 2 (SARS-CoV-2) olarak adlandırılan etken virüsün dinamiklerini anlamak, testleri doğru stratejide kullanabilmek ve yorumlayabilmek için gereklidir. Ancak, virüs ve immün yanıt konusunda henüz netleşmemiş birçok konu bulunmaktadır. Zarflı ve pozitif polariteli büyük bir RNA genomuna sahip olan SARS-CoV-2’nin, “spike (dikensi)” S proteini ile konak hücredeki reseptörü olan anjiyotensin dönüştürücü enzim 2’ye tutunduğu, hücredeki transmembran proteaz serin 2 (TMPRSS2) ile membran füzyonunun sağlandığı gösterilmiştir. COVID-19’un kesin tanısı solunum yolu örneklerinde SARS-CoV-2 RNA testleriyle konulmaktadır. Yaygın olarak ters transkripsiyonlu polimeraz zincir reaksiyonu (RT-PCR) kullanılmaktadır. Hastalarda semptomların ortaya çıkmasından iki üç gün öncesinden başlayarak ilk hafta nazofarenks sürüntü örneklerinde veya diğer üst solunum yolu örneklerinde viral RNA saptanabilmektedir. Birinci haftadan sonra, özellikle pnömoni gelişmesi durumunda alt solunum yolu örneği tercih edilmelidir. Özellikle düşük virüs yükü olan örneklerde duyarlılık ve özgüllük sorunları yaşanmaktadır. SARS-CoV-2 RNA testlerinin klinik duyarlılığı şimdiye kadar gerçekleşen çalışma ve deneyimlere göre yaklaşık %55-75 arasında bildirilmektedir ve test negatifliğinin COVID-19 veya SARS-CoV-2 enfeksiyonunu dışlamayacağı bilinmelidir. Viral RNA pozitifliğinin de aktif ve enfeksiyöz virüs varlığının kanıtı olmadığı dikkate alınmalıdır. Antikor testleri ise virüs ile karşılaşmış olma durumunu göstermektedir. Bu testler tek başına enfeksiyon tanısı ve olgu yönetiminde kullanılmamalıdır. Antikor testleri tanıya destek olabilir ve seroepidemiyolojik çalışmalarda değerlidir. IgM, IgA ve IgG antikorlarının semptomların ortaya çıkmasından sonraki 5.-14. günlerinde saptanabildiği, ikinci haftadan sonra ve 21. günde çoğunun pozitifleştiği bildirilmektedir. IgM ve IgA testlerinde yalancı pozitiflik daha çok görülmektedir. Özellikle hastalığın ikinci haftasından sonra ve ileri dönemlerinde antikor testlerinin RNA ile birlikte ek/yardımcı test olarak kullanıldığı algoritmalarda klinik tanı duyarlılığının arttığı gösterilmiştir. Ancak, öncesinde testlerin özgüllük, duyarlılık, pozitif ve negatif öngörü değerlerinin geniş ve standart çalışmalarla belirlenmesine ve daha geniş serokonversiyon çalışmaları ile kanıt oluşturulmasına ihtiyaç vardır. Bu derlemede, SARS-CoV-2 ve mikrobiyolojik tanısı hakkında günümüze kadar elde edilen bilgi ve veriler tartışılmıştır.
Anahtar kelimeler: COVID-19, SARS-CoV-2, RNA testi, antikor testi
ABSTRACT
We have been introduced to “Coronavirus Disease 2019 (COVID-19)” disease with high mortality and transmission rate caused by a novel human coronavirus, in December 2019 and the microbiological diagnosis of the infection has been in the center of the focus to control the pandemic. It is necessary to understand the dynamics of the virus which was classified among the severe acute respiratory syndrome (SARS) related coronaviruses and named as SARS coronavirus 2 (SARS-CoV-2), to manage testing in the right strategy and for interpretation of the results. However, much remains unclear about the virus and the immune response. SARS-CoV-2, which is an enveloped, RNA virus has been shown to attach to the host cell receptor angiotensin converting enzyme 2 with spike (S) protein and membrane fusion is provided by transmembrane protease serine 2 (TMPRSS2) of the host cell. The most commonly used and reliable test for diagnosis of COVID-19 is reverse-transcribed polymerase chain reaction (RT-PCR) performed by using nasopharyngeal swabs or other respiratory tract specimens. Viral RNA is usually detected two three days before the onset of symptoms and in the first week from upper respiratory tract samples. If possible, the lower respiratory tract specimens are preferable in the second week, especially if former PCR is negative and pneumonia has developed. The clinical sensitivity of SARS-CoV-2 RNA tests has been reported around 55-75%. Negative RT-PCR test result does not exclude COVID-19 or SARS-CoV-2 infection. It should also be noted that viral RNA positivity is not an evidence of active or infectious virus. SARS-CoV-2 infection can be also detected indirectly by testing the host specific immune response to the virus. There is an increasing interest in the use of SARS-CoV-2 antibody tests both for the diagnosis and public health surveillance. However, the antibody tests should not be used as the sole test for diagnosis and case management. Antibody tests are valuable tools in seroepidemiological studies. Anti-SARS-CoV-2 IgM, IgA and IgG antibodies have been shown to be detectable as early as 5th-14th days after the onset of symptoms and most of them become positive on the 21st day. False positivity has been reported more frequently with IgM and IgA tests due to low specificity. It was shown that clinical sensitivity of the diagnostic approach increases when RNA and total antibody tests were integrated as co-tests, especially after the second week of the disease. Specificity, sensitivity, positive and negative predictive values are needed to be evaluated with large and standard studies targeting populations with different prevalences. It is also necessary to create evidence with larger seroconversion studies. In this review article, the information and data obtained until today about SARS-CoV-2 and its microbiological diagnosis have been discussed.
Keywords:COVID-19, SARS-CoV-2, RNA test, antibody test
Geliş Tarihi (Received): 19.06.2020 - Kabul Ediliş Tarihi (Accepted):13.07.2020
GİRİŞ
Yirmi birinci yüzyılın üçüncü koronavirüs salgını 2019 yılının Aralık ayında Çin’in Wuhan şehrinden viral pnömoni olgularının bildirilmesi ve hızla yayılmasıyla başlamıştır. Dünya Sağlık Örgütü (DSÖ) tarafından 30 Ocak 2020 tarihinde uluslararası toplum sağlığını tehdit eden acil durum ilan edilmiş, hastalık “Coronavirus Disease 2019 (COVID-19)” adı ile tanımlanmış ve 11 Mart 2020 tarihinde pandemi olarak ilan edilmiştir (www.who.int/emergencies/diseases/novel-coronavirus).Türkiye’de de ilk resmi olgu 11 Mart 2020 tarihinde bildirilmiştir (https://covid19bilgi.saglik.gov.tr).
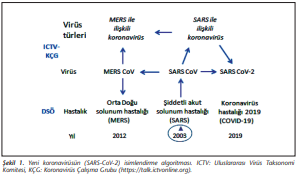
Uluslararası Virüs Taksonomi Komitesi (ICTV), etken virüsü (Şekil 1)’deki algoritmada özetlendiği gibi “ağır akut solunum yolu sendromu (SARS) ile ilişkili koronavirüs türleri arasında “SARS koronavirüsü 2 (SARS-CoV-2)” olarak adlandırmıştır (https://talk.ictvonline.org).
Salgının fark edilmesiyle birlikte, çok sayıda deneyim ve çalışma, çoğunluğu hakem değerlendirmesinden geçmeden önce serbest erişimle yayımlanarak birikmektedir.
COVID-19 dinamikleri bu bilgilerle anlaşılmaya çalışılmakta ve pandemi ile mücadelede kullanılmaktadır. Bu derlemede, SARS-CoV-2 ve mikrobiyolojik tanısı hakkında günümüze kadar elde edilen bilgi ve verilerin aktarılması amaçlanmıştır.
Koronavirüsler
Koronavirüsler, Nidovirales takımı altında, Coronaviridae ailesine ait yaklaşık 80-160 nm büyüklüğünde, helikal kapsidli, segmentsiz, pozitif polariteli, tek sarmallı RNA genomları olan virüslerdir. Virüse taç görünümü veren “corona” zarfa sahiptirler[1].
Doğada yaygın olarak farklı türlerde dolaşan koronavirüslerin türler arası bulaşması, nispeten büyük olan genomlarında nokta mutasyonların birikmesi ve rekombinasyonlar yeni tiplerin ortaya çıkmasına neden olmaktadır[1].
Koronavirüsler; alfa, beta, gama, delta olmak üzere dört cinse ayrılmaktadır[1]. İnsanlarda enfeksiyona neden olan koronavirüslerin tümü alfa ve beta cinsinde bulunmaktadır. Sıklıkla kış ve ilkbahar aylarında üst solunum yolu enfeksiyonlarının %15-30’unda etken olarak insan koronavirüsleri “human coronavirus (HCoV)”; 229E, OC43, NL63, HKU1 saptanmaktadır[1]. Beta-koronavirüslerin rezervuarı olan yarasalar dünyada virüsün yayılmasına neden olmaktadır[2].
SARS-CoV-2’nin Yapısı ve Genomu
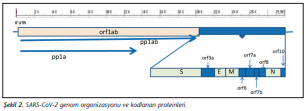
SARS-CoV-2’nin genomu 29.8-29.9 kb büyüklüğünde ve 5’ yönünde üçte ikisinden büyük bir kısmı ORF1ab “open reading frame (açık okuma çerçevesi)” yapısal olmayan poliproteinlerini kodlar. Replikaz olarak da tanımlanan bu poliproteinler (pp1a ve pp1ab), viral proteazlar [3C-benzeri proteaz (3CLpro) ve papain-benzeri proteaz (PLpro)] tarafından yapısal olmayan (ns) 16 proteine parçalanır. Virüsün genomunun replikasyonunu sağlayan RNA’ya bağımlı RNA polimeraz enzimi (RdRp) yapısal olmayan bu proteinlerdendir[2],[3].
Genomun 3’ yönünde üçte biri ise yapısal proteinleri olan yüzey dikensi (S) glikoproteinleri, zarf (E), membran/matriks (M) glikoproteini ve nükleokapsid (N) fosfoproteini kodlamaktadır. Ek altı olarak, aksesuar protein de; ORF3a, ORF6, ORF7a, ORF7b, ORF8 ve ORF10 genlerinden kodlanmaktadır[3]. (Şekil 2)’de SARS-CoV-2 genom organizasyonu gösterilmiştir.
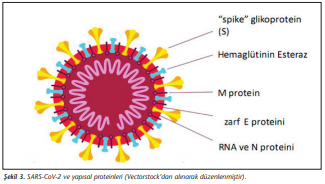
SARS-CoV-2 yapısal proteinleri arasında yer alan dikensi (S) glikoproteinler, virüsün konak hücresine girmesi için gerekli olan en büyük yapılarıdır. SARS-CoV-2’nin reseptöre bağlanan bölgesi (RBD)’nin insan anjiyotensin dönüştürücü enzim 2 (ACE2)’sine iyi bağlanmasını sağlayan altı kritik aminoasit belirlenmiştir[3]. Zarf (E) proteinleri, küçük miktarlarda bulunmakta olup iyon kanalları olarak görev görür ve patogenez için gereklidir. Membran/matriks (M) proteinleri, virüs yapısında bol miktarda bulunmakta ve virüs membranının yapısını oluşturmakla birlikte nükleokapside bağlanması için gereklidir. Nükleokapsid (N) fosfoproteinleri ise virüs RNA’sını çevreler ve şeklini korumasını sağlar. SARS-CoV-2 yapısal proteinleri (Şekil 3)’te şematik olarak gösterilmiştir.
SARS-CoV-2’nin Replikasyon Döngüsü
SARS-CoV-2’nin konak hücreye girişi: Virüsün konak hücreye tutunup girişini sağlayan reseptör ACE2’dir. Bu molekül akciğerlerde, kalpte, damarlarda, böbreklerde ve bağırsakta bol miktarda bulunur. Virüs S proteini ile ACE2’ye tutunur ve S proteini hücresel proteaz ile S1 ve S2 olmak üzere iki alt birime ayrılır. S1, ACE2’ye bağlanırken, S2 konak hücrenin yüzeyindeki transmembran serin proteaz 2 (TMPRSS2) tarafından ayrılır ve aktive edilir. Böylece, konak hücre ile virüs membranlarının füzyonu gerçekleşir ve RNA genomu konak hücrenin sitoplazması içine girer[3]-[5].
Furin ve diğer proteazlar tarafından etkili biçimde bölünen ve viral enfektivite ile konak tropizminde belirleyici olduğu düşünülen polibazik bölünme bölgesi, SARS-CoV-2 S1 ve S2 birleşiminde yer alan Prolin-Arginin-Alanin-Arginin-Arginin (RRARR) dizilimini içeren özgün bir değişimdir. Bu bölgedeki prolin O-bağlı glikanların eklenmesini sağlar[3]-[5]
Transkripsiyon ve translasyon: Hücre tarafından poliproteinlerin translasyonu ve viral proteazların sentezi sağlanır. Poliproteinler (pp1a ve pp1ab) 3CLpro ve PLpro protezlar ile 16 yapısal olmayan proteine parçalanır. RNA’ya bağımlı RNA polimeraz ile birlikte replikasyon kompleksi oluşur ve negatif RNA kalıbı sentezlenir. Bu RNA kalıbı üzerinden RNA genomu çoğaltılır ve virüsün yapısal ve aksesuar proteinlerinin translasyonu için gerekli olan subgenomik ulak RNA’lar (mRNA) yapılır.
Nükleokapsidin paketlenmesi: Sentezlenen proteinler endoplazmik retikulum ve Golgi aparatı aracılığıyla yeni virüs partikülleri oluşacak şekilde toparlanır.
Tomurcuklanma ve hücre dışına salınma: Golgi veziküllerinden tomurcuklandıktan sonra olgun SARS-CoV-2 virionları ekzositoz ile konak hücreden salınır.
SARS-CoV-2’nin Diğer Koronavirüslerle Benzerliği
Beta-koronavirüsler içinde yeni bir üye olarak tanımlanan SARS-CoV-2’nin Sarbecovirus alt cinsi ile ilişkili olduğu gösterilmiştir. Sarbekovirüsler içinde ağır akut solunum yolu sendromu koronavirüsü (SARS-CoV), Orta Doğu solunum yolu sendromu koronavirüsü (MERS-CoV) ve çeşitli yarasalardan izole edilen SARS ile ilişkili koronavirüsler bulunmaktadır. SARS-CoV-2’nin tam genom dizi analizlerinde SARS-CoV ile yaklaşık %79 dizi benzerliği bulunurken, Çin’in Yunnan eyaletinde nal burunlu yarasalardan (Rhinolophus) izole edilen iki beta-koronavirüs (RaTG13 ve RmYN02) ile %96 ve %97 oranlarında benzerlik bulunmuştur[2]-[6] Ancak, tüm genomdaki benzerlik oranlarının yanı sıra spesifik gen bölgelerinin değerlendirilmesi önemlidir. SARS-CoV-2 ve RaTG13’ün RBD benzerliği %85, RmYN02 S proteini benzerliği ise %72 olarak gösterilmiştir[2].
SARS-CoV-2’nin Ara Konağı
Yarasa koronavirüslerinin insana bulaşmada bu denli uyumlu hale gelmelerini sağlayan ara konak kesin olarak belirlenememiştir. Uzak Doğu’da kuyruklu, pullu sürüngenler olan pangolinlerden izole edilen koronavirüste RBD’de ACE2 reseptörüne bağlanmaya uyumlu protein şeklini sağlayan SARS-CoV-2’deki altı kritik mutasyonun hepsinin tanımlanmış olması ve RBD’de %97 benzerlik bulunması ara konak olarak düşünülmesine neden olmuştur[2],[4],[6]. Ancak genomun diğer bölgelerindeki benzerliğin daha düşük olduğu gösterilmiştir ve vahşi doğada çok fazla hayvan türünde koronavirüsler bulunduğu bilinmektedir[2],[6]. Kaynağının ve gelişiminin izini sürmek için çok sayıda hayvan türlerinden ve topluluklarından örnekler alınarak genomik analizler yapılmasına ihtiyaç vardır. Çok daha önceden insanlarda dolaşırken daha uyumlu hale gelecek mutasyonları kazanmış olma olasılığı da vardır. Vahşi doğanın içine girdikçe ve ekosisteme müdahaleler sürdükçe benzer zoonotik salgınların kaçınılmaz olduğu da bir gerçektir.
SARS-CoV-2’de Mutasyon Hızı
Diğer RNA virüslerine göre mutasyon hızının düşük olduğu bildirilmesine karşın, yüksek replikasyon ve yayılma hızı ile uyumu sağlayan mutasyonların birikme olasılığı artar. Evrilme hızı 1 x 10-3 ile 7 x 10-4/bölge/yıl olarak hesaplanmaktadır[7]. Farklı coğrafik bölgelerdeki bulaşmayı veya replikasyonu artırabilecek ya da hastalığın ağır seyretmesine neden olabilecek farklı SARS-CoV-2 tipleri üzerine birçok çalışma bildirilmektedir. Ancak mutasyonların etkilerini fonksiyonel ve epidemiyolojik olarak değerlendirirken, konak faktörleri ve toplumların özelliklerinin etkisi göz ardı edilmemelidir. Bazı araştırmacılar, önemli olduğunu öne sürdükleri mutasyonlara dayanarak aminoasit varyantları üzerinden L/S (ORF8 S84L; Lösin/Serin) veya A, B, C ya da S, V, G (D614G varyantı) gibi SARS-CoV-2 filogenetik soyları (“clade”) önermişlerdir[7]. Ancak bu tanımlamalar henüz ortak bir karar ile kabul edilmemiştir ve analizlere itirazlar da vardır. Tam genom analizleri ve virüsün fonksiyonlarına etkilerinin araştırılması ile tekrarlayan mutasyonların konağa adaptasyonları gösterilmeye devam etmektedir.
Tüm dünyadan izole edilen SARS-CoV-2 genom dizileri GISAID web tabanında filogenetik analizle birlikte yer almaktadır(https://www.gisaid.org/). Türkiye’de izole edilip yüklenmiş olan 62 gen dizisinin incelendiği çalışmada, bulaşma hızı ve immünepitop özelliği hakkında tartışılan D614G de dahil olmak üzere, Avrupa, Asya, Kuzey Amerika, Okyanusya’daki dizilerde sık rastlanan çeşitli mutasyonlar belirlenmiştir[8].
COVID-19 Mikrobiyolojik Tanısı
COVID-19 kesin tanısı, solunum yolu örneklerinde ters transkripsiyonlu polimeraz zincir reaksiyonu (RT-PCR) ile SARS-CoV-2 RNA’sı araştırılarak konulmaktadır. Virüs ile karşılaşmayı gösteren antikor testlerinin ise tanıda ve olgu yönetiminde tek başına kullanımı şu ana kadar elde edilen veriler ve olanaklarla uygun değildir ancak salgının durumunu ortaya koymak için seroepidemiyolojik çalışmalarda anlamlıdır. COVID-19 tanı algoritmasında, hastalığın geç döneminde RT-PCR ile birlikte antikor testlerinin destekleyici olarak kullanılabilmesi için veri oluşturulup değerlendirilmelidir.
Yeni koronavirüsün tanımlanması ve kısa süre içinde virüsün tam genomunun nükleik asit dizilerinin yayımlanması ile birlikte, hızla geliştirilen tanı testlerinin sayı ve çeşitleri sürekli artmaktadır. Test protokolleri, kitler ve değerlendirmeleri DSÖ, “Centers for Disease Control and Prevention (CDC), “Food and Drug Administration (FDA)” sayfalarında yayımlanmaktadır ((https://www.who.int/emergencies/diseases/novel-coronavirus-2019/technical-guidance/laboratory-guidance),(https://www.cdc.gov/coronavirus/2019-ncov/lab/rt-pcr-panel-primer-probes.html),(https://www.fda.gov/medical-devices/emergency-situations-medical-devices/emergency-use-authorizations)).
Salgın dinamiği içinde çalışmalar ve deneyimlerle veriler değerlendirilmekte, tanı yaklaşımları ve algoritmaları güncellenmeye devam etmektedir. Ulusal rehberlerin yanı sıra DSÖ, CDC, Avrupa CDC, “Infectious Diseases Society of America (IDSA)” gibi kuruluşlar da algoritma önerilerini güncelleyerek paylaşmaktadır. Benzer şekilde, Türkiye’de de Sağlık Bakanlığı rehberleri ve algoritmaları güncellenerek paylaşılmaktadır.
Erken tanı kapasitesinin artırılması, hastaların zamanında tedaviye alınmasını sağlamasının yanı sıra sağlık sisteminin etkin yönetilmesi, pozitif kişilerin izolasyonu ve temaslılarının taranması ile toplum sağlığı açısından da son derece önemlidir. Pandemi sürecinde DSÖ ve FDA, testlerin hızlı değerlendirme ve acil onay [Emergency Use Authorization (EUA)] mekanizmasını uygulamaktadır.
Sağlık Bakanlığı Türkiye Halk Sağlığı Genel Müdürlüğü Mikrobiyoloji Referans Laboratuvarları-Viroloji Laboratuvarında geliştirilen SARS-CoV-2 RNA test kiti başlangıçta merkezde, ardından Halk Sağlığı Laboratuvarlarında ve sonrasında yetkilendirilen 110’un üzerinde kurumda COVID-19 mikrobiyolojik tanı testi olarak uygulanmaktadır(https://covid19bilgi.saglik.gov.tr).
SARS-CoV-2 RNA Testleri (RT-PCR)
Viral RNA’yı saptamak için en yaygın kullanılan test, RT-PCR ile nükleik asit amplifikasyon yöntemidir. Testin başarılı olması için örnekte testin saptayabileceği miktarda (alt saptama sınırı) viral RNA bulunması gerekmektedir[9]-[12].
Test için uygun klinik örnekler: COVID-19 hastalığının viral dinamikleri ile şimdiye kadar elde edilen veriler, virüsün enfeksiyonun ilk haftasında üst solunum yollarında, ikinci haftadan itibaren ise alt solunum yollarında saptandığını göstermektedir. Bu nedenle, ilk standart örnek olarak nazofarenks sürüntü örneği tercih edilmelidir. Orofarenksten de sürüntü örneği alınabilmekle birlikte, testin duyarlılığını artırmak amacıyla nazofarenks sürüntüsü ile beraber alınması ve aynı örnekte birleştirilmeleri önerilmektedir. Örneğin alınmasını kolaylaştırmak için orta burun ve ön burun örneklerinin de kullanılabileceğini gösteren çalışmalar vardır. Tükürük kolay alınabilen bir örnek olduğu için yoğunlaştırma, arka orofarenksten toplama gibi duyarlılığı artırmaya yönelik işlemler uygulanabilmektedir[9]-[11].
Hastalığın ileri dönemlerinde pnömoni geliştiği zaman alt solunum yolu örneği tercih edilmelidir. Hasta balgam çıkarıyorsa tanıda balgam örneğinin kullanılması uygun olmakla birlikte indüksiyon yapılmamalıdır. Örneğin alınması sırasında aerosol oluşturacak işlemlerden kaçınmak için azami dikkat gösterilmelidir. Trakeal aspirat, bronkoalveoler lavaj gibi alt solunum yolu örnekleri de tanıda klinik örnek olarak kullanılabilir[9]-[12].
Hastalığın evresine göre alınan klinik örneğin uygunluğunun yanı sıra yeterli örneğin uygun eküvyon ile alınması, kullanılan taşıyıcı ortam, analize kadar geçen süre de testin başarısını etkilemektedir. Örneklerin alınma şekli, taşıma ortamları, transport ve saklama koşulları DSÖ, CDC ve Sağlık Bakanlığı COVID-19 rehberlerinde ayrıntılı olarak açıklanmıştır.
Virüs Dinamikleri
Virüs bulaşmasından sonra kısa süre içinde üst solunum yolunda viral RNA saptanmakta ve semptomların ortaya çıkmasından önceki bir-iki gün içinde yüksek düzeylere çıkmaktadır. Ağır hastalığı olanlarda ortalama 17 gün (14-30 gün), hafif olgularda ise ortalama 14 gün (10-21 gün) solunum yolu örneklerinde viral RNA’nın bulunduğu gösterilmiştir[10],[13],[14]. Viral RNA negatifliğinin ardından düşük düzeylerde RNA oynamaları nedeniyle tekrar pozitif sonuçlar elde edilebileceği gösterilmiş ve CDC tarafından da özellikle 65 yaş üzerindeki hastalarda daha uzun süre izlem önerilmiştir[10],[12],[14]. RNA pozitifliğinin 56 güne kadar devam ettiği gösterilmiş olmasına karşın, saptanan RNA’nın enfeksiyöz virüs varlığını göstermediği dikkate alınmalıdır. Bunun için virüs kültürü, hatta kültürde enfeksiyöz özelliği belirleyen testlerin yapılması gerekmektedir.
Virüs RNA’sının solunum yolu dışında dışkıda yüksek oranda ve 31. güne kadar uzun sürede atıldığı gösterilmiştir[11],[15]. Dışkıda saptanan RNA pozitifliğinin enfeksiyöz özelliği bilinmemekle birlikte, CDC’de bu konuda dikkatli ve temkinli olunmasını önermektedir.
Hafif veya asemptomatik SARS-CoV-2 enfeksiyonlarında ve semptom öncesi dönemde viral RNA’nın saptanabildiği ve bulaştırıcılığın da olabildiği gösterilmiştir[16],[17]. Salgın kontrolünde asemptomatik ve hafif olguların saptanabilmesi için olanaklar ve koşullar doğrultusunda değerlendirmelerle etkin stratejiler oluşturulmalıdır.
RNA Testinde Hedeflenen Gen Bölgeleri
Kullanılan çeşitli test tasarımlarında genellikle RdRp, ORF1, S, N, E genleri hedeflenmektedir. Tek veya iki gen bölgesini hedefleyen test protokolleri geliştirilmiştir. DSÖ ile iş birliği bulunan “Foundation for Innovative New Diagnostics (FIND)” örgütü (www.finddx.org/covid-19/) ve FDA web sayfalarında protokollerin ve testlerin değerlendirme sonuçları görülebilir. Test protokollerinin ve kitlerin düzenli olarak yapılan kalite değerlendirme çalışmalarının sonuçlarının paylaşılması ve analizi sistemlerin iyileştirilmesi için kullanılmalıdır.
Primer-prob setlerinin karşılaştırıldığı ve çevrim içi yayımlanmış çalışmalarda genellikle benzer alt saptama düzeyleri bildirilmekle birlikte, özellikle virüs yükünün düşük olduğu örneklerde hem sistemler hem de laboratuvarlar arası duyarlılık ve özgüllük farkları görülebilmektedir[18],[19]. Bu testlerde seçilen gen bölgelerinin yanı sıra oligonükleotitlerin seçimi, doğru bağlanma sıcaklıklarının belirlenmesi ve test tasarımları önemlidir. Örneğin, salgının başında yaygın kullanılan Charite RdRp ve CDC N3 protokollerinde duyarlılığın düşük olduğu ve primer tasarımlarında hata fark edilmiştir[18],[19].
SARS-CoV-2 RNA Testinin Performansı
Klinik duyarlılığa ait kanıt oluşturacak henüz net veri ve standardizasyon olmamakla birlikte, az sayıda basılı veya çevrim içi ya da henüz hakem değerlendirmesinden geçmemiş çalışmalara ait verilerde olası COVID-19 olgularında %2’den %40’a kadar yanlış negatif sonuçlar izlenmektedir[9],[11]. Bu nedenle, RT-PCR ile negatif sonuç alınması COVID-19 tanısını dışlamamaktadır. Ulusal ve uluslararası rehberlerde COVID-19 şüpheli olgularda RT-PCR test sonucunun negatif olması durumunda, 24 saat sonra mümkünse alt solunum yolu örneği olan yeni bir örnek alınarak testin tekrarlanması önerilmektedir.
Sağlık Bakanlığı “SKS Işığında COVID-19 Tanı Laboratuvarları Kalite Yönetimi Rehberinde” (https://kalite.saglik.gov.tr/TR,66534/sks-isiginda-covid-19-tani-laboratuvarlari-kalite-yonetimi-rehberi) ülkemizde uygulanan SARS-CoV-2 RT-PCR testi özelinde kalite yönetiminde dikkat edilmesi gereken konular açıklanmaktadır. Yalancı negatif sonuçların başlıca nedenleri arasında; yetersiz veya hastalık dönemine göre uygun olmayan bölgeden alınmış örnek, örneğin transfer veya saklama koşullarının uygun olmaması, testin analitik duyarlılığının düşük olması veya teste ait teknik sorunlar bulunmaktadır. Yalancı pozitiflik ise, kontaminasyon, nonspesifik reaksiyonlar veya testin özgüllük sorunu nedeniyle başka hedeflere ait reaksiyonlara ait pozitif yanıt şeklinde açıklanabilir.
Kullanılmakta olan kalitatif RT-PCR testlerinde, sinyalin saptanmaya başladığı eşik döngü sayısı (Ct) ile virüs yükünün ters orantılı olması beklenmektedir. Yüksek Ct sayıları düşük düzeyde virüs olduğunu göstermekle birlikte, sigmoidal PCR eğrisi olup olmadığı değerlendirilmeli ve nonspesifik ışımalar yönünden incelenmelidir.
Uyumsuz ya da kuşkulu sonuçlarda yeni bir örnekle, farklı bir gen bölgesini hedefleyen bir test ile tekrar veya nükleik asit dizi analizi ile doğrulama uygundur. Örneklerin işleme alınmasında kritik basamak olan nükleik asit izolasyonundan başlamak üzere tüm süreç boyunca yöntem onayı, iç ve dış kalite değerlendirme basamaklarının doğru uygulanması gerekmektedir.
Artan test kapasitesi ihtiyacına karşılık olarak, hızlı sonuç almak ve biyogüvenliği sağlamak amacıyla numunenin doğrudan parçalayıcı solüsyon içine alınması ve ek izolasyon basamağına gerek bırakmayan protokoller ülkemizde de kullanılmaktadır.
Hızlı SARS-CoV-2 RNA Testleri
Bir saatten kısa sürede, genellikle 15 dakikada sonuç veren “Reverse transcription-loop mediated isothermal amplification (RT-LAMP)” teknoloji gibi tek sıcaklık derecesinde çalışan testlerde üreticiler tarafından yüksek duyarlılık ve özgüllük bildirilmektedir[20]. Bu testlerin tanıda etkinliğinin belirlenmesi için değerlendirmelere ihtiyaç vardır. Çeşitli ticari firmalar tarafından geliştirilen hızlı ve tam otomatize SARS-CoV-2 testleri bulunmaktadır. SARS-CoV-2’nin solunum virüsleri paneline katıldığı hızlı ticari kitlerden FDA EUA onayı alanlar FDA sayfasında görülmektedir.
Viral Antijen Testleri
Aktif enfeksiyon taramasında antijen testleri, kullanım kolaylığı ve düşük maliyet yönünden faydalı olabilmektedir. Testin başarılı olması için viral proteini yakalayacak yüksek kalitede antikorların üretilebilmesi gerekir. İlk testlerde etkinlik yetersizliği gözlendiği için henüz kullanıma girememiştir. Yeni testler geliştirilmektedir ve immünofloresans yatay akım yöntemi ile nükleokapsid antijenini saptayan hızlı antijen testi FDA EUA onayı almıştır. FDA web sayfasında da görülebileceği gibi üretici firma tarafından %80 duyarlılık ve %100 özgüllük tanımlanmaktadır. Bu ve benzeri antijen testlerinin gerçek hayatta, özellikle kritik grupların taramasında kullanılabilmesi için değerlendirilmesi önem taşımaktadır.
Antikor Testleri
SARS-CoV-2 enfeksiyonu tanısında antikor testlerinin anlam ifade etmesi için immün yanıtın dinamikleri, süresi ve koruyucu immün yanıtın oranı hakkında halen netleşmeyen konuların aydınlatılması gereklidir. Antikor testlerinde sıklıkla nükleokapsid (N) veya S (S1, RBD) proteini kullanılmaktadır. Hızlı immünokromatografik antikor testlerine göre ELISA ve CLIA testlerinin özgüllük ve duyarlılığına daha çok güvenilmektedir[9],[14],[20].
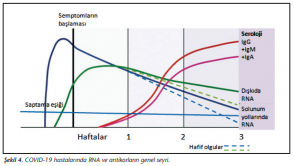
İlk çalışmalarda virüse karşı özgül antikorların (IgM, IgG, IgA) semptomların başlamasından sonra ikinci haftada yükselmeye başladığı gösterilmiştir[9],[12],[14],[21] (Şekil 4). Genelde semptomların başlamasından sonra üçüncü ve dördüncü haftada tüm hastalarda IgM ve IgG serokonversiyonu olduğu ve IgM’in beşinci haftada düştüğü, hatta önemli bir kısımda yedinci haftada kaybolduğu gösterilmiştir[12],[14],[21]. Ciddi seyirli olgularda genelde antikor düzeyi daha yüksek bildirilmektedir[9],[14],[21].
Antikor Testlerinin Tanıya Katkısı
Geniş kapsamlı, etkinlik karşılaştırması ve izlem yapan yeterli çalışma olmasa da, sınırlı çalışma ile SARS-CoV-2 enfeksiyonu tanısında ikinci haftada tek başına RT-PCR ile yaklaşık %52-54 olan duyarlılığın, RT-PCR ve ELISA total (IgM + IgG) antikor testi birlikte kullanıldığında %97-99’a yükseldiği gösterilmiştir[14],[21],[22] İlk 5.5 günde RT-PCR duyarlılığı daha yüksekken, sonrasında IgM ELISA pozitiflik oranı daha yüksek bulunmuştur[9],[14],[21]. Hastalığın ileri dönemlerinde RT-PCR testlerine destek olarak kullanılabilmesi için duyarlılık ve özgüllüğü kanıtlanmış testlerle yeterli kanıt oluşturulmalıdır.
Long’un çalışmasında[21] SARS-CoV-2 IgG ve IgM yanıtlarının kişiler arasında farklılık gösterdiği; IgM’nin veya IgG’nin önce çıktığı ya da ikisinin aynı zamanda saptanabildiği görülmektedir. IgA antikor yanıtı erken çıkmakta ve IgG’ye benzer şekilde devam etmektedir, ancak gözlenen özgüllük sorunu ve yeterince değerlendirilmediği için literatürde arka planda kalmıştır.
Antikor Testleri ve Koruyucu Bağışıklık
ELISA ile yüksek düzeyde saptanan IgG antikorlarının nötralizan antikorlarla korelasyonu çalışmalarda gösterilmekle birlikte, pozitif antikor test sonucunu nötralizan antikor yerine kullanmak için henüz yeterli kanıt bulunmamaktadır[9] . Askeri uçak görevlilerinde başlayan ve genelde hafif ya da asemptomatik bulaş durumlarında ortaya çıkan SARS-CoV-2 salgınında antikor saptanan kişilerin ancak %59.2’sinde nötralizan antikor gösterilebilmiştir[23] .
Nötralizan antikorların araştırılması için hücre kültürü ve biyogüvenlik düzeyi 3’ün gerekmesi ve zahmetli olması nedeniyle, bu yöntemin rutin laboratuvarlarda uygulanabilmesi zordur. Bu nedenle, enfeksiyöz olmayan yalancı tipte virüsle geliştirilen nötralizasyon testleri ve S proteinin RBD’ye karşı antikorla yarışma temelli dolaylı testler kullanımda başarılı olursa, sıvısal immünite araştırılmasında kolaylık sağlayacaktır.
Sıvısal immünitenin yanı sıra COVID-19 uzun süreli bağışıklık ile ilgili olarak hücresel immünitenin araştırılması, T hücre yanıtlarının analizi ve anlaşılması kritik öneme sahiptir.
Sonuç
COVID-19 hastalığının etkeni olan SARS-CoV-2’nin dinamikleri ve bağışıklığının doğası hakkında halen netleşmesi gereken açık konular vardır. Şu anki koşullar ve bilgiler ışığında, akut başlangıçlı yeni hastalık tanısında yapılması gereken RT-PCR yöntemi ile viral RNA’nın araştırılmasıdır.
Pandeminin başlangıcından beri elde edilen veriler, enfeksiyöz dönemin semptomlardan yaklaşık iki gün önce başladığını ve semptomların ortaya çıkmasından sonra 7-10 gün sürdüğünü göstermektedir. Solunum yollarında virüs replikasyonunun genellikle ikinci haftada azaldığı görülmekle birlikte, RNA pozitifliği daha uzun süre devam edebilmektedir.
SARS-CoV-2 enfeksiyonunun dolaylı tanısı için çalışılan özgül IgM, IgA, IgG anti-SARS antikorları virüsle karşılaşılmış olduğunu göstermektedir. Semptomların ortaya çıkmasından sonraki 5.-14. günlerinde saptanabildiği, ikinci haftadan sonra 21. günde genellikle birçok olguda pozitifleştiği gösterilmiştir. Akut ve erken dönemde tek başına olgu tanısı ve yönetiminde kullanılmaları uygun bulunmamıştır ancak epidemiyolojik çalışmalar açısından değerlidir. Şu anki veriler, antikor testinin pozitif olmasının hastalığa karşı koruyucu olduğunun kabul edilmesi için yeterli değildir, bunun için nötralizasyon testlerine gereksinim bulunmaktadır.
Bulaş zincirini kırmada COVID-19 enfeksiyonunun tanısının konulması kritik bir basamak olduğundan, test stratejisi ve algoritmaları; mevcut bilimsel kanıtlar/veriler, olanaklar ve koşullar değerlendirilerek öncelikli çalışmalarla belirlenmelidir. Semptomatik olguların tanısının konulmasının öncelikli olarak sağlanması gerekmekle birlikte, temas ve bulaştırma riski yüksek olanlar ile özel cerrahi girişim, immünsupresif tedavi gibi COVID-19’un yüksek mortalite riski taşıdığı kritik risk gruplarının aktif enfeksiyon yönünden taranmasına da gereksinim bulunmaktadır.
Pandemi gibi olağanüstü durumlarda hızlı bir şekilde test kapasitesinin artırılması için hazırlıklı olunması, yetkin insan gücünün tükenmişlik içine düşmesinin önüne geçecek şekilde organize edilmesi, bu amaçla iletişim ve sürekli bilgi akışının paylaşılması, plan, strateji ve rehberlerin yaygın işbirliği ile üretilmesi değerlidir.
ÇIKAR ÇATIŞMASI
Yazar bu makale ile ilgili herhangi bir çıkar çatışması bildirmemişlerdir.
KAYNAKLAR
- Su S, Wong G, Shi W, Liu J, Lai ACK, Zhou J, et al. Epidemiology, genetic recombination, and pathogenesis of coronaviruses. Trends Microbiol 2016; 24(6): 490-502.
- Zhang YZ, Holmes EC. A genomic perspective on the origin and emergence of SARS-CoV-2. Cell 2020; 181(2): 223-7.
- Hoffmann M, Kleine-Weber H, Schroeder S, Kruger N, Herrler T, Erichsen S, et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell 2020; 181(2): 271-80.
- Andersen KG, Rambaut A, Lipkin WI, Holmes EC, Garry RF. The proximal origin of SARS-CoV-2. Nat Med 2020; 26(4): 450-2.
- Liu C, Zhou Q, Li Y, Garner LV, Watkins SP, Carter LJ. Research and development on therapeutic agents and vaccines for COVID-19 and related human coronavirus diseases. ACS Cent Sci 2020; 6(3): 315-31.
- Forster P, Forster L, Renfrew C, Forster M. Phylogenetic network analysis of SARS-CoV-2 genomes. Proc Natl Acad Sci USA 2020; 117(17): 9241-3.
- Feyzioğlu B. SARS-CoV-2 kökeni. J Biotechnol and Strategic Health Res 2020; 1(Özel Sayı): 1-9.
- Demir AB, Benvenuto D, Abacıoğlu YH, Angeletti S, Ciccozzi M. Identification of the nucleotide substitutions in 62 SARS-CoV-2 sequences from Turkey. Turk J Biol 2020; 44(SI-1): 178-84.
- To KWK, Tsang TYO, Leung WS, Tam AR, Wu TC, Lung DC, et al. Temporal profiles of viral load in posterior oropharyngeal saliva samples and serum antibody responses during infection by SARS-CoV-2: an observational cohort study. Lancet Infect Dis 2020; 20(5): 565-74.
- Zou L, Ruan F, Huang M, Liang L, Huang H, Hong Z, et al. SARS-CoV-2 viral load in upper respiratory specimens of infected patients. N Engl J Med 2020; 382(12): 1177-9.
- Wang W, Xu Y, Gao R, Lu R, Han K, Wu G, et al. Detection of SARS-CoV-2 in different types of clinical specimens. JAMA 2020; 323(18): 1843-4.
- Liu R, Han H, Liu F, et al. Positive rate of RT-PCR detection of SARS-CoV-2 infection in 4880 cases from one hospital in Wuhan, China, from Jan to Feb 2020. Clin Chim Acta 2020; 505: 172-5.
- Wu J, Liu X, Liu J, Liao H, Long S, Zhou N, et al. Coronavirus disease 2019 test results after clinical recovery and hospital discharge among patients in China. Jama Netw Open 2020; 3(5): e209759.
- Yongchen Z, Shen H, Wang X, Shi X, Li Y, Yan J. Different longitudinal patterns of nucleic acid and serology testing results based on disease severity of COVID-19 patients. Emerg Microbes Infect 2020; 9(1): 833-6.
- Zhang W, Du RH, Li B, Zheng XS, Yang XL, Hu B, et al. Molecular and serological investigation of 2019-nCoV infected patients: implication of multiple shedding routes. Emerg Microbes Infect 2020; 9(1): 386-9.
- Arons MM, Hatfield KM, Reddy SC, Kimball A, James A, Jacobs JR, et al. Presymptomatic SARS-CoV-2 infections and transmission in a skilled nursing facility. N Engl J Med 2020; 382(22): 2081-90.
- Bai Y, Yao L, Wei T, Tian F, Jin DY, Chen L, et al. Presumed asymptomatic carrier transmission of COVID-19. JAMA 2020; 323(14): 1406-7.
- Nalla AK, Casto AM, Huang MLW, Perchetti GA, Sampoleo R, Shrestha L, et al. Comparative performance of SARS-CoV-2 detection assays using seven different primer-probe sets and one assay kit. J Clin Microbiol 2020; 58(6): e00557-20.
- Muenchhoff M, Mairhofer H, Nitschko H, Grzimek-Koschewa N, Hoffmann D, Berger A, et al. Multicentre comparison of quantitative PCR-based assays to detect SARS-CoV-2, Germany, March 2020. Euro Surveill 2020; 25(24): 2001057.
- Yan C, Cui J, Huang L, Du B, Chen L, Xue G, et al. Rapid and visual detection of 2019 novel coronavirus (SARS-CoV-2) by a reverse transcription loop-mediated isothermal amplification assay. Clin Microbiol Infect 2020; 26(6): 773-9.
- Long QX, Liu BZ, Deng HJ, Wu GC, Deng K, Chen YK. Antibody responses to SARS-CoV-2 in patients with COVID-19. Nat Med 2020; 26(6): 845-8.
- Xiao AT, Gao C, Zhang S. Profile of specific antibodies to SARS-CoV-2: the first report. J Infect 2020; 81(1): 147-78.
- Payne DC, Smith-Jeffcoat SE, Nowak G, Chukwuma U, Geibe J, Hawkins R, et al. SARS-CoV-2 infections and serologic responses from a sample of U.S. navy service members-USS Theodore Roosevelt, April 2020. MMWR Morb Mortal Wkly Rep 2020; 69(23): 714-21.
İletişim (Correspondence):
Prof. Dr. Selda Erensoy,
Ege Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
İzmir, Türkiye.
Tel (Phone):+90 532 384 1003,
E-posta (E-mail): selda.erensoy@ege.edu.tr,