Toxoplasma gondii'nin İnvazyonundan Sorumlu Hedef Rhoptry Neck Protein (RON) Geninin
siRNA Transfeksiyonu ile Susturulması
Silencing the Target Rhoptry Neck Protein (RON) Gene Responsible For the
Invasion of Toxoplasma gondii with siRNA Transfection
Merve Y�R�K1, T�lay AKSOY2, Eda SİVCAN1, Hilal NERGİZ3
1 Erciyes �niversitesi Tıp Fak�ltesi, Tıbbi Parazitoloji Anabilim Dalı, Kayseri.
1 Erciyes University Faculty of Medicine, Department of Medical Parasitology, Kayseri.
2 İn�n� �niversitesi Tıp Fak�ltesi, Tıbbi Parazitoloji Anabilim Dalı, Malatya.
2 İn�n� University Faculty of Medicine, Department of Medical Parasitology, Malatya, Turkey.
3 Erciyes �niversitesi Tıp Fak�ltesi, Kayseri.
3 Erciyes University Faculty of Medicine, Kayseri, Turkey.
* Bu �alışma; Erciyes �niversitesi Bilimsel Araştırma Projeleri Birimi tarafından (Proje no: TDK-15-6147) desteklenmiş ve �alışmanın sonu�ları Uluslararası Katılımlı 20. Ulusal Parazitoloji Kongresi (25-29 Eyl�l 2017, Eskişehir)'nde s�zl� bildiri olarak sunularak ikincilik �d�l� almıştır.
Makale Atıfı: Y�r�k M, Aksoy T, Sivcan E, Nergiz H. Toxoplasma gondii'nin İnvazyonundan Sorumlu Hedef Rhoptry Neck Protein (RON) Geninin siRNA Transfeksiyonu ile Susturulması. Mikrobiyol Bul 2019;53(1):81-95
�Z
Koksidiyan bir protozoon olan Toxoplasma gondii'nin sebep olduğu toksoplazmozis t�m d�nyada olduğu gibi T�rkiye'de de yaygın bir hastalıktır. İmm�n sistemin durumuna, yaşa veya yerleştiği b�lgeye g�re �ok farklı klinik belirtilere sebep olmaktadır. Parazitin �n ucunda apikal kompleks adı verilen organel bulunmaktadır. Bu organelin bir bileşeni olan "rhoptry neck protein (RON)"leri konak h�creye invazyon s�recinde "moving junction" formasyonunda ve parazitoforik vakuol�n oluşumunda kritik bir role sahiptir. �te yandan son yıllarda geliştirilen interferens RNA (iRNA) teknikleri ile yeni tedavi se�enekleri ortaya �ıkmıştır. Small iRNA (siRNA) ile paraziter hastalıkların tedavisi ve kontrol�n�n yapılabilmesi de m�mk�n g�r�lmektedir. Buradan hareketle toksoplazmozise karşı bu y�ntemin kullanılması d�ş�n�lm�şt�r. �alışma kapsamında, T.gondii'nin invazyon molek�l� olan RON1 geninin siRNA transfeksiyonu ile susturulması ama�lanmıştır. �alışmada, negatif kontrol grubunu oluşturan HeLa h�creleri, pozitif kontrol grubunu oluşturan T.gondii takizoitleri ile enfekte HeLa h�creleri ve deney grubunu oluşturan siRNA transfeksiyonu yapıldıktan sonra T.gondii takizoitleri ile enfekte edilen HeLa h�creleri kullanılmıştır. Her �alışma grubundan 30. saniye, 1. dakika, 5. dakika, 15. dakika, 30. dakika, 1. saat, 6. saat, 12. saat, 24. saat, 36. saat ve 48. saat s�relerinde �rnekler toplanmıştır. Deney i�i kontrol grupları ile deney grupları arasındaki parazit y�klerinin orantısal değişimini hesaplamak �zere, bu �rneklerden RNA izolasyonu yapılarak ger�ek zamanlı polimeraz zincir reaksiyonu (qRt-PCR) ve protein izolasyonu yapılarak Western Blot (WB) analizleri ger�ekleştirilmiştir. Kontrol grupları ile deney grupları arasındaki istatistiksel fark hesaplanmıştır. siRNA1 (p< 0.0055), siRNA2 (p< 0.0003), siRNA3 (p< 0.0001), siRNA4 (p< 0.0001), siRNA5 (p< 0.0001), siRNA6 (p< 0.0001), siRNA7 (p< 0.0182), siRNA9 (p< 0.0011) ve siRNA10 (p< 0.0004) ile yapılan deneylerde gen ifadesinde anlamlı fark olduğu fakat siRNA8 (p< 0.4049) ile yapılan deneyde istatistiksel olarak anlamlı bir fark olmadığı tespit edilmiştir. RON1 geninin susturulması sonucu total anti-T.gondii ve anti-T.gondii RON1 antikorları ile yapılan WB analizlerinde, deney grubuna ait h�cre lizatlarında parazit antijeninin �retilmemesine bağlı olarak invazyonun engellendiği tespit edilmiştir. Anti-toksoplasmozis aşıların ve terap�tik ajanların geliştirilmesi i�in TgRON1 gen ifadesinin bu y�ntem ile baskılanması umut verici bir basamak niteliğindedir.
Anahtar kelimeler: Toxoplasma gondii; siRNA; transfeksiyon; rhoptry neck protein.
ABSTRACT
Toxoplasma gondii is a coccidian protozoan that causes toxoplasmosis is a common disease in Turkey as well as all over the world. It causes various clinical symptoms depending on the immune system status, age, or location of the disease. There is an organelle called the apical complex at the anterior end of the parasite. Rhoptry Neck Proteins (RONs), a component of this organelle, play a critical role in the formation of "moving junction" and parasitophorous vacuoles during host cell invasion. On the other hand, interfering RNA (iRNA) treatment options developed in recent years have emerged. With small iRNAs (siRNA) it is also possible to treat and control parasitic diseases, too. From here it is thought to use this method against toxoplasmosis. Within the scope of the project, it is aimed to silence RON1 gene the target invasion molecules of T.gondii with siRNA transfection. In the study, the negative control group constitute HeLa cells, the positive control group constitute HeLa cells infected with T.gondii tachyzoites and the experimental group constitute HeLa cells infected with T.gondii tachyzoites after siRNA transfection were used. Samples were collected in each study group at 30 seconds, 1 minute, 5 minutes, 15 minutes, 30 minutes, 1 hour, 6 hours, 12 hours, 24 hours, 36 hours and 48 hours. In order to calculate the proportional change of the parasite loads between control groups and experimental groups, RNA and protein isolations were performed from these samples for real time polymerase chain reaction (qRt-PCR) and WB analyzes, respectively. The statistical difference between control groups and experimental groups was calculated. Significant difference in gene expression in experiments with siRNA1 (p< 0.0055), siRNA2 (p< 0.0003), siRNA3 (p<0.0001), siRNA4 (p< 0.0001), siRNA5 (p< 0.0001), siRNA6 (p< 0.0001), siRNA7 (p< 0.0182), siRNA9 (p< 0.0011) and siRNA10 (p< 0.0004) but there was no significant difference statistically in the experiment with siRNA8 (p< 0.4049) was detected. Thus, it has been detected that invasion was inhibited due to the lack of production of parasite antigen in the cell lysate belongs to experimental groups at WB assays with anti-T.gondii RON1 and total anti-T.gondii antibodies resulting in silencing of the RON1 gene. The suppression of the TgRON1 gene expression by this method is a promising step in the development of anti-toxoplasmosis vaccines and therapeutic agents.
Keywords: Toxoplasma gondii; siRNA; transfection; Rhoptry neck protein.
Geliş Tarihi (Received): 04.07.2018 - Kabul Ediliş Tarihi (Accepted): 27.11.2018
GİRİŞ
Toksoplazmozis, zorunlu h�cre i�i protozoon parazit Toxoplasma gondii'nin neden olduğu, d�nya genelinde yaygın g�r�len zoonotik karakterli bir hastalıktır. Bu hastalık insan v�cudundaki t�m hayati organları tutabilmektedir. Kanser hastalarında, kemik iliği ve soliter organ nakli yapılan ve imm�n sistemi baskılanmış kimselerde �ok ağır seyredebilmekte hatta �l�mle sonu�lanabilmektedir1. Parazitin invazyon molek�lleri bu patolojilere neden olabilmektedir. Konak h�creye invaze olan T.gondii takizoitlerinin etrafında halka benzeri yapıda daralmaya neden olan RON proteinleri 2005 yıllında tanımlanmıştır. Apikompleksan şubesinde korunmuş proteinler olan AMA1 ve RON'lar ortak �alışırlar. AMA1 proteinin ektodomaini, konak h�cre membranından i�eriye girişi sağlayan ve h�crenin kortikal iskeletinde bulunan diğer RON proteinlerine bağlandığı d�ş�n�len RON2'ye bağlanır2. Bununla beraber, konak h�creye tutunma ile ilişkili olan mikronem proteinleri, parazitin �n kısmından boşaldıktan sonra RON molek�lleri ile konak h�cre membranında oluşturdukları "moving junction" [hareketli bağlantı (MJ)] formasyonundan h�cre i�ine doğru itilerek parazitoforik vakuol� oluşturmaktadırlar3,4.
İmm�n sistemi sağlam veya baskılanmış kimselerde, gebelerde ve �ocuklarda ve ok�ler toksoplazmoziste uygulanan farklı tedavi yaklaşımları ve bu esnada kullanılan anti-Toxoplasma ila�larının olası yan etkileri tedaviyi g��leştirmektedir. Bu nedenle tedavisi kritik olan hasta gruplarına ortak uygulanabilen, yan etkisi daha az veya yan etkisi olmayan alternatif tedavi y�ntemlerinin geliştirilmesi ihtiyacı ortaya �ıkmaktadır5,6. Son yıllarda, kanser gibi farklı hastalıklarda interferens RNA'lar (iRNA) ile tedavi y�ntemleri geliştirilmeye �alışılmıştır. Bu �alışmalar, small iRNA'lar (siRNA) ile toksoplazmozisin tedavisinde alternatif bir y�ntem geliştirilebileceği fikrini doğurmuştur7,8. �alışmada, rhoptry neck protein (RON) molek�llerinin siRNA transfeksiyonu ile genetik olarak susturulması, dolayısıyla T.gondii'nin konak h�creye invazyonunun engellenmesi ve bu teknik ile parazitin ortaya �ıkardığı patolojilerin, engellenebileceği hipotezi geliştirilmiştir. Bu �alışmada, HeLa h�cre k�lt�r�nde in vitro k�ltivasyonu yapılmış olan T.gondii'nin h�crelere invazyonundan sorumlu RON1 genine ait RNA'lar i�in tasarlanan siRNA'lar ile RON1 geninin susturulması ama�lanmıştır.
GERE� ve Y�NTEM
Toxoplasma gondii Takizoitleri, HeLa H�cresi ve siRNA Dubleksleri
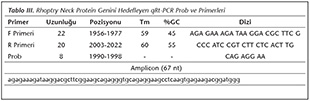
�alışmada kullanılan Hela h�creleri ATCC'den ve Toxoplasma gondii Ankara suşu takizoitleri; 1973 yılında Altıntaş tarafından izole edilen ve Ankara �niversitesi Tıp Fak�ltesi Parazitoloji laboratuvarında deney faresine s�rekli pasajlarla devam ettirilen k�lt�rden satın alınarak temin edildi. H�creler ve takizoitler kriyo t�plerde deney s�resince kullanılmak �zere -80C'de saklandı. RON1 genine ait mRNA'ları hedefleyen siRNA ve kontrol dizilerini belirlemek �zere BlOCK-iT RNAi Designer programı (https://rnaidesigner. invitrogen.com/rnaiexpress/) kullanıldı. ORF �zerindeki olası b�lgelerin başlangı�ları ve GC y�zdeleri belirlendi (Tablo I). Bu b�lgelere komplementer 10 farklı siRNA dubleksi tasarlandı ve deneyde kullanıldı (Tablo II).
H�cre K�lt�r� ve Enfeksiyon
H�cre k�lt�r�, %10 deaktive FBS, %1 penisilin-streptomisin ve %1 L-glutamine i�eren RPMI-1640 besiyeri ortamında ger�ekleştirildi. H�creler, 4 ml besiyeri bulunan 25 cm2 flasklarda 37C'lik, %5 CO2 i�eren et�vde ink�be edildi. D�zenli olarak h�crelerin flask y�zeyini kapladıkları alan invert mikroskop ile kontrol edildi. H�creler flask y�zeyinin %80'ini kapladığında tripsin ile muamele edilerek pasajlandı. Daha sonra sayımı yapılan h�creler, i�inde 10 ml besiyeri bulunan flasklara ekildi ve enfeksiyon dozajını belirlemek i�in kullanıldı. H�cre �oğaltımı sağlandıktan sonra pasajlanan h�creler, 24 kuyucuklu mikroplaklara ge�irilerek deneye devam edildi. Belirlenen h�cre yoğunluklarındaki flasklara sırasıyla 10:1, 5:1, 1:1 h�cre/parazit oranlarında takizoit ekimi yapıldı. Flasklardaki besiyerleri �� g�n boyunca değiştirilmedi. Her g�n parazit yoğunluğu invert mikroskopla g�zlemlenerek takizoit sayısı ve canlı h�cre sayısı trypan blue ile boyanarak sayıldı. Buna g�re; deneyi i�in optimal koşul olarak belirlenen 1:1 (2 x 105 h�cre: 2 x 105 takizoit) oranına g�re transfeksiyon sonrasında enfeksiyon deneyi yapıldı. Negatif kontrol� oluşturan HeLa h�creleri deney başlayana kadar devam ettirildi. Pozitif kontrol� oluşturan HeLa h�creleri ise deney grubu ile aynı anda, belirtilen oranda takizoitler ile enfekte edildi.
siRNA Duplekslerinin Hazırlanması ve Transfeksiyonu
Liyofilize edilmiş siRNA dubleksleri (METABION, Steinkirchen, Almanya) �retici firma �nerisine g�re hazırlanan 1X annealing buffer (1X: 60 mM KCl, 6 mM HEPES-pH 7.5, 0.2 mM MgCl2) eklenerek ��zd�r�ld�. 100 �M konsantrasyonunda hazırlanan stok ��zeltisinden 10 pmol konsantrasyonda ��zelti hazırlandı. Deney, her kuyuda 2 x 105 (%100) h�cre konsantrasyonu olacak şekilde Opti-MEM besiyeri i�eren 24 kuyucuklu mikroplaklarda ger�ekleştirildi. Seyreltilen siRNA ve lipofektamin RNAiMAX ayracı (Invitrogen, Callifornia, ABD) ile firma �nerisine g�re hazırlanan karışım 5 dakika boyunca oda sıcaklığında ink�be edildi ve siRNA-lipid (50 pmol) kompleksi HeLa h�crelerine eklendi. H�creler �� g�n boyunca 37C'de %5'lik CO2'li et�vde ink�be edildi. Deney, her siRNA dubleksi i�in dublike edilerek ger�ekleştirildi. siRNA transfeksiyonu yapılan HeLa h�creleri ���nc� g�n�n sonunda 200 �l PBS ile yıkandı ve h�creler enfekte edildi.
H�cre K�lt�rlerinden RNA Kantifikasyonu
Pozitif kontrol, negatif kontrol ve deney grubunu oluşturan h�cre k�lt�rlerinden farklı zaman aralıklarında toplanan �rnekler, RNA ve protein izolasyonu yapılana kadar 4C'de TRIzol (Sigma Aldrich, ABD) i�inde bekletildi.
H�cre k�lt�r�nden RNA izolasyonu, TRIzol ile kit protokol�ne g�re ger�ekleştirildi. İzole edilen RNA kalite ve miktarları �l��lerek intakt ve yeterli miktarda olduğu g�r�len �rnekler, cDNA sentezi yapılana kadar -80C'de saklandı. cDNA sentezi kit (Transcriptor High Fidelity cDNA Syntesis Kit-Roche, Indianapolis, ABD) kullanılarak �nerilen işleme g�re uygulandı. Elde edilen cDNA'lar ile qRt-PCR yapıldı. qRt-PCR'de kullanılan primer ve UPL prob dizileri ProbFinder Software �zerinden (https://lifescience.roche.com), DQ096562 GenBank numaralı T.gondii RON1 dizisine g�re tasarlandı (Tablo III). Deneyde kullanılan RON1 �zg�n primerlerin hassasiyeti, B1 geni primerleri ile qRt-PCR yapılarak karşılaştırmalı test edildi9.
10 �l prob reaksiyon karışımı (2x) (Roche, Mannheim, Almanya), 0.4 �l primer F ve R (20 �M) (Roche, Mannheim, Almanya), 0.4 �l prob (10 �M) (Roche, Mannheim, Almanya), 5 �l cDNA (60 ng), 3.8 �l dH2O kullanılarak toplam reaksiyon hacmi 20 �l olacak şekilde karışım hazırlandı. qRt-PCR (Roche Light Cycler 480II, Mannheim, Almanya) cihazında bir d�ng�; 95C'de 10 dakika ilk denat�rasyonun ardından 45 d�ng� 95�C'de 10 saniye denat�rasyon, 59�C'de 30 saniye primer bağlanması, 72�C'de 1 saniye uzama sonrası 40�C'de 30 sn son uzamadan oluşan qRt-PCR programı optimize edilerek ger�ekleştirildi. Daha sonra �rneklerin "quantification cycle (Cq)" değerleri hesaplandı ve r�latif kantifikasyon yapıldı.
H�cre K�lt�rlerinin Western Blot Analizleri
TRIzol protokol� uygulanan �rneklerden, RNA izolasyonun ardından protokole devam edilerek protein izolasyonu yapıldı. �rneklere ait proteinler, hazırlanan %8'lik jele (TGX Stain Free Fastcast Acrylamid kit, BioRad, ABD) y�klenerek 180 V'ta 1 saat SDS-PAGE yapıldı. Proteinler jelden 0.2 �m nitrosel�loz membrana (TransBlot Turbo Transfer Pack mini format, BioRad, ABD) transfer edildi. Membran %5 yağsız s�t tozu (500 ml PBS, 250 �l Tween 20, 25 g yağsız s�t tozu) ile bir gece oda sıcaklığında bloklandı. Bloklama sonrasında membran %0.02 Tween 20 i�eren PBS'de beş kez 5 dakika yıkandı. Yıkama sonrası membran 1/80.000 oranında peroksidaz işaretli spesifik anti-T.gondii RON1 ve anti-T.gondii antikoru ile 1 saat oda sıcaklığında 37�C'de ink�be edildi. Yıkama basamağı tekrar edilerek yıkanan membran ECL ile muamele edildi ve reaksiyon g�r�nt�lendi (ChemiDoc MP, BioRad, ABD).
İstatistiksel Analiz�
Bu �alışmada deney iki kere tekrarlandı ve her deneyde �rnekler dublike edilerek �alışıldı. Verilerin ortalaması alınarak One Sample T Test analizi ile p değerleri tespit edildi ve istatistiksel olarak p< 0.05 değerinde anlamlılıkları değerlendirildi. İstastistiksel analizler Minitab version 17.1.0 (Minitab, Kanada) istatistik programları kullanılarak yapıldı.
BULGULAR
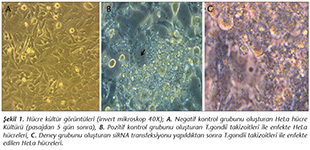
�alışmada negatif kontrol grubunu oluşturan HeLa h�creleri (Şekil 1A), pozitif kontrol grubunu oluşturan T.gondii takizoitleri ile enfekte HeLa h�creleri (Şekil 1B) ve deney grubunu oluşturan siRNA transfeksiyonu yapıldıktan sonra T.gondii takizoitleri ile enfekte edilen HeLa h�creleri kullanılmıştır (Şekil 1C). Negatif kontrol grubu, pozitif kontrol grubu ve deney grupları arasında morfolojik farklılıkların olup olmadığı invert mikroskop yardımıyla g�zlemlenmiştir. Buna g�re, deney grubundaki h�crelerin morfolojik olarak sağlam HeLa h�crelerinden oluşan negatif kontrolle benzer olduğu g�r�lm�şt�r. Pozitif kontrole ait h�crelerde ise deney s�resince hasar olduğu g�zlemlenmiştir.
HeLa h�creleri, 24 kuyucuklu h�cre k�lt�r plağında 2 x 105 h�cre sayısı elde edildikten sonra RON1 genine g�re tasarlanan siRNA'lar ile transfekte edilmiştir. Transfeksiyondan sonraki 3. g�nde 1:1 oranında T.gondii takizoitleriyle enfekte edilmiştir. Her �alışma grubundan 30. saniye, 1. dakika, 5. dakika, 15. dakika, 30. dakika, 1. saat, 6. saat, 12. saat, 24. saat, 36. saat ve 48. saat s�relerinde �rnekler toplanmıştır. RNA kantifikasyonu yapmak i�in 1.5 �g/�l olarak �l��lm�ş sulandırılmamış DNA ile 10'ar kat sulandırma yapılarak beş seri dil�syon hazırlanmış ve kopya/ml oranları belirlenmiştir. Seri dil�syonlardan elde edilen kopya sayılarına g�re her deney i�in standart eğriler oluşturulmuş ve deney gruplarının pozitiflik oranları belirlenmiştir. Belirlenen saatlerde alınan lizatlardan RNA ve protein izolasyonu yapılarak reverse transkripsiyon ger�ek zamanlı polimeraz zincir reaksiyonu (qRt-PCR) ve WB analizleri yapılmıştır.
qRt-PCR analizlerinde, konsantrasyonu bilinen standartlarla oluşturulan standart eğri �zerindeki Cq değerleri, konsantrasyonu bilinmeyen �rnek ile karşılaştırılarak �rneğe ait parazit y�k� hesaplamaktadır. B�ylece, pozitif ve negatif kontrol arasındaki farka dayalı sayısal hesaplamalar ile �rneklerin r�latif kantifikasyonu yapılmaktadır. Dolayısıyla, parazit y�k� bulunmayan negatif kontroller ile aynı olan 45 Cq ve �zerinde değer g�steren �rnekler negatif olarak tespit edilmiştir.
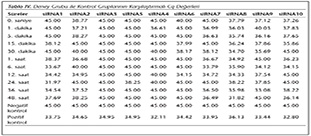
Deney i�i negatif ve pozitif kontrol grupları ile deney gruplarındaki parazit y�klerinin orantısal değişimi hesaplanmıştır (Tablo IV).
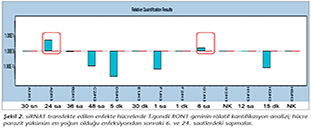
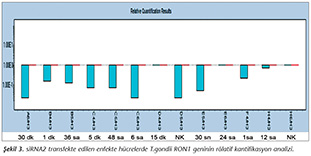
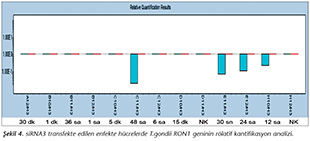
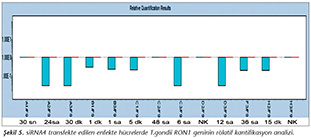
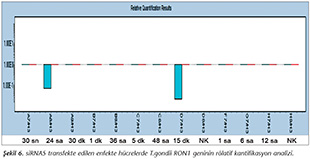
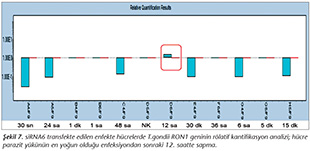
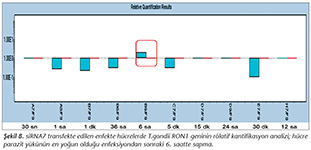
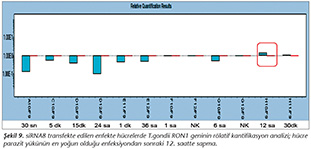
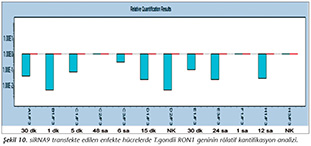
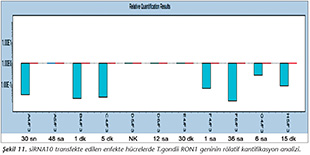
Pozitif kontroldeki T.gondii (0.015 �g) y�k�ne g�re deney grupları ve negatif kontrol gruplarının belirtilen saatlerde toplanan �rneklerindeki parazit y�kleri grafiksel olarak qRt-PCR ile hesaplanmış ve barlarla g�sterilmiştir (Şekil 2,3,4,5,6,7,8,9,10,11). 45 Cq ve �zeri değerlerde parazite ait DNA y�k� negatif olup "0" olarak kantifikasyon yapılmıştır. Bu nedenle grafiklerde negatif �rnekler barlarla g�sterilmemiştir.
qRt-PCR verilerine g�re; kontrol grupları ile deney grupları arasındaki ekspresyon d�zeylerinin farkı istatistiksel olarak değerlendirilmiştir. RON1 proteinini hedef alan deneyde kullanılan farklı siRNA'lardan siRNA1, siRNA6 ve siRNA7 ile yapılan gen susturma �alışmalarında toplanan veriler istatistiksel olarak anlamlı olmasına rağmen, deneyde h�cre parazit y�k�n�n en yoğun olduğu enfeksiyondan sonraki 6. ve 12. saatlerde sapmalar olmuştur. Ancak deneyin ilerleyen saatlerinde gen ifadesinde d�ş�ş olduğu ve deneyin sonlandırıldığı 48. saate kadar gen ifadesinin susturulduğu tespit edilmiştir. siRNA8 ile yapılan deneyde ise gen ifadesindeki azalma anlamlı bulunmamıştır (p< 0.4049). siRNA2, siRNA3, siRNA4, siRNA5, siRNA9, siRNA10 ile yapılan deneylerde belirlenmiş saatlerde alınan �rneklerde gen ifadesinin anlamlı oranda azaldığı tespit edilmiştir (p< 0.05) (Tablo V).
Pozitif ve negatif kontrol gruplarında ve deney gruplarında total T.gondii antijenlerinin ve T.gondii RON1 antijenlerinin hedeflendiği WB analizleri yapılmıştır. Deney gruplarında ve negatif kontrollerde total T.gondii antijenlerine ait bantlar g�r�lememiştir. Bu durum enfeksiyonu ger�ekleştiremeyen takizoitlerin h�cre k�lt�r� ortamından elimine olduğunu g�stermektedir. Anti-T.gondii RON1 antikoru ile yapılan WB analizlerinde ise qRt-PCR sonu�larını destekleyen veriler tespit edilmiştir. Parazit y�k�n�n artış g�sterdiği saatlerde RON1 proteninin k�lt�r ortamında �retildiği ve negatif kontrole bakılarak yalancı bir pozitifliğin veya kontaminasyonun olmadığını g�r�lm�şt�r (Şekil 12).
TARTIŞMA
D�nyada yaygın g�r�len toksoplazmozisin etkeni olan T.gondii, sıcakkanlı omurgalıları enfekte edebilen zorunlu h�cre i�i protozoon olarak, optimal b�y�me ve devamlılığı i�in kendi ihtiya�larını sağlayacak şekilde konak h�creyi yeniden d�zenleyecek gelişmiş mekanizmalar kullanmaktadır10. T.gondii membran proteomunun ileri sistematik analizlerinin, enfeksiyonunun fizyopatolojisinin altında yatan molek�ler ve biyolojik mekanizmayı aydınlatacağı ve yeni ila� hedeflerine imkan sunacağı ileri s�r�lm�şt�r11. T.gondii'nin, apikompleksan protozoonlar hari� diğer protozoonlarda bulunmayan h�cre membranı ile ilişkili tek veya �oklu transmembran segmentler i�eren RON1, RON2, RON3 gibi integral plazma membran proteinlerine sahip olduğu g�sterilmiştir11. RON molek�llerinin, parazitin h�creye invazyonu sırasında oluşan MJ formasyonunda kritik bir rol� olduğu bildirilmiştir10 ve konak h�cre membranında oluşturdukları MJ formasyonundan h�cre i�ine doğru itilerek parazitoforik vakuol�n oluşmasında g�revlidirler3,4. Hen�z literat�rde RON1 ve MJ potansiyeli hakkındaki bilgi bulunmaması �alışmanın �zg�n kısmını oluşturmaktadır. Dolayısıyla bu �alışmanın sonu�ları, T.gondii'nin konak h�creye invazyonunda �nemi artan molek�ller arasında RON1 proteininin de g�sterilmesi gerektiğine işaret etmektedir. Bu nedenle, bu �alışmada RON1 geni hedef alınarak siRNA transfeksiyonu ile genetik olarak susturulduğu ve bunun sonucu olarak anti-T.gondii antikorları ile yapılan WB analizlerinde deney grubuna ait h�cre lizatlarında parazit antijeninin �retilemediği g�r�lmektedir. Dolayısıyla, HeLa h�cre k�lt�r�nde in vitro k�ltivasyonu yapılmış olan T.gondii'nin konak h�creye invazyonunun engellendiği tespit edilmiştir. siRNA8 ile yapılan deneyde ise gen ifadesindeki azalma anlamlı bulunmamıştır (p< 0.4049). Bu durum siRNA8 molek�l�n�n, genin non-fonksiyonel bir b�lgesine komplementasyon sağlaması ile ilgili olabilir. T.gondii suş tiplerinin arasında b�y�me oranı ve enfeksiyon kabiliyeti gibi �nemli farklar olduğu bilinmektedir. Konakta gelişen kronik veya akut enfeksiyon, suş tipleri ile ilişkili olup Tip 1 suşu, Tip 2 ve Tip 3 suşlarına g�re daha virulenttir12,13. Bu sebeple, �alışmamızda T.gondii T1 suşu arasında yer alan RH Ankara suşu takizoitler enfeksiyon deneylerinde kullanılmıştır. Deney sonu�larında yaşanan sapmaların bir sebebinin de parazitin vir�lans kabiliyeti y�ksek suşunun kullanımına bağlı olabileceği d�ş�n�lm�şt�r. siRNA dubleksleri ile lipofektamin paketi bir lipozomdur; memeli h�creleri i�in toksik olmayan14, etkin internalizasyon sağlanabilen ve kolay uygulanabilen15 bir y�ntem olan lipofektamin ile transfeksiyon uygulaması ile gen susturma �alışmasında karşılaşılabilecek zorluklar minimize edilmiştir. Ancak, mikroarray analizleri siRNA tedavisinin hedef dışı gen susturma ile sonu�lanabildiğini g�stermiştir16. Hedef dışı susturma, istenmeyen h�cre transformasyonuna ve gen ifadesinde tehlikeli mutasyonlara neden olması nedeniyle istenilmez. Kullanılan siRNA'ların hedef dışı gen susturma yapıp yapmadığının mikroarray analizi ile değerlendirilmesi �nerilmektedir.
Parazit miRNA'ları ilk olarak parasitik nematodlarda tanımlanmış daha sonra bir�ok miRNA dizisi protozoonlarda, diğer helmintlerde ve arthropod parazitlerde karakterize edilmiştir. G�n�m�ze kadar yapılan �alışmalarda Trypanosoma brucei, Leishmania braziliensis, Entomoeba histolytica, Giardia intestinalis ve T.gondii gibi bazı protozoon parazitlerde endojen siRNA'ların eksojen kaynaklılarda olduğu gibi gen ekspresyonlarının down reg�lasyoundan sorumlu olduğu belirtilmiştir17. Literat�rde az sayıda yayımlanmış bazı protozoonlarla yapılan RNA interferans deneyleri bulunmaktadır. Parazitoforik vakuol�n non-f�zojenik doğasını s�rd�rebilmesi i�in gerekli olan EGFR sinyalizasyonunun bloklanmasının strateji olarak kullanıldığı bir �alışmada, siRNA'lar ile T.gondii MIC1-3 genleri susturulmuş ve parazitlerin CD154 aracılığıyla �ld�r�ld�ğ� g�zlemlenmiştir. B�ylece EGF-MIC1-3-6'nın parazit yaşamını d�zenlemek i�in konak h�crelerde sinyalizasyonda g�rev aldığı g�sterilmiştir18. Spesifik parazit fenotipleri ile konak gen ekspresyonunu ilişkilendirmek ve tanımlamak i�in �ok değişkenli mikroarray analizleri yapılarak insan h�cre b�l�nme otoantijen-1'in (CDA-1) tanımlandığı bir diğer �alışmada, bu genin siRNA ile susturulmasının parazit replikasyonunun inhibisyonuna sebep olduğu ve ardışık olarak bradizoit farklılaşmasının ind�klenmesine �nc�l�k ettiği g�sterilmiştir19. H�cre i�i zorunlu bir parazit olan T.gondii'nin gelişmesi i�in gerekli olan O2 metabolizmasını nasıl sağladığını anlamaya y�nelik yapılan �alışmada, T.gondii ile enfekte HeLa h�crelerinde hipoksi ile ind�klenen transkripsiyon fakt�r 1 (HIF-1) geni tarafından reg�le edilen Hexokinase2 (HK2) geni siRNA transfeksiyonu ile susturulmuştur. HK2'nin fonksiyonun anlaşılması ve HK2'nin HIF-1 bağımlı ekspresyonu, fizyolojik O2 seviyesinin sağlanmadığı h�cre i�i parazitlikte yeni bir mekanizma ile a�ıklanmıştır20. Bir �alışmada, T.gondii p�rin salvaj yolağının en �nemli enzimlerden biri olan Adenozin kinaza (AK) spesifik 3 faklı siRNA dizayn edilmiştir. Elektroporasyonu takip eden 24 saatte siRNA'lardan iki tanesi anlamlı oranda (p< 0.05) hedef mRNA seviyesini azaltmıştır. Kırk sekiz saat sonra dahi enzim seviyesi anlamlı oranda d�ş�k kalmaya devam etmiştir. Veriler g�stermiştir ki siRNA transfekte edilen h�creler, T.gondii'de gen ekspresyonunu reg�le etmek i�in etkin bir şekilde �alışmışlardır. T.gondii'de gen ekspresyonunu baskılamak i�in siRNA uygulaması anti-toksoplasmozis aşılarının ve terap�tik ajanların gelişimine doğru atılan �mit verici bir adım olarak değerlendirilmiştir21.
Sonu� olarak, bu �alışma ile in vitro k�ltivasyonu yapılmış olan T.gondii'nin RON1 spesifik siRNA transfeksiyonu ile genetik olarak susturulmasıyla konak h�creye invazyonunun engellendiği, RON1 geninin gen susturmada iyi bir hedef olduğu belirlenmiştir. T.gondii i�in RON1 genine spesifik tasarlanan 10 adet farklı siRNA dubleksi, siRNA8 hari� hedef mRNA ile komplementasyon yaparak mRNA'nın degrede olmasını sağladığı, her �alışma grubunda, enfeksiyondan sonraki 30. saniye, 1. dakika, 5. dakika, 15. Dakika, 30. dakika, 1. saat, 6. saat, 12. saat, 24. saat, 36. saat ve 48. saat s�relerinde gen susturmanın stabil kaldığı g�sterilmiştir. Bu durum, transmembran proteinini olan RON1 molek�l�n�n tamamının veya ekstrasel�ler bir domaininin h�cre invazyonu aşamasında parazit i�in �nemli fizyopatolojik mekanizmalarda g�revli olabileceğini ve �nemli bir terap�tik hedef olduğunu g�stermektedir. Ayrıca, siRNA stratejisinin toksoplazmozis in tedavisinde alternatif bir y�ntem olarak geliştirilebileceği fikrini doğurmuştur. Elde edilen sonu�lar kapsamında, ileri �alışmalarda ayrı ayrı deneyi yapılan bu siRNA'ların bir kokteyli ile gen susturma deneyinin tekrar yapılarak sinerjik etkisi bakımından incelebilir. siRNA partik�llerinin preparat haline getirilmesi, farklı suşların ve yabanıl tiplerin bu deneyin enfeksiyon aşamasında kullanılması, T.gondii'nin konak h�creye invazyonunun engellemesi i�in in vivo deneyler ve saha �alışması yapılması bu �alışmanın ileri basamakları olarak tasarlanabilir.
Teşekk�r
Bu �alışmaya yaptığı katkılardan dolayı Prof. Dr. İzzet Şahin'e teşekk�r ederiz.
�IKAR �ATIŞMASI
Yazarlar bu makale ile ilgili herhangi bir �ıkar �atışması bildirmemişlerdir.
KAYNAKLAR
- Kaye A. Toksoplasmozis: diagnosis, treatment, and prevention in congenitally exposed infants. J Ped Health Care 2011;25:355-64.
- Bargieri D, Lagal V, Andenmatten N, Tardieux I, Meissner M, Menard R, et al. Host cell invasion by apicomplexan parasites: the junction conundrum. PLoS Pathog 2014;10:1004273.
- Beck JR, Chen AL, Kim EW, Bradley PJ. RON5 is critical for organization and function of the Toxoplasma moving junction complex. PLoS Pathog 2014;10:1004025.
- Poukchanski A, Fritz HM, Tonkin ML, Treeck M, Boulanger MJ, Boothroyd JC. Toxoplasma gondii sporozoites invade host cells using two novel paralogues of RON2 and AMA1. PloS One 2013;8:70637.
- Zamboni DS, Lima-Junior DS. Inflammasomes in host response to protozoan parasites. Immunol Rev 2015;265:156-71.
- Rivera Fernandez N, Mondragon Castelan M, Gonzalez Pozos S, Ramirez Flores CJ, Mondragon Gonzalez R, G�mez de Leon CT, et al. A new type of quinoxalinone derivatives affects viability, invasion, and intracellular growth of Toxoplasma gondii tachyzoites in vitro. Parasitol Res 2016;115:2081-96.
- Zheng Y. Phylogenetic analysis of the Argonaute protein family in platyhelminths. Mol Phylogenet Evol 2013;66:1050-4.
- Manzano-Roman R, Siles-Lucas M. MicroRNAs in parasitic diseases: potential for diagnosis and targeting. Mol Biochemic Parasitol 2012;186:81-6.
- Costa JM, Cabaret O, Moukoury S, Bretagne S. Genotyping of the protozoan pathogen Toxoplasma gondii using high-resolution melting analysis of the repeated B1 gene. J Microbiol Methods 2011;86:357-63.
- Hakimi MA, Cannella D. Apicomplexan parasites and subversion of the host cell microRNA pathway. Trends Parasitol 2011;27:481-6.
- Che FY, Madrid-Aliste C, Burd B, Zhang H, Nieves E, Kim K, et al. Comprehensive proteomic analysis of membrane proteins in Toxoplasma gondii. Mol Cell Proteomics 2011;10:M110.000745.
- Moser LA, Pollard AM, Knoll LJ. A genome-wide siRNA screen to identify host factors necessary for growth of the parasite Toxoplasma gondii. PloS One 2013;8:68129.
- Saeij JP, Boyle JP, Boothroyd JC. Differences among the three major strains of Toxoplasma gondii and their specific interactions with the infected host. Trends Parasitol 2005;21:476-81.
- Gavrilov K, Saltzman WM. Therapeutic siRNA: principles, challenges, and strategies. Yale J Biol Med 2012;85:187-200.
- Gao Y, Liu XL, Li XR. Research progress on siRNA delivery with nonviral carriers. Int J Nanomedicine 2011;6:1017-25.
- Jackson AL, Bartz SR, Schelter J, Kobayashi SV, Burchard J, Mao M, et al. Expression profiling reveals off-target gene regulation by RNAi. Nat Biotechnol 2003;21:635-7.
- Kolev NG, Tschudi C, Ullu E. RNA interference in protozoan parasites: achievements and challenges. Eukaryot Cell 2011;10:1156-63.
- Muniz-Feliciano L, Van Grol J, Portillo JA, Liew L, Liu B, Carlin CR, et al. Toxoplasma gondii-induced activation of EGFR prevents autophagy protein-mediated killing of the parasite. PLoS Pathog 2013;9:1003809.
- Radke JR, Donald RG, Eibs A, Jerome ME, Behnke MS, Liberator P, et al. Changes in the expression of human cell division autoantigen-1 influence Toxoplasma gondii growth and development. PLoS Pathog 2006;2:105.
- Menendez MT, Teygong C, Wade K, Florimond C, Blader IJ. siRNA screening identifies the host hexokinase 2 (hk2) gene as an important hypoxia-inducible transcription factor 1 (hıf-1) target gene in Toxoplasma gondii-infected cells. MBio 2015;6:00462.
- Yu L, Gao YF, Qiao ZP, Li CL, Li X, Shen JL. Toxoplasma gondii: siRNA can mediate the suppression of adenosine kinase expression. Exp Parasitol 2008;118:96-102.
İletişim (Correspondence):
Dr. Merve Y�r�k,
Erciyes �niversitesi Tıp Fak�ltesi,
Tıbbi Parazitoloji Anabilim Dalı,
Melikgazi,� 38039, Kayseri, T�rkiye.
Tel (Phone): +90 352 207 6666,
E-posta (E-mail): yuruk_merve@hotmail.com