MOTAKK HBV DNA ve HCV RNA Dış Kalite Kontrol Ulusal Programı
2015-2016 Sonu�larının Değerlendirilmesi
Evaluation of 2015-2016 MOTAKK HBV DNA and
HCV RNA External Quality Assessment National Program Results
Ersin KARATAYLI1, Ege SOYDEMİR2, Zeynep B�şra AKSOY2, Mehtap KIZILPINAR1, Aylin ALTAY KO�AK1,3, Senem Ceren KARATAYLI1, Esra YURDCU1, Umut YILDIRIM4, Haluk G�RİZ5, G�lendam BOZDAYI6, Cihan YURDAYDIN7, Osman İLHAN8, Yasin YILDIRIM9, MOTAKK HBV ve HCV �alışma Grubu*, A. Mithat BOZDAYI1
1 Ankara �niversitesi Hepatoloji Enstit�s�, Ankara.
1 Ankara University Hepatology Institute, Ankara, Turkey.
2 Ankara �niversitesi Biyoteknoloji Enstit�s�, Ankara.
2 Ankara University Biotechnology Institute, Ankara, Turkey.
3 Başkent �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Ankara.
3 Baskent University Faculty of Medicine, Department of Medical Microbiology, Ankara, Turkey.
4 Tomurcuk Teknoloji, Cyberpark, Bilkent, Ankara.
4 Tomurcuk Technology, Cyberpark, Bilkent, Ankara, Turkey.
5 Ankara �niversitesi Tıp Fak�ltesi, Cebeci Merkez Laboratuvarı, Ankara.
5 Ankara University Faculty of Medicine, Cebeci Central Laboratory, Ankara, Turkey.
6 Gazi �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Ankara.
6 Gazi University Faculty of Medicine, Department of Medical Microbiology, Ankara, Turkey.
7 Ankara �niversitesi Tıp Fak�ltesi, Gastroenteroloji Bilim Dalı, Ankara.
7 Ankara University Faculty of Medicine, Division of Gastroenterology, Ankara, Turkey.
8 Ankara �niversitesi Tıp Fak�ltesi, Hematoloji Bilim Dalı, Ankara.
8 Ankara University Faculty of Medicine, Division of Hematology, Ankara, Turkey.
9 Ankara �niversitesi Tıp Fak�ltesi, Hematoloji Bilim Dalı, Terap�tik Aferez Merkezi, Ankara.
9 Ankara University Faculty of Medicine, Division of Hematology, Therapeutic Apheresis Center, Ankara, Turkey.
* MOTAKK HBV ve HCV �alışma Grubu (* İsme g�re alfabetik olarak sıralanmıştır.) A�elya Yal�ıntaş Oğuz, Ahmet Barış, Alpaslan Alp, Alper Aks�zek, Arzu Sayıner, Aydan Karag�l, Aylin Ordu, Ayşe İstanbullu, Barış Otlu, Buket Arıdoğan, Burak Aksu, C. Kurtuluş Buruk, Ceren Karahan, �akır G�ney, Devrim Toks�z, Dilara Yıldırım, Dilek �olak, Duygu Eren Dağlar, Duygu Fındık, Elif Kaş, Emel �alışkan, Fadile Yıldız Zeyrek, Fatma Arslan, Feyza Demir, Fikriye Milletli, Filiz Kibar, Furkan �zdin�er, G�lnur D�ndar, Hande Arslan, Harun Ağca, Hikmet Eda Alışkan, H�seyin G�d�c�oğlu, Işıl Fidan, Işın Akyar, İlhan Afşar, İlknur Kaleli, İsmail D�nmez, Kemalettin Yanık, Kenan Midilli, Kıvan� �ubuk�u, Mehmet �zdemir, Melek Acar, Meltem Yalınay, Mert Ahmet Kuşkucu, Mustafa Zahir Bakıcı, Neriman Aydın, Neziha Yılmaz, Nihan �eken, Nihan Ziyade, Nisel Yılmaz, Osman Birol �zg�m�ş, �zlem Gitmişoğlu, Recep Demirgan, Recep Keşli, Rıdvan G��kan, R��han Sert�z, Sadık Akg�n, Sebahat Aksaray, Seda Tezcan, Sedat Kaygusuz, Selma G�kahmetoğlu, Sevim Meşe, Seyit Ahmet Bayık, Sinem Ak�alı, Şaban G�rcan, Tekin Karslıgil, Tercan Us, Tuncer �zekinci, T�lin Pilgir, Uğur Aslan, Uğur Din�, Umut Safiye Şay Coşkun, Yeliz �etinkol, Yusuf Keskin, Zeynep Ayaydın, Z�lal Aş�ı Toraman.
* Bu �alışma T�bitak ‘213S130' No'lu 1001 Projesi ile desteklenmiştir.
* Bu �alışma, 4. Ulusal Klinik Mikrobiyoloji Kongresi (8-12 Kasım 2017, Antalya)'nde bildiri olarak sunulmuştur.
�Z
�lkemizde, molek�ler mikrobiyoloji tanı laboratuvarlarında yapılan HBV DNA ve HCV RNA viral y�k saptama testlerinin ulusal bir dış kalite kontrol programında değerlendirilmesi amacıyla MOTAKK (Molek�ler Tanıda Kalite Kontrol) Ulusal Programı başlatılmıştır. ISO 17043:2010 (Uygunluk değerlendirmesi-Yeterlilik deneyi i�in genel şartlar) standartlarına uyularak hazırlanan bu program, �lkemizde yapılan molek�ler tanı testlerinin, daha standart ve doğru yapılmasına katkıda bulunarak, yurt dışından sağlanan dış kalite kontrol (DKK) programlarının yerini almayı ama�lamaktadır. Bu �alışmada, MOTAKK DKK Programı kapsamındaki HBV DNA ve HCV RNA viral y�k 2015 ve 2016 sonu�larının değerlendirilmesi ama�lanmıştır. Yapılan �ağrılar MOTAKK web sayfası (www.motakk.org) �zerinden ilan edilmiştir. Web sayfası �zerinden kayıt olan katılımcı laboratuvarlara, 2015 ve 2016 yıllarında birer kalite kontrol paneli g�nderilmiştir. �evrimlerde kullanılan paneller, HBV, HCV, HIV, HAV, Parvovir�s B19 ve CMV serolojik belirte�leri negatif olan plazma ile dil�syon yapılan değişik viral y�klere sahip �rnekler ile hazırlanmış, negatif �rneklerle beraber soğuk zincirde katılımcı laboratuvarlara ulaştırılmıştır. Laboratuvarlar ilgili testleri 2-3 hafta i�erisinde sonu�landırarak, MOTAKK web sayfasına sonu�larını girmiştir. MOTAKK tarafından geliştirilen bir yazılım ile katılımcı laboratuvarların sonu�ları ISO 13528'e uygun olarak analiz edilerek sonu� raporları oluşturulmuş ve web sayfasına y�klenerek katılımcılara iletilmiştir. Katılımcılar, �alışma sonucunu diğer laboratuvar sonu�ları ile karşılaştırmalı olarak� değerlendirme imkanına sahip olmuş ve referans değerlere ve ortalama sonu�la ilgili farklılıkları g�rerek kullandıkları testleri tekrar değerlendirmiştir. HBV DNA ve HCV RNA DKK programına, 2015-2016 yıllarında 70-73 laboratuvar katılmıştır. Katılımcılar, program ara�larına y�ksek uyum g�stererek kayıt, sonu� girme ve sonu� raporlarının alınmasını aksaksız olarak ger�ekleştirmişlerdir. HBV panelinde; 2015 yılında katılımcı laboratuvarların %72.6-89.1'inin, 2016 yılında ise %84.7-90.3'�n�n 1 standart sapma (SS) aralığında yer aldığı g�r�lm�şt�r. HCV panelinde ise; katılımcıların %70.8-89.1'i 1 SS'de, ikinci �ağrının yapıldığı 2016 yılında ise, %84.7-90.3'�n�n 1 SS'nin i�erisinde yer aldığı g�r�lm�şt�r. Bu proje ile T�rkiye'de HBV DNA ve HCV RNA ile ilgili ilk kez ulusal bir DKK programı hazırlanmış ve başarıyla uygulanmıştır. MOTAKK, DKK programı sonu� raporlarında sağlanan bilgiler, yurt dışından sağlanan kalite kontrol programı sonu� raporlarının sağladığı t�m bilgileri karşılamakta; ek olarak kullanılan teknolojilerin ve ticari �r�nlerin sağlıklı karşılaştırmalarına olanak sağlamaktadır.
Anahtar s�zc�kler: HBV DNA; HCV RNA; dış kalite kontrol; viral y�k.
ABSTRACT
MOTAKK, as a national external quality control program has been launched to evaluate the molecular detection of viral infections including HBV DNA and HCV RNA in molecular microbiology diagnostic laboratories in Turkey. This program is prepared in compliance with ISO 17043:2010 (Conformity assessment general requirements for proficiency testing) standards, and aims to take the place of external quality control programs from abroad, contributing to standardization and accuracy of molecular diagnostic tests in our country.� The aim of this study was to evaluate� 2015 and 2016 results of the MOTAKK External Quality Control Program for HBV DNA and HCV RNA viral load . The calls were announced on the web page of MOTAKK (www.motakk.org). The quality control samples were sent to participating laboratories in 2015 and 2016. Main stocks were prepared from patients with chronic hepatitis B and C who had viral load detection with reference methods according to WHO reference materials for viral load studies to improve quality control sera. From these main stocks, samples with different viral loads were prepared from dilutions of plasma with HBV, HCV, HAV, HIV, Parvovirus B19 and CMV negative serologic markers. Quality control samples were sent to the participating laboratories along with the negative samples in the cold chain. The laboratories accomplished the related tests within 2-3 weeks and entered their results on the MOTAKK web page. These results were analysed according to ISO 13528 (Statistical methods for use in proficiency testing by interlaboratory comparison) and scoring reports were created by a software developed by MOTAKK and sent to participating labs. Each laboratory evaluated their own results in comparison with the other laboratory results, reassessed the tests via observing the distance from the mean result and the reference values. The number of laboratories participating in the HBV DNA and HCV RNA external quality control program was 70-73 in 2015-2016. Participants were able to comply with the program tools, registering, entering results and receiving the results reports without problem. In HBV panel, 72.6-89.1% and 84.7-90.3% of the participant laboratories were in 1 standard deviation (SD) in 2015-2016, respectively. In HCV panel, 70.8-89.1% and 84.7-90.3% of the participant laboratories were in 1 SD in 2015-2016, respectively. A national external quality control program for HBV DNA and HCV RNA in Turkey has been prepared for the first time with this project and implemented successfully. All the data provided in the MOTAKK external quality control program final report, compensate all the data provided by the quality control program final reports from abroad; additionally, the report allows comparison of used technologies and commercial products.
Keywords: HBV DNA; HCV RNA; external quality control; viral load.
Geliş Tarihi (Received): 28.03.2018 - Kabul Ediliş Tarihi (Accepted): 20.07.2018
GİRİŞ
Hepatit B vir�s� (HBV) enfeksiyonu, kronik karaciğer hastalığının başlıca nedenlerinden biridir. D�nya genelinde yaklaşık 2 milyar insanın HBV ile enfekte olduğu tahmin edilmektedir1,2. D�nya Sağlık �rg�t� (DS�) sınıflamasına g�re; T�rkiye, hepatit B i�in orta endemik olan (%2-8) �lkelerden biridir. 2011 yılında yapılan meta-analizden elde edilen T�rkiye'ye �zg� prevalans, t�m b�lgelerde ve yaş gruplarında %4.5 olarak belirlenmiştir3. Hepatit C vir�s� ise, kronik hepatit, siroz ve hepatosel�ler karsinomayı i�eren kronik karaciğer hastalıklarının başlıca nedenidir ve d�nya genelinde 170 milyon kronik hepatitli hasta bulunmaktadır. �lkemizdeki HCV prevalansı ise, ortalama %1 olarak bildirilmektedir1,4.
N�kleik asit amplifikasyon teknikleri (NAT)'nin 1990'ların başında kullanılmaya başlanmasından bu yana, i� ve dış kalite kontrol programları, klinik tanı i�in bu y�ntemlerin uygulanmasında giderek daha �nemli bir rol oynamaktadır. Klinik laboratuvarlar, ISO standartları gereği (ISO 15189), ruhsatlandırma kuruluşlarının zorunlu tutması gerek�esiyle ya da bilimsel gerek�elerle dış kalite kontrol (DKK) programlarına katılmaktadır. Laboratuvarlar, g�ncel rehberlere g�re DKK programı sağlayıcıları tarafından organize edilmiş bir DKK programına d�zenli bir katılım ile analitik y�ntemlerinin kalitesini doğrulamak ve kalite kontrol kriterlerinin sağlanamadığı durumlarda d�zeltici/�nleyici faaliyetlerde bulunmak zorundadır5-8. Klinik laboratuvarlarda HBV ve HCV viral y�k değerlendirmesi duyarlılık, �zg�ll�k, testin hızı ve analitik otomasyona bağlı olarak; �oğunlukla, n�kleik asit �oğaltma tekniklerine dayanmaktadır. Polimeraz zincir reaksiyonu (PCR) ve ger�ek zamanlı PCR (Rt-PCR) �ok duyarlı bir kantitasyon sağlamaktadır1. Viral genom saptanması, kantitasyonu ve tiplendirmesi i�in de molek�ler testlerin kullanımı �nemli bulunmaktadır. Ancak, �rnek toplanması veya işlenmesinde kontaminasyonun yanı sıra yanlış işlemden dolayı yalancı pozitif ve/veya negatif sonu�lar �ıkabilmektedir. N�kleik asit testlerinin doğruluğunu ve g�venilirliğini sağlamak i�in, nitelikli bir test, sertifikalı bir test sistemi, etkin kalite y�netimi ve dış kalite değerlendirmesi yapılması gibi �eşitli koşullar g�z �n�ne alınmalıdır4,9.
İlk Uluslararası DS� HBV DNA NAT Standardı (97/746), 2001 yılında uluslararası işbirliğine dayalı bir �alışma sonucunda kabul edilmiş ve HBV DNA saptanmasında "Internasyonel �nite (IU)" birimi ilk kez kullanıma girmiştir10. HCV NAT i�in DS� Uluslararası Standardı ise 1997 yılında HCV RNA prosed�rlerinin kalite kontrol�nde �ok �nemli bir basamak olarak yerini almıştır. Bu standart materyallerin yardımıyla, �alışma reaktiflerinin kalibrasyonu ve laboratuvarlardan gelen verilerin uyumu m�mk�n ve uygulanabilir hale gelmiştir9,11. DS� Uluslararası Standartlarına g�re� geliştirilen �eşitli HBV DNA kantitatif testleri bulunmaktadır. Serum HBV DNA seviyeleri; mevcut t�m testlerde, farklı y�ntemler ve farklı denemelerdeki testler arasında karşılaştırma yapılabilmesi ve kullanılan y�nteme uygun kılavuzların oluşturulabilmesi a�ısından evrensel olarak IU/ml cinsinden ifade edilmektedir12.
Rutin molek�ler tanı laboratuvarları, iyi laboratuvar uygulamaları �er�evesindeki test performans parametreleri (�zg�ll�k, saptama sınırı, kantitasyon sınırı, doğruluk, kesinlik, g�venilirlik, tekrarlanabilirlik, doğrusallık, dinamik aralık, sağlamlık) sayesinde kabul edilebilir standartta tanısal sonu�lar vermektedir. Bu aşamada, DKK uygulaması, rutin PCR tanı laboratuvarlarında uluslararası akreditasyon a�ısından kritik bir �neme sahiptir13.
Kalite kontrol programlarının �� bileşeni bulunmaktadır; kullanılan materyaller (genellikle ‘kontrol' olarak adlandırılır), kullanılan y�ntemler (klinik �rnekler ve hangi sıklıkta �alışıldığı) ve kalite kontrol kuralları (�alışılan kontrollerin sonu�larının nasıl kabul edildiğinin yorumlanması, sorun ��zme veya testin tekrarı). Kontroller, beklenen sonu�larla g�zlenen sonu�ların kıyaslanması suretiyle, zamana bağlı olarak kesinlik ve tekrarlanabilirliği değerlendirmek i�in kullanılan analitin bilinen konsantrasyonlarını i�eren stabil materyallerden oluşmaktadır. İdeal kontroller, test edilecek olan bilinmeyen �rneklerle aynı numune tipinde olmalı ve aynı formdaki analiti i�ermelidir14.
Molek�ler mikrobiyoloji alanında T�rkiye'de ulusal �l�ekli DKK programları hen�z bulunmamaktadır13. T�bitak 213S130 no'lu proje kapsamında, �lkemizdeki molek�ler mikrobiyoloji tanı laboratuvarlarında �alışılan HBV DNA ve HCV RNA viral y�k saptama testlerinin ulusal bir DKK programınca değerlendirilmesi ama�lanmıştır. ISO 1704315 standartlarına uyularak hazırlanan MOTAKK (Molek�ler Tanıda Kalite Kontrol) Ulusal Programı, �lkemizde yapılan molek�ler tanı testlerinin, daha standart ve doğru yapılmasına katkıda bulunarak, yurt dışından temin edilen kalite kontrol serumlarının yerini almayı ama�lamaktadır. Bu �alışmada, MOTAKK HBV DNA ve HCV RNA viral y�k Dış Kalite Kontrol Programı kapsamındaki 2015-2016 sonu�larının değerlendirilmesi ama�lanmıştır.
GERE� ve Y�NTEM
Bu �alışma, Ankara �niversitesi Etik Kurul Onayı (Tarih: 9 Aralık 2013 ve Karar No: 18-688-13) ile ger�ekleşti.
Kalite Kontrol �rneklerinin Hazırlanması
Kalite kontrol �rneklerinin geliştirilmesi amacıyla, viral y�k �alışmaları i�in DS� referans materyallerine g�re referans y�ntemler ile viral y�k saptaması yapılarak kronik B (genotip D) ve C (genotip 1b) hepatitli hastalardan ana stoklar hazırlandı. Bu ana stoklardan serolojik olan hepatit belirte�leri ve viral y�kleri negatif (HBV, HCV, HIV1, HAV, Parvovir�s B19, CMV negatif) plazma ile dil�syon yapılan, değişik viral y�klere sahip �rnekler hazırlandı ve 4 pozitif, 1 negatif �rnekten oluşan paneller oluşturuldu. Hazırlanan �rnekler vidalı kapaklı t�plere 1.2 ml olarak dağıtıldı ve HBV, HCV paneli ile her bir �rnek i�in; g�nderim yapılan yıl, �ağrı numarası ve t�p numarasını belirten bir kod numarası (�rn. HBV-K1601.01, HCV-K1601.01) verildi. �rnekler kod numaralarına g�re etiketlendi ve g�nderim zamanına kadar -80oC'de saklandı. Hazırlanan �rneklerin homojenite ve kararlılık testleri COBAS� AmpliPrep/COBAS� TaqMan� HBV/HCV Test, Roche, ABD kullanılarak ger�ekleştirildi.
Kalite Kontrol Programının D�zenlenmesi
Katılımcı ve program ilişkisi bu proje kapsamında geliştirilmiş olan web sayfası ve �ağrı d�zenleme ve değerlendirme programınca dijital ortamda ger�ekleştirildi. Yapılan �ağrılar MOTAKK web sayfası (http://www.motakk.org/) �zerinden ilan edildi. �lkemizdeki HBV DNA ve HCV RNA �alışılan t�m �niversite ve kamu hastaneleri, �zel laboratuvarlar ve halk sağlığı merkezleri katılımcı olmak �zere davet edildi. Katılımcı laboratuvarlara 2015 ve 2016 yıllarında kullanım kılavuzları ile birlikte birer panel g�nderildi. G�nderilen paneller, soğuk zincirde katılımcı laboratuvarlara ulaştırıldı, laboratuvarlar ilgili testleri 2-3 hafta i�erisinde sonu�landırarak, MOTAKK web sayfasına sonu�ların girişini ger�ekleştirdi.
Sonu�ların Değerlendirilmesi
Panelleri oluşturan plazma �rnekleri i�in katılımcı laboratuvarların girmiş oldukları sonu�lara g�re ortalama, standart sapma ve dağılımlar hesaplandı. Değerlendirme �ncesi girilen sonu�ların dağılımı değerlendirildi ve normal dağılım dışındaki değerler� ortalama dışı bırakıldı. Kantitatif sonu�lar, logaritmik değerlerine �evrildi. T�m katılımcıların her iki yıla ait skorlama değerlendirmesi yapıldı. Ortalamalar ve standart sapmalar (SS), hem t�m katılımcılar i�in hem de aynı teknolojiyi kullanan katılımcıların kendi aralarında yapıldı. Skorlamalar, aynı teknolojiyi kullanan grupların kendi arasındaki değerlendirmelere g�re yapıldı. Aynı teknolojiyi kullanan katılımcı sayısı 7‘den az ise skorlama t�m teknoloji kullanıcı sonu�larına g�re yapıldı. Buna g�re; 1 SS'de yer alanlar ‘0' ceza puanı, 2 SS'de yer alanlar ‘1' ceza puanı, 3 SS'de yer alanlar ‘2' ceza puanı ve ‘3 SS'nin dışında yer alanlar ‘3' ceza puanı olacak şekilde değerlendirildi. T�m sonu�lar, geliştirilmekte olan yazılım programı ile analiz edildi ve sonu� raporları web sayfası ve e-posta yoluyla katılımcılara ulaştırıldı. �alışmalar sonucunda her bir laboratuvar �alışma sonucunu diğer laboratuvar sonu�larıyla karşılaştırmalı olarak g�rebildi ve kendi sonu�larının referans değerlere ve ortalama sonuca olan uzaklığını saptayarak kullandıkları testleri tekrar değerlendirdi.
BULGULAR
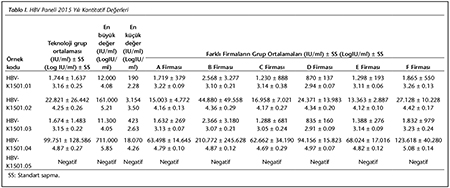
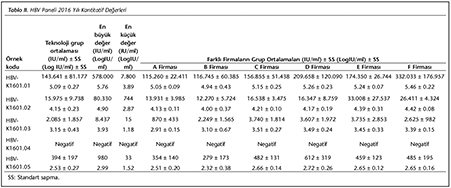
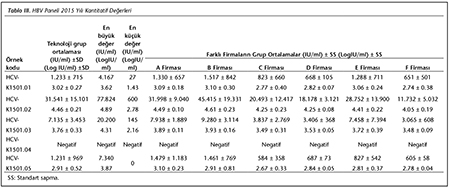
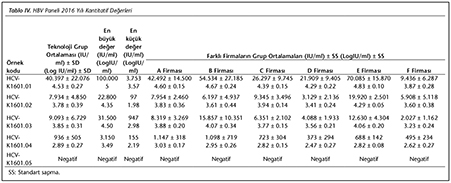
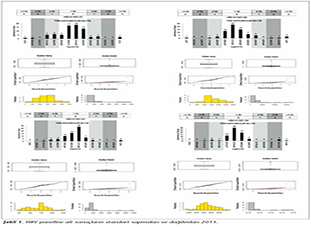
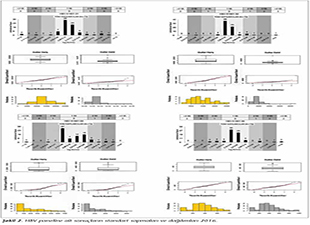
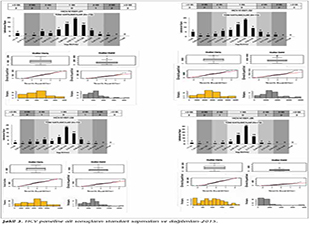
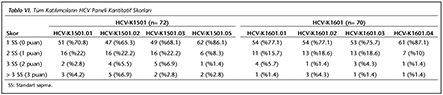
Katılımcı laboratuvar sayısı HBV paneli i�in 2015 yılında 73, 2016 yılında 72; HCV paneli i�in 2015 yılında 72, 2016 yılında 70 olarak ger�ekleşmiştir. Katılımcılar, program ara�larına y�ksek uyum g�stererek kayıt, sonu� girme ve sonu� raporlarının alınmasını aksaksız olarak ger�ekleştirmiştir. 2015 ve 2016 yıllarında panelleri oluşturan plazma �rnekleri i�in katılımcı laboratuvarların girmiş oldukları sonu�lara g�re teknoloji grup ortalamaları, katılımcıların saptadığı en b�y�k ve en k���k değerler, standart sapma ve dağılımları Tablo I, II, III ve IV ile Şekil 1, 2, 3 ve 4'te g�sterilmiştir.
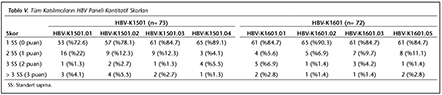
�alışmamızda ilk �ağrının yapıldığı 2015 yılında, HBV paneline 73 laboratuvar katılmış ve katılımcı laboratuvarların %72.6-89.1'i 1 SS'nin i�erisinde yer alarak ‘0' ceza puanı; %1.3-5.5'i ise 3 SS'nin dışında kalarak ‘3' ceza puanı almıştır. İkinci �ağrının yapıldığı 2016 yılında ise, 72 laboratuvar HBV paneline katılmış ve ortalamaya daha yakın sonu�larla %84.7-90.3'� 1 SS'nin i�erisinde yer almış; %1.4-2.8'i ise 3 SS'nin dışında kalmıştır. HCV paneline ise 2015'teki �ağrıda 72 laboratuvar katılmış ve katılımcı laboratuvarların %70.8-89.1'i 1 SS'nin i�erisinde yer alarak ‘0' ceza puanı; %1.3-5.5'i ise 3 SS'nin dışında kalarak ‘3' ceza puanı almıştır. İkinci �ağrının yapıldığı 2016 yılında ise, 70 laboratuvar HCV paneline katılmış ve %84.7-90.3'� 1 SS'nin i�erisinde yer almış; %1.4-2.8'i ise 3 SS'nin dışında kalmıştır. Her iki yıla ait t�m katılımcıların HBV ve HCV skorlama değerlendirmeleri V ve VI'da g�sterilmiştir.
Sonu�ların kalitatif değerlendirmeleri Şekil 5'te g�sterilmiştir. Katılımcıların HBV paneli kalitatif değerlendirmesi incelendiğinde, 2015 yılında 2 (%2.7) �rnekte yalancı pozitiflik tespit edilmiştir. 2016 yılında ise, 4 �rnekte yalancı pozitiflik, 3 �rnekte yalancı negatiflik tespit edilmiştir. HCV panelinde ise, 2015 yılındaki �ağrıda 1 �rnekte yalancı pozitiflik, 2 �rnekte yalancı negatiflik saptanırken; 2016 yılında 2 �rnekte yalancı pozitiflik, 1 �rnekte yalancı negatiflik saptanmıştır.
TARTIŞMA
Avrupa Farmakopesi, DKK değerlendirmesi programlarına katılımın, laboratuvarlar i�in �nemli bir NAT kalite g�vencesi s�reci olduğunu belirtmektedir11. Laboratuvar performansının izlenmesi, g�venilir amplifikasyon tekniklerinin sağlanması i�in bir �n şarttır. �lkemizde, 2015 yılına kadar HBV DNA ve HCV RNA kantitatif testleri i�in ulusal olarak hazırlanmış bir DKK programı bulunmaması nedeniyle, bu gereksinim yurt dışından sağlanan kalite kontrol programlarıyla sağlanmaktaydı. Bu nedenle, �alışmamız ile T�rkiye'de HBV DNA ve HCV RNA ile ilgili ilk kez ulusal bir DKK programı hazırlanmış ve başarıyla uygulanarak �lkemiz genelindeki 70'ten fazla laboratuvarda elde edilen test sonu�ları biraraya getirilerek değerlendirilmiş ve yazılı rapor haline getirilmiştir. Kalite kontrol programları, laboratuvar sonu�larının birbirleriyle karşılaştırılmasındaki g�venilirliğin izlenmesine, doğru olmayan sonu�ların raporlanmasını en aza indirmeye, doğru sonu�ların hızlıca ve y�ksek g�venilirlikle raporlanmasına ve kabul edilmemiş test sonu�larının reddedilmesini �nleyerek hataları bildirilmeden �nce tespit ederek tasarruf edilmesine olanak tanımaktadır14. Yeni bir test s�reci değerlendirilirken klinik �nem, maliyet, enstr�mantasyon ve �alışma kolaylığı dikkate alınmalıdır; ancak birincil �nem, test performansının verifikasyonu ve validasyonudur. Bir laboratuvar testi, hatasız ve kesin sonu�lar vermelidir ve aynı zamanda klinik laboratuvarlar i�in kalite g�vence programlarının da �z�n� oluşturmalıdır. Ayrıca doğrulamanın belgelendirilmesi, doğrulanmış bir testin laboratuvarın gereksinimlerinin yerine getirildiğinin g�sterilmesi i�in gereklidir16.
HBV DNA ve HCV RNA kantitasyonunun tanı ve tedavideki �nemi nedeniyle, rutin laboratuvarlarda duyarlı, dinamik aralığı geniş, g�venilir ve tekrarlanabilirliği y�ksek bir kitin kullanılması �nemlidir. G�n�m�zde Rt-PCR y�ntemini kullanan �ok �eşitli ticari kitler bulunmaktadır17. Kronik HBV ve HCV enfeksiyonlarındaki viremiler, �ok d�ş�k veya saptanamayan seviyeden 108 kopya/ml'ye kadar değişmektedir. Bu nedenle; etkin nicelik a�ısından yapılan analizler, geniş bir viral genom konsantrasyon yelpazesini �l�melidir. Yalnızca Rt-PCR, enfeksiyonun t�m aşamalarında vir�s�n miktarının belirlenmesi i�in gereken geniş dinamik aralığı kapsamaktadır18. Ger�ek zamanlı kantitatif PCR y�ntemleri, diğer teknolojilere g�re; �zellikle de klinik araştırmalarda, �ok duyarlı ve geniş bir dinamik aralık �l��s�ne (mevcut y�ntemler ile 7-8 log10) sahip oldukları i�in kullanımları �nerilmektedir12. Ancak, farklı laboratuvarlarda kullanılan farklı veya aynı ticari kitler arasındaki standardizasyonun ve uyumun DKK programlarınca değerlendirilmesi gerekmektedir. Duyarlılık ve �zg�ll�k a�ısından y�ksek performanslı standardize ve valide ticari y�ntemlerin kullanılması, NAT sonu�larının laboratuvarlar arasında uyumlu olmasına daha �st seviyede katkıda bulunmaktadır10.
Yapılan �ağrılarda, katılımcıların neredeyse tamamı HBV ve HCV panelleri i�in uyumlu sonu�lar vermiştir. İlk �ağrının yapıldığı 2015 yılındaki skorların, 2016 yılındaki ikinci �ağrıda daha iyi olduğu g�r�lm�şt�r. Bu da, katılımcı laboratuvarların ilk skorlarını aldıktan sonra d�zeltici/�nleyici faaliyetlerle sonu�larını iyileştirdiklerini g�stermektedir. 2016 yılındaki HBV panelinde yalancı negatiflik tespit edilen 3 �rneğin ikisi, viral y�k� ‘2 log10 IU/ml' olan HBV-K1601.05 kodlu t�pe ait olması nedeniyle d�ş�k viral y�k saptanamamış olabilir. HCV panelinde ise, yine her iki yılda yalancı negatiflik saptanan �rnekler ‘2 ve 3 log10 IU/ml' oranlarında d�ş�k viral y�klere sahip �rneklerden oluşmuştu. Kantitatif sonu�lar incelendiğinde ise, farklı firmaların logaritmik sonu� ortalamalarının birbirleriyle ve teknoloji grup ortalamasıyla genellikle yakın sonu�lara sahip oldukları g�r�lm�şt�r (Tablo I, II, III, IV).
Sonu� olarak, MOTAKK Dış Kalite Kontrol Programı sonu� raporlarında sağlanan bilgiler, yurt dışından elde edilen kalite kontrol programı sonu� raporlarının sağladığı t�m bilgileri karşılamakta; ek olarak, kullanılan teknolojilerin ve ticari �r�nlerin sağlıklı bir şekilde karşılaştırılmalarına olanak sağlamaktadır. �lkemizdeki HBV DNA ve HCV RNA testi �alışılan 70'ten fazla laboratuvarın katılımıyla ger�ekleştirilen bu �alışma; sonu�ların karşılaştırılması ve değerlendirilmesi a�ısından, olduk�a verimli ve faydalı olacak bulguların elde edilmesi nedeniyle de ayrı bir �nem taşımaktadır.
* MOTAKK HBV ve HCV �alışma Grubu (* İsme g�re alfabetik olarak dizilmiştir.) A�elya Yal�ıntaş Oğuz (İontek Laboratuvarı, İstanbul), Ahmet Barış (RTA Laboratuvarları, Kocaeli), Alpaslan Alp (Hacettepe �niversitesi Hastaneleri Merkez Laboratuvarı, Ankara), Alper Aks�zek (Muğla Sıtkı Ko�man �niversitesi EAH, Mikrobiyoloji Lab., Muğla), Arzu Sayıner (Dokuz Eyl�l �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, İzmir), Aydan Karag�l (Antalya Eğitim ve Araştırma Hastanesi, Mikrobiyoloji Lab., Antalya), Aylin Ordu (Şişli Florence Nightingale Hastanesi Molek�ler Mikrobiyoloji Laboratuvarı, İstanbul), Ayşe İstanbullu (Medipol Hastanesi, İstanbul), Barış Otlu (Malatya �niversitesi, Tıbbi Mikrobiyoloji AD, Malatya), Buket Arıdoğan (S�leyman Demirel �niversitesi Tıbbi Mikrobiyoloji AD, Isparta), Burak Aksu (Marmara �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, İstanbul), C. Kurtuluş Buruk (KAT� Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, Trabzon), Ceren Karahan (Ankara �niversitesi Tıp Fak�ltesi, İbn-i Sina Hastanesi Merkez Mikrobiyoloji Lab., Ankara), �akır G�ney (�zel SYNLAB Merkezi Lab., Ankara), Devrim Toks�z (Referans Klinik Laboratuvarı, İstanbul), Dilara Yıldırım (Sivas Numune Hastanesi, Mikrobiyoloji Lab., Sivas), Dilek �olak (Akdeniz �niversitesi Hastanesi, Merkez Laboratuvarı, Antalya), Duygu Eren Dağlar (Aydın Devlet Hastanesi, Tıbbi Mikrobiyoloji Laboratuvarı, Aydın), Duygu Fındık (Sel�uk �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji Lab., Konya), Elif Kaş (Ankara 2. B�lge KHB Genel Sekreterliği, Ankara), Emel �alışkan (D�zce �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, D�zce), Fadile Yıldız Zeyrek (Harran �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, Şanlıurfa), Fatma Arslan (Kayseri Eğitim ve Araştırma Hastanesi, Mikrobiyoloji Lab., Kayseri), Feyza Demir (SB.SB�. Van EAH Mikrobiyoloji B�l�m�, Van), Fikriye Milletli (Ahi Evran �niversitesi, EAH Mikrobiyoloji Lab., Kırşehir), Filiz Kibar (�ukurova �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, Adana), Furkan �zdin�er (Gelişim Tıp Laboratuvarları, İstanbul), G�lnur D�ndar (Centro Laboratuvarı Molek�ler Mikrobiyoloji, İstanbul), Hande Arslan (Başkent �niversitesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji AD, Ankara), Harun Ağca (Uludağ �niversitesi Tıp Fak�ltesi, Mikrobiyoloji AD, Bursa), Hikmet Eda Alışkan (Başkent �niversitesi, Tıbbi Mikrobiyoloji AD, Adana Uygulama ve Araştırma Merkezi Mikrobiyoloji Lab., Adana), H�seyin G�d�c�oğlu (Y�z�nc� Yıl �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, Van), Işıl Fidan (Gazi �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, Ankara), Işın Akyar (Acıbadem Labmed Mikrobiyoloji Lab., İstanbul), İlhan Afşar (İK�� Atat�rk EAH Tıbbi Mikrobiyoloji Lab., İzmir), İlknur Kaleli (Pamukkale �niversitesi, Tıbbi Mikrobiyoloji Merkez Laboratuvarı, Denizli), İsmail D�nmez (Uşak Devlet Hastanesi Mikrobiyoloji Lab., Uşak), Kemalettin Yanık (Ondokuz Mayıs �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, Samsun), Kenan Midilli (İstanbul �niversitesi Cerrahpaşa Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, İstanbul), Kıvan� �ubuk�u (Trabzon Kanuni EAH Klinik Mikrobiyoloji Lab., Trabzon), Mehmet �zdemir (Necmettin Erbakan �niversitesi Hastanesi, Tıbbi Mikrobiyoloji AD, Konya), Melek Acar (Samsun Eğitim ve Araştırma Hastanesi, Mikrobiyoloji Lab., Samsun), Meltem Yalınay (Gazi �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, Ankara), Mert Ahmet Kuşkucu (İstanbul �niversitesi Cerrahpaşa Tıp Fak�ltesi Tıbbi Mikrobiyoloji AD, İstanbul), Mustafa Zahir Bakıcı (Cumhuriyet �niversitesi Uygulama ve Araştırma Hastanesi, Mikrobiyoloji Lab., Sivas), Neriman Aydın (Adnan Menderes �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, Aydın), Neziha Yılmaz (Bozok �niversitesi, Mikrobiyoloji AD, Yozgat), Nihan �eken (Balıkesir Devlet Hastanesi Mikrobiyoloji Lab., Balıkesir), Nihan Ziyade (İstanbul Adli Tıp Kurumu Başkanlığı Postmortem Mikrobiyoloji Laboratuvarı, İstanbul), Nisel Yılmaz (Tepecik Eğitim ve Araştırma Hastanesi, Tıbbi Mikrobiyoloji Lab., İzmir), Osman Birol �zg�m�ş (Recep Tayyip Erdoğan �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, Rize), �zlem Gitmişoğlu (Necip Fazıl Şehir Hastanesi, Mikrobiyoloji Lab., Kahramanmaraş), Recep Demirgan (Anatolia Genetik Lab., İstanbul), Recep Keşli (Afyon Kocatepe �niversitesi, Tıbbi Mikrobiyoloji AD, Afyon), Rıdvan G��kan (Amasya �niversitesi Sabuncuoğlu Şerefeddin EAH, Mikrobiyoloji Kliniği, Amasya), R��han Sert�z (Ege �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, İzmir), Sadık Akg�n (Adıyaman �niversitesi, EAH Tıbbi Mikrobiyoloji Lab., Adıyaman), Sebahat Aksaray (Haydarpaşa Numune Hastanesi, Tıbbi Mikrobiyoloji Lab., İstanbul), Seda Tezcan (Mersin �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, Mersin), Sedat Kaygusuz (Kırıkkale �niversitesi, Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji AD, Kırıkkale), Selma G�kahmetoğlu (Erciyes �niversitesi Tıp Fak�ltesi, Mikrobiyoloji AD, Kayseri), Sevim Meşe (İstanbul �niversitesi, İstanbul Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, İstanbul), Seyit Ahmet Bayık (Adana Numune EAH, Tıbbi Mikrobiyoloji Lab., Adana), Sinem Ak�alı (Celal Bayar �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, Manisa), Şaban G�rcan (Trakya �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, Tekirdağ), Tekin Karslıgil (Gaziantep �niversitesi, Tıbbi Mikrobiyoloji AD, Gaziantep), Tercan Us (Eskişehir Osmangazi �niversitesi, Tıbbi Mikrobiyoloji AD, Eskişehir), Tuncer �zekinci (Dicle �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, Diyarbakır), T�lin Pilgir (Viromed Laboratuvarı, Ankara), Uğur Aslan (Sel�uk �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji Lab., Konya), Uğur Din� (�orlu Devlet Hastanesi Mikrobiyoloji, Lab., �orlu), Umut Safiye Şay Coşkun (TOKAT GOP �niversitesi Hastanesi, Mikrobiyoloji Lab., Tokat), Yeliz �etinkol (Ordu �niversitesi EAH, Tıbbi Mikrobiyoloji Lab., Ordu), Yusuf Keskin (�ukurova Devlet Hastanesi Mikrobiyoloji Lab., Adana), Zeynep Ayaydın (Gazi Yaşargil EAH, Mikrobiyoloji Lab., Diyarbakır), Z�lal Aş�ı Toraman (Fırat �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji AD, Elazığ).
KAYNAKLAR
- Tozun N, Ozdogan O, Cakaloglu Y, et al. Seroprevalence of hepatitis B and C virus infections and risk factors in Turkey: a fieldwork TURHEP study. Clin Microbiol Infect 2015; 21(11): 1020-6.
- Allice T, Cerutti F, Pittaluga F, et al. Comparison of the Cobas Ampliprep�/Cobas TaqMan� HBV Test versus the Cobas Amplicor HBV monitor for HBV-DNA detection and quantification during antiviral therapy. New Microbiol 2008; 31(1): 27-35.
- Toy M, �nder FO, W�rmann T, et al. Age- and region-specific hepatitis B prevalence in Turkey estimated using generalized linear mixed models: a systematic review. BMC Infect Dis 2011; 11: 337.
- Mancini C, Pisani G, Azzi A, et al. Inter-laboratory comparison of qualitative and quantitative detection of hepatitis C (HCV) virus RNA in diagnostic virology: a multicentre study (MS) in Italy. J Clin Virol 2004; 30(4): 313-9.
- Valentine-Thon E, Van Loon AM, Schirm J, et al. European proficiency testing program for molecular detection and quantitation of hepatitis B virus DNA. J Clin Microbiol 2001; 39(12): 4407-12.
- Pisani G, Cristiano K, Marino F, et al. External quality assessment programmes for detection of HCV RNA, HIV RNA and HBV DNA in plasma: improved proficiency of the participants observed over a 2-year period. Vox Sang 2010; 99(4): 319-24.
- Candido A, Chionne P, Milazzo L, et al. Nucleic acid testing (NAT) for HCV RNA in Italian transfusion centres: an external quality assessment. J Clin Virol 2008; 41(4): 277-82.
- Akyar I. Klinik mikrobiyoloji laboratuvarında ISO 15189 akreditasyonu: genel bilgiler ve laboratuvarımızdaki durum. Mikrobiyol Bul 2009; 43(4): 683-97.
- Wang L, Pan Y, Zhang K, et al. A 10-year human hepatitis B virus nucleic test external quality assessment in China: continual improvement. Clin Chim Acta 2013; 425: 139-47.
- Saldanha J, Gerlich W, Lelie N, et al. An international collaborative study to establish a World Health organization international standard for hepatitis B virus DNA nucleic acid amplification techniques. Vox Sang 2001; 80(1): 63-71.
- Gentili G, Pisani G, Bisso G, et al. Hepatitis C virus testing of plasma pools by nucleic acid amplification technology: external quality assessment. Vox Sang 2001; 81(3): 143-7.
- Pawlotsky JM, Dusheiko G, Hatzakis A, et al. Virologic monitoring of hepatitis B virus therapy in clinical trials and practice: recommendations for a standardized approach. Gastroenterology 2008; 134(2): 405-15.
- Sayan M, Willke A, Meri� M, et al. Hepatit B ve C virus n�kleik asit testlerinde NEQAS uluslararası dış kalite kontrol değerlendirme programı sonu�larının analizi. Mikrobiyol Bul 2009; 43(1): 103-114.
- Garrett PE. Quality control for nucleic acid tests: common ground and special issues. J Clin Virol 2001; 20(1-2): 15-21.
- TS EN ISO/IEC 17043: 2010. Uygunluk değerlendirmesi-yeterlilik deneyi i�in genel şartlar.
- Espy MJ, Uhl JR, Sloan LM, et al. Real-time PCR in clinical microbiology: applications for routine laboratory testing. Clin Microbiol Rev 2006; 19(1): 165-256.
- Bi�eroğlu SU, Yazan Sert�z R, Zeytinoğlu A, et al. Hepatit B vir�s kantitasyonunda iki farklı Rt-PCR testinin karşılaştırılması: COBAS AmpliPrep/COBAS TaqMan ve ARTHUS QS-RGQ KİT. Ege Tıp Dergisi 2012; 51(4): 233-7.
- Caliendo AM, Valsamakis A, Bremer JW, et al. Multilaboratory evaluation of real-time PCR tests for hepatitis B virus DNA quantification. J Clin Microbiol 2011; 49(8): 2854-8.
İletişim (Correspondence):
Prof. Dr. A. Mithat Bozdayı,
Ankara �niversitesi Tıp Fak�ltesi
Cebeci Kamp�s�, Hepatoloji Enstit�s�,
Dikimevi, Ankara, T�rkiye.
Tel (Phone): +90 533 437 7892,
E-posta (E-mail): Mithat.Bozdayi@ankara.edu.tr