Nötropenik Olmayan Yoğun Bakım Hastalarında İnvazif Pulmoner Aspergilloz İçin
Risk Faktörlerinin Değerlendirilmesi ve Bronkoalveoler Lavaj Örneklerinde
Galaktomannan ve PCR Testlerinin Tanısal Değerinin Belirlenmesi
Evaluation of Risk Factors for Invasive Pulmonary Aspergillosis and
Detection of Diagnostic Values of Galactomannan and PCR Methods in
Bronchoalveolar Lavage Samples From Non-Neutropenic Intensive Care Unit Patients
Selçuk ÖZGER1, Kenan HIZEL2, Ayşe KALKANCI3, Müge AYDOĞDU4, Füsun CİVİL5, Murat DİZBAY2, Gül GÜRSEL4
1 Gaziantep Dr. Ersin Arslan Devlet Hastanesi, Enfeksiyon Hastalıkları Bölümü, Gaziantep.
1 Dr. Ersin Arslan State Hospital, Infectious Diseases Department, Gaziantep, Turkey.
2 Gazi Üniversitesi Tıp Fakültesi, Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı, Ankara.
2 Gazi University Faculty of Medicine, Department of Infectious Disease and Clinical Microbiology, Ankara, Turkey.
3 Gazi Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Ankara.
3 Gazi University Faculty of Medicine, Department of Medical Microbiology, Ankara, Turkey.
4 Gazi Üniversitesi Tıp Fakültesi, Göğüs Hastalıkları Anabilim Dalı, Ankara.
4 Gazi University Faculty of Medicine, Department of Chest Diseases, Ankara, Turkey.
5 Gazi Üniversitesi Tıp Fakültesi, Halk Sağlığı Anabilim dalı, Ankara.
5 Gazi University Faculty of Medicine, Department of Public Health, Ankara, Turkey.
ÖZ
Nötropenik olmayan yoğun bakım (YB) hastaları, invazif pulmoner aspergilloz (İPA) gelişimi için artmış risk taşımaktadır. Bu olgularda, tanı için kullanılabilecek radyolojik ve mikrobiyolojik yöntemlerin (direkt mikroskopi, kültür) duyarlılık ve özgüllükleri oldukça düşüktür. Bu çalışmada, nötropenik olmayan YB hastalarında İPA risk faktörlerinin değerlendirilmesi, galaktomannan (GM) antijen ve Aspergillus nükleik asit tespiti yöntemlerinin, İPA için tanısal değerinin belirlenmesi amaçlanmıştır. Çalışmaya, Ocak-Aralık 2013 tarihleri arasında, göğüs hastalıkları YB ünitesinde invazif mekanik ventilasyon (İMV) ile takip edilen ve bronkoskopi uygulanan 44 hasta (13 kadın, 31 erkek; yaş aralığı: 36-96 yıl) dahil edilmiştir. Hastalardan bronkoalveoler lavaj (BAL) sıvısı ve eş zamanlı serum örnekleri alınmıştır. BAL örneklerinde Aspergillus DNA'sı polimeraz zincir reaksiyonu (PCR) ile; BAL ve serum örneklerde GM antijeni ise EIA (Platelia Aspergillus, BioRad, Fransa) yöntemi ile çalışılmıştır. İPA için olgu tanımlarının oluşturulmasında EORTC/MSG kriterleri kullanılmış; hastalar yüksek olası İPA, olası İPA ve İPA olmayan olarak gruplandırılmıştır. İPA tanısının konulmasında BAL GM ve BAL Aspergillus PCR yöntemlerinin tanı değerinin belirlenmesi için ROC (receiver operating characteristic) analizi uygulanmıştır. Hastaların beşi yüksek olası İPA, altısı olası İPA olarak tanımlanmış ve nötropenik olmayan YB hastalarında İPA insidansı %11.4 olarak (5/44) belirlenmiştir. Yüksek olası İPA olarak tanımlanan grupta, BAL GM düzeyleri, İPA olmayan gruba göre anlamlı olarak daha yüksek saptanmıştır (p< 0.05). Yoğun bakım yatış süresinin uzaması, septik şok varlığı ve kümülatif steroid dozunun yüksek olması (> 460 mg), İPA gelişimi için risk faktörleri olarak tespit edilmiştir (p< 0.05). BAL GM için 0.7 sınır değerinin İPA tanısındaki duyarlılığı %100 (%95 güven aralığı: 47.9-100), özgüllüğü %87.9 (%95 güven aralığı: 71.7-96.5) olarak bulunmuş ve İPA tanısı için optimal BAL GM değeri ≥ 0.7 olarak değerlendirilmiştir. Serumda GM tespiti ve Aspergillus PCR yöntemlerinin İPA tanısı için özgüllükleri yüksek bulunmakla birlikte (sırasıyla, %97.1 ve %93.9), duyarlılıklarının oldukça düşük olduğu (sırasıyla, %33.3 ve %40) izlenmiştir. Sonuç olarak, nötropenik olmayan hastalar, yoğun bakımda yatış süresinin uzadığı ve yüksek doz kümülatif steroid kullanıldığı durumlarda İPA gelişimi açısından değerlendirilmelidir. Bu hastaların BAL sıvısında GM antijenin saptanması, diğer tanısal yöntemlerle karşılaştırıldığında İPA tanısında etkin olarak kullanılabilir.
Anahtar sözcükler: Aspergillus; invazif pulmoner aspergilloz; risk faktörleri; galaktomannan; bronkoalveoler lavaj.
ABSTRACT
Non-neutropenic intensive care unit (ICU) patients are at particular risk for invasive pulmonary aspergillosis. In these cases, radiological and microbiological methods (direct microscopy, culture), which can be used for diagnosis, have quite low sensitivity and specificity. The aims of this study were to evaluate the risk factors for invasive pulmonary aspergillosis (IPA) in non-neutropenic ICU patients and to determine the diagnostic values of galactomannan (GM) antigen and Aspergillus nucleic acid detection methods. A total of 44 patients (13 female, 31 male; age range: 36-96 years) who had been followed at pulmonary ICU with invasive mechanical ventilation and undergone bronchoscopy between January to December 2013, were included in the study. Consecutive bronchoalveolar lavage (BAL) and serum samples were obtained from all of the patients. BAL samples were tested for the presence of Aspergillus DNA by polymerase chain reaction (PCR) and both serum and BAL samples were tested for GM antigen by EIA method (Platelia Aspergillus, BioRad, France). EORTC/MSG criteria were used for the case definition of IPA. Patients were classified as high-probable IPA, possible IPA and non-IPA. ROC (receiver operating characteristics) analysis was used to determine the diagnostic values of BAL Aspergillus PCR and BAL GM in the diagnosis of IPA. Five patients were defined as high-probable IPA and six were defined as possible IPA; thus the incidence rate of IPA was estimated as 11.4% (5/44) among non-neutropenic intensive care unit patients. In high-probable IPA patients, BAL GM levels were significantly higher than non-IPA patients (p< 0.05). The prolonged duration in ICU, presence of septic shock and the use of high cumulative doses (> 460 mg) of steroid were found to be risk factors for IPA development. The cut-off value for GM in BAL samples was determined as 0.7, with a sensitivity rate of 100% (95% confidence interval: 47.9-100) and a specificity rate of 87.9% (95% confidence interval: 71.7-96.5), so optimal GM level in BAL was considered as ≥ 0.7 for the diagnosis of IPA. The specificity rates of serum GM and BAL Aspergillus PCR methods were high (97.1% and 93.9%, respectively), however their sensitivity rates were found quite low (33.3% and 40%, respectively), in the diagnosis of IPA. In conclusion, development of IPA should be assessed in non-neutropenic patients when the stay in ICU extends and high dose cumulative steroids are used. GM antigen detection in BAL can be used effectively for diagnosis of IPA in these patients compared to other diagnostic methods.
Keywords: Aspergillus; invasive pulmonary aspergillosis; risk factors; galactomannan; bronchoalveolar lavage.
Geliş Tarihi (Received): 10.05.2015 • Kabul Ediliş Tarihi (Accepted): 01.07.2015
GİRİŞ
İnvazif pulmoner aspergilloz, özellikle immün sistemi baskılanmış hastalarda görülen ve yüksek morbidite ve mortalite nedeni olan fırsatçı bir enfeksiyondur1,2,3. Ancak immün baskılanması olmayan yoğun bakım (YB) hastalarında da invazif pulmoner aspergilloz (İPA) artan sıklıkta bildirilmekte olup insidansı %0.33-19 arasında değişkenlik göstermektedir4. Nötropenik olmayan YB hastalarında kronik obstrüktif akciğer hastalığının (KOAH) varlığı, steroid kullanımı, çoklu organ yetmezliği, yoğun bakım ve hastane yatış süresindeki uzama İPA gelişimini kolaylaştırmaktadır5,6,7. Özgül olmayan klinik ve radyolojik bulgular ve kolonizasyon-enfeksiyon ayrımının güçlükle yapılabildiği pozitif kültür sonuçları erken tanı konulmasını zorlaştırmaktadır8,9,10. İPA için altın standart tanı testi kabul edilen histopatolojik inceleme, YB hastalarının büyük çoğunluğunda yapılamamaktadır11. Bu durum, yeni tanı yöntemlerinin kullanıldığı klinik çalışmalara gereksinimi artırmaktadır.
Mantar hücre duvarında yer alan ve doku invazyonu sırasında salındığı bilinen galaktomannan (GM) antijeninin ELISA yöntemiyle vücut sıvılarında saptanması, İPA'nın erken tanısında kullanılmaktadır12. Nötropenik hastalarda serum GM antijeninin tekrarlayan ölçümleri İPA tanısında kullanılmakla birlikte, ancak nötropenik olmayan hastalarda serum GM ölçümünün duyarlılık ve özgüllüğü düşüktür12,13,14,15. Bu olgularda, bronkoalveoler (BAL) sıvısında GM antijeninin saptanmasının İPA tanısındaki duyarlılığı daha yüksektir ve klinik çalışmalardaki önemi giderek artmaktadır11.
Vücut sıvılarında Aspergillus nükleik asidinin polimeraz zincir reaksiyonu (PCR) ile saptanmasının İPA tanısındaki duyarlılığı, standardizasyon sıkıntısı nedeniyle değişkendir ve yöntemin tanı algoritmaları içerisindeki yeri henüz netleşmemiştir1,16. İPA tanısı için geliştirilen klinik algoritmalar çoğunlukla immün sistemi baskılanmış hastaları kapsamaktadır1. Yoğun bakım hastalarında erken tanıya olanak sağlayan klinik algoritmaların geliştirilebilmesi için farklı tanı yaklaşımların uygulandığı klinik çalışmalara ihtiyaç vardır. Bu çalışmanın amacı; nötropenik olmayan YB hastalarında İPA risk faktörlerinin saptanması, BAL GM antijeni ve PCR ile Aspergillus nükleik asidinin saptanmasının, İPA için tanısal değerinin belirlenmesidir.
GEREÇ ve YÖNTEM
Çalışma Popülasyonunun Belirlenmesi ve Verilerin Toplanması
Göğüs hastalıkları yoğun bakım ünitesinde Ocak-Aralık 2013 tarihleri arasında takip edilen invazif mekanik ventilasyon (İMV) ihtiyacı gösteren ve BAL örneği alınan 18 yaşından büyük tüm hastalar çalışmaya dahil edildi. İmmün baskılanmış (hematolojik malignite, solid organ nakli, son 3 ay içinde radyoterapi ve kemoterapi, KOAH dışında steroid kullanımı) ve nötropenik (mutlak nötrofil sayısı < 500 mm3) hastalar çalışma dışında bırakıldı.
Klinik Örneklerin Toplanması
Yoğun bakım klinisyenleri tarafından bronkoskopi uygulanan 44 hastadan toplam 77 BAL örneği alındı. Birden fazla BAL yapılan hastaların son alınan BAL örnekleri değerlendirmeye dahil edildi. BAL örneklemesi ile eş zamanlı klinik değerlendirme yapıldı. YB yatış süresi ve İMV süresi, yatış APACHE II skorları, klinik pulmoner enfeksiyon skorları (CPIS), Charlton komorbidite indeksleri (CCI), toplam kullanılan steroid dozları, kullanılan antibiyotikler, laboratuvar sonuçları ve radyolojik bulgular kaydedildi. BAL örnekleri ile eş zamanlı olarak serum örnekleri alındı; 3000 devirde 15 dakika santrifüj edildikten sonra -20°C'de saklandı.
Klinik Örneklerde GM ve Aspergillus PCR Testleri
Alınan örnekler direkt mikroskopik inceleme ve fungal kültür yapıldıktan sonra -20°C'de saklandı. Fungal kültür için Sabouraud dekstroz agar kullanıldı ve 2 gün 37°C'de, ardından 25°C'de 7 gün inkübe edildi. İzole edilen küfler plaktaki üreme hızları, renkleri, spor ve hif yapılarının mikroskobik özelliklerine göre morfolojik olarak tanımlandı.
GM Tespiti
Toplanan BAL ve serum örneklerinde GM antijeni üretici firma (Platelia Aspergillus, BioRad, Fransa) talimatları doğrultusunda ELISA yöntemi ile 1 ay içerisinde çalışıldı. Oda ısısında çözünen örneklerden 300 μL alınarak mikrosantrifüj tüpüne konuldu ve 100 μL serum treatment solution (R7) eklendi. Pozitif kontrol, negatif kontrol ve eşik değer (cut-off) süspansiyonlarından 300 μL santrifüj tüpüne konulup 100 μL R7 eklendi. 97°C'de 3 dakika inkübe edildikten sonra 10.000 devirde 10 dakika santrifüj edildi. Kitin içerisinde bulunan striplere 50 μL konjugat (R6) eklendi. Santrifüj edilen örneklerin üst sıvısından 50 μL alınarak konjugat içeren striplere eklendi; 37°C'de 90 dakika inkübe edildi ve ardından yıkama solüsyonu ile 5 kez yıkandı. Cam bir steril tüp içinde, her bir strip için 200 μL TMB substrat tamponu (R8), 40 μL kromojen TMB (R9) karıştırıldı ve hazırlanan süspansiyondan 200 μL her bir kuyucuğa dağıtıldı. 30 dakika ışıksız ortamda bekletildikten sonra her bir kuyucuğa 100 μL durdurma solüsyonu (R10) eklendi ve 2 dakika bekletildi. Sonuçlar spektrofometrede 450 nanometre dalga boyunda okundu (Elx800, BioTek, ABD). Sonuçlar, serum için ≥ 0.5, BAL örnekleri için ≥ 0.5-0.7-0.8-1.0-1.5-2.0 sınır değerlerine göre pozitif ve negatif olarak değerlendirildi.
BAL Örneklerinden DNA İzolasyonu ve PCR
Her BAL örneğinden 300 μl alınarak üzerine 1000 μl eritrosit parçalama tamponu eklendi. Beş dakika -20°C'de inkübe edildikten sonra 10.000 devirde 3 dakika santrifüj edildi; üstteki kısım atıldı ve üzerine 100 μL parçalama solüsyonu ve 5 μL proteinaz K eklendi. Örnekler 65°C'de 2 saat, daha sonra 95°C'de 10 dakika inkübe edildi. Ardından 10.000 devirde 1 dakika santrifüj edilen örneklerin üst kısmından 100 μL temiz tüplere aktarıldı. Üzerine 400 μL DNA erime//bağlama solüsyonu eklendi ve karışım 65°C'de 10 dakika bekletildikten sonra 4°C'de tutuldu. Ependorf tüplerinin kapakları açılmadan önce spin santrifüj uygulandı, üzerine 500 μL DNA çöktürme solüsyonu eklenip karıştırıldı. 15 dakika 13.000 devirde santrifüj edildikten sonra üst kısım tamamen alınıp vakumlu santrifüj ile kurutuldu. Son olarak, 50 μL DNA örnek çözme tamponu ile sulandırıldı ve elde edilen total DNA miktarları DNA ölçüm cihazında ölçülerek DNA varlığı kontrol edildi.
Elde edilen DNA örnekleri gerçek zamanlı PCR cihazında çoğaltıldı. Çoğaltma basamağı için en az 10 ng/µL DNA kullanıldı. Çoğaltma için LightCycler (Roche Diagnostics, ABD) cihazı ve LightCycler yazılımının 4.0 versiyonu kullanıldı. BAL örneklerinden elde edilen DNA'ların (reaksiyonda pozitif ve negatif kontrol olarak kullanıldı) çoğaltılmasında Aspergillus'a özgül primer [ileri primer (F) 5'-CTG TCC GAG CGT CAT TG -3' ve geri primer (R) 5'-TCC TCC GCT TAT TGA TAT-3'] ve problar (TaqMan Probu; FAM-AGC CGA CAC CCA ACT TTA TTT-TAMRA) kullanıldı.
Gerçek zamanlı PCR uygulamalarında prob teknolojisi kullanıldı. Amplifikasyon karışımı; kalıp DNA, FastStart DNA Master Plus HybProbe karışım tamponu, mantar primeri ve probları (Eurogentec, Belçika) içerecek şekilde hazırlandı. Karışım malzemeleri -20°C'de saklandı. Karışım 4°C'de soğutulan kurşun blok içinde hazırlandı ve kurşun blok, karışım odasında (temiz oda) örnek sayısı kadar kapiller ile dolduruldu. Karışım malzemesi soğutucudan çıkarıldıktan sonra, tüpler alt üst edilerek karıştırıldı.
Her örnek için hazırlanan ana karışımdan 7.5 μL, DNA'dan ise 2.5 μL kapillerlere eklendi. Amplifikasyon kontrolü için sadece karışımdan 10 µL bir kapiller içerisine konuldu ve negatif kontrol olarak kabul edilen, sadece bu kapillerin kapağı karışım odasında (temiz oda) kapatıldı. Diğerleri ise kurşun bloğun içinde ekstraksiyon odasında bulunan biyogüvenlik kabini içine götürüldü ve orada DNA örneği eklendi. Örnekler hızlı bir şekilde spin santrifüj edilerek LightCycler® 2.0 (Roche, Almanya) cihazına yerleştirildi.
Prob kullanıldığı için amplifikasyon üç aşamada gerçekleştirildi; (1) denatürasyon (95˚C'de 10 sn, sıcaklık değişimi 10˚C/sn), (2) hibridizasyon (zaman ve sıcaklık primerlere bağlı, sıcaklık değişimi 5-20˚C/sn), (3) uzama (72˚C'de primerlere göre değişen zamanlarda, sıcaklık değişimi 20˚C/sn). Gerçek zamanlı PCR amplifikasyonu sonrasında, “absolute quantification” analizi incelenmiştir.
İPA Olgu Tanımları
Çalışmaya dahil edilen tüm hastalar EORTC/MSG tarafından oluşturulan kriterler baz alınarak gruplandırıldı1. Ayrıca daha önce yapılan klinik çalışmalar dikkate alınarak, geniş spektrumlu antibiyotik tedavisine yanıt alınamayan, diğer etiyolojik nedenlerle açıklanamayan pnömoni ve kötüleşen PA akciğer grafisi bulguları da klinik/radyolojik kriterler olarak kabul edildi4,5,17. Öncelikle serum GM pozitifliği ve BAL örneklerindeki kültür pozitifliği mikolojik kriterler olarak belirlendi. BAL GM veya Aspergillus PCR yöntemleri, olgu tanımlarının oluşturulmasında mikolojik kriter olarak kabul edilmedi. Kan GM pozitifliğinin İPA tanı değerinin belirlenebilmesi için, BAL GM pozitifliği mikolojik kriter olarak ele alındı ve İPA olgu tanımları yeniden yapıldı (Tablo I).
İstatistiksel Analiz
Hastalar yüksek olası İPA, olası İPA ve İPA olmayan olarak gruplandırıldı; ancak istatistiksel karşılaştırmalarda olası İPA grubu dışlandı. Tanımlayıcı verilerden kategorik olanlar frekans dağılımı ve yüzde ile ölçüm olanlar ise ortalama (±) standart sapma ve ortanca (en büyük, en küçük değerler) olarak sunuldu. Hasta gruplarının kategorik verilerinin karşılaştırılmasında Ki-kare testi uygulandı. Ölçümle belirtilen verilerin karşılaştırılmasında, parametrik hipotez test koşullarının karşılanamaması nedeniyle non-parametrik testlerden Kruskal-Wallis ve Mann-Whitney U testleri kullanıldı. İPA tanısının konulmasında, BAL GM ve BAL Aspergillus PCR yöntemlerinin tanı değerinin belirlenmesi için ROC analizi uygulandı. Farklı BAL GM sınır değerleri, kan GM ve BAL Aspergillus PCR yöntemi için duyarlılık, özgüllük, pozitif ve negatif prediktif değer (PPD, NPD) hesaplandı. İstatistiksel anlamlılık değeri p< 0.05 olarak kabul edildi.
BULGULAR
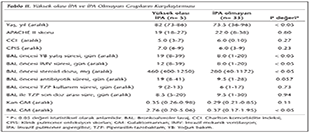
Çalışma kapsamında 13'ü kadın, 31'i erkek 44 kişiye ulaşılmış ve hastalar yüksek olası İPA (n= 5), olası İPA (n= 6) ve İPA olmayan (n= 33) şeklinde gruplandırılmıştır. Yüksek olası İPA ve İPA olmayan gruplar; yaş, altta yatan komorbid durumlar ve çoklu antibiyotik kullanımı açısından karşılaştırılmış, istatistiksel anlamlı fark saptanmamıştır. Yüksek olası İPA grubunda septik şok varlığı, İPA olmayan grubuna göre anlamlı olarak yüksek bulunmuştur (sırasıyla, %60 ve %21.2; p< 0.05). Kategorik olmayan tanımlayıcı değişkenler açısından, yüksek olası İPA ve İPA olmayan hasta gruplarının karşılaştırması Tablo II'de sunulmuştur.
BAL örneklerinde GM ve Aspergillus PCR'ın yüksek olası İPA tanısındaki değerinin saptanması için ROC analizi uygulanmıştır. Yüksek olası İPA olgularında BAL GM pozitifliği için ROC eğrisi altında kalan alan AUC 96.4 [%95 CI (90.4-100)], Aspergillus PCR pozitifliği için ROC eğrisi altında kalan alan AUC 67.0 [%95 CI (37.5-96.4)] olarak saptanmıştır. Farklı GM sınır değerlerinin yüksek olası İPA olgularını tahmin gücünü saptamak amacıyla uygulanan ROC analizi sonuçları Şekil 1'de görülmektedir.
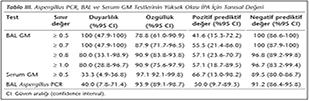
Aspergillus PCR, BAL GM ve serum GM tayini yöntemlerinin, yüksek olası İPA olgularının saptanmasındaki duyarlılık, özgüllük, pozitif ve negatif prediktif değerleri Tablo III'te verilmiştir.
TARTIŞMA
İnvazif fungal enfeksiyonların, yoğun bakım (YB) ünitelerindeki sıklığı ve hasta sağkalımına etkileri artmaktadır. İnvazif Aspergillus enfeksiyonları kandida enfeksiyonlarından sonra, YB hastalarında en sık saptanan fungal enfeksiyonlardır18,19. He ve arkadaşları17 tarafından KOAH ve YB hastalarında yapılan çalışmada; YB öncesi hastanede yatış süresi, çoklu antibiyotik kullanımı, toplam antibiyotik kullanım süresi, steroid kümülatif dozu ve APACHE II skoru İPA gelişimi ile ilgili risk faktörleri olarak saptanmıştır. KOAH, siroz, kronik böbrek yetmezliği, diabetes mellitus, inhaler steroid kullanımı, invazif mekanik ventilasyon ve santral katater varlığı, tanımlanmış olan diğer İPA risk faktörleridir4,7. Çalışmamızda, nötropenik olmayan YB hastalarında İPA insidansı %11.4 (5/44) olarak belirlenmiş; YB'da yatış süresi, İMV süresinin uzaması, kullanılan kümülatif steroid dozu ve septik şok varlığı İPA ile ilişkili risk faktörleri olarak değerlendirilmiştir (p< 0.05; Tablo II).
Yoğun bakımda steroid kullanımının, Aspergillus türlerinin solunum yollarındaki kolonizasyonu ve İPA gelişimini kolaylaştırdığı düşünülmektedir. Steroid kullanım süresindeki uzamanın, solunum yollarında Aspergillus izolasyon sıklığını artırdığı gösterilmiştir20. Steroid kullanımının doza bağımlı olarak İPA riskini artırdığı bilinmekte, ancak İPA riskini artıran steroid dozu hakkında görüş birliği bulunmamaktadır. Barberan ve arkadaşları10, solunum salgılarında tekrarlayan Aspergillus üremeleri olan hastalarda 100 mg ve üzeri steroid kullanımının İPA ile ilişkili olduğunu göstermişlerdir. He ve arkadaşları17 da, kümülatif 350 mg ve üzerinde prednizolon kullanımının İPA riskini 8.6 kat artırdığını bildirmişledir. Çalışmamızda da, literatür21 bilgileri ile paralel olarak, steroid kullanımının doza bağımlı olarak İPA gelişiminde etkili olduğu saptanmış ve yüksek olası İPA olgularında kümülatif steroid dozu 460 mg olarak belirlenmiştir.
Klinik ve radyolojik bulguların ayırt edici niteliğinin düşük olması, İPA tanısında mikrobiyolojik yöntemlerin kullanılmasını gerektirmektedir. Nötropenik hastalarda solunum salgılarından Aspergillus izolasyonunun İPA ile ilişkili olma ihtimali yüksektir. Ancak nötropenik olmayan YB hastalarında kolonizasyon enfeksiyon ayrımı güçlükle yapılmaktadır10. Bu nedenle mikrobiyolojik tanı yaklaşımları, konvansiyonel yöntemlerden serolojik ve moleküler yöntemlere doğru kaymaktadır. Vücut sıvılarında GM antijeninin saptanması İPA tanısında kullanılmaktadır. Serum GM antijeninin tekrarlayan pozitifliği, immün sistemi baskılanmış hastalarda İPA tanısında oldukça yararlıdır12. Ancak YB hastalarında serum GM tayininin tanısal duyarlılığının %42'ye kadar düştüğü gösterilmiştir14. Çalışmamızda, yüksek olası İPA ve İPA olmayan olgular arasında serum GM düzeyleri açısından fark saptanmamıştır. Serum GM düzeyinin, yüksek olası İPA olgularındaki tanısal duyarlılığı %33.3 olarak tespit edilmiştir. Nötropenik olmayan İPA olgularında inflamatuar yanıtın fazla olması nedeniyle, fungal yükün ve damar invazyonunun daha az olması, bu olgularda serum GM duyarlılığındaki azalmanın en önemli nedenidir. Ayrıca immün sistemi normal hastalarda, GM antijeninin dolaşımdan temizlendiği ve nötrofil sayısının artması ile serum GM antijenin tanı değerinin düştüğü de, yapılan çalışmalarla gösterilmiştir22.
Bronkoalveoler lavaj sıvısında GM antijen tespitinin İPA tanısındaki duyarlılığı, nötropenik ve nötropenik olmayan hasta gruplarında serum GM antijenine göre daha yüksektir. Bu durum, testin, fungal yükün fazla olduğu primer enfeksiyon bölgesinde çalışılmasından kaynaklanmaktadır23,24. Ancak, serum GM antijeninin aksine, BAL sıvısında GM antijeninin pozitif sınır değeri konusunda görüş birliği bulunmamaktadır. D'Haese ve arkadaşları25 tarafından yapılan çalışmada, nötropenik ve nötropenik olmayan İPA olgularında optimal GM değeri ≥ 0.8 olarak saptanmıştır. Zou ve arkadaşları24 tarafından yapılan meta-analizde ise, İPA için optimal GM değeri ≥ 1.0 olarak bildirilmiştir. Çalışmamızda, BAL GM antijeninin, serum GM antijenine göre İPA tanı değerinin yüksek olduğu belirlenmiştir. BAL sıvısında farklı GM sınır değerleri için duyarlılık ve özgüllükler belirlendiğinde, nötropenik olmayan YB hastalarında optimal BAL GM değeri ≥ 0.7 olarak tespit edilmiştir (duyarlılık %100, özgüllük %87.9; Tablo III).
Galaktomannan antijeni; beta-laktam antibiyotik kullanımı, Aspergillus kolonizasyonu, diğer mantarlar ve gıdalarla çapraz reaksiyon ve laboratuvar kontaminasyonu nedeniyle pozitif olarak saptanabilmektedir26,27. Aubry ve arkadaşları28 tarafından yapılan çalışmada, immünosüpresif hastalarda beta-laktam kullanımının, serum GM antijenini ortalama üçüncü günde pozitifleştirdiği ve tedavi kesilmesine rağmen pozitifliğin ortalama 5.5 gün devam ettiği gösterilmiştir. Aynı çalışmada, antibiyotik şişelerinden alınan örneklerin %86'sında GM pozitifliği saptanmıştır28. Çalışmamızda, yüksek olası İPA ve İPA olmayan hasta grupları, piperasilin-tazobaktam (TZP) kullanımı açısından karşılaştırıldığında anlamlı bir fark izlenmemiş; buna göre TZP kullanımının yüksek olası İPA grubundaki BAL GM pozitifliği ile ilişkisi saptanmamıştır.
Aspergillus PCR yönteminin İPA tanısında kullanımı, hızlı olması ve fungal yükün erken dönemde belirlenmesinde yüksek duyarlılığa sahip olması nedeniyle yaygınlaşmaktadır. Hematolojik maligniteli hastalarda, seri ölçümlerdeki pozitifliğin İPA ile ilişkisi tanımlanmıştır29. Buna karşın, DNA salınımındaki dalgalı seyir nedeniyle kan örneklerinde negatiflikler saptanabilmektedir. Serum örneklerine göre, BAL'da uygulanan PCR'ın duyarlılığı daha yüksektir29,30. Bu nedenlerden dolayı çalışmamızda, Aspergillus PCR çalışması için serum örnekleri yerine BAL örnekleri tercih edilmiştir. Sun ve arkadaşları16 tarafından immünosüpresif hastaları kapsayan bir meta-analizde, BAL sıvısında yöntemin duyarlılık ve özgüllüğü sırasıyla %91 ve %92 olarak belirtilmiştir. Reinwald ve arkadaşlarının31 çalışmasında da, immünosüpresif hastalarda duyarlılık ve özgüllük sırasıyla %59 ve %87 olarak saptanmıştır. Bir başka meta-analizde de, GM ve PCR yöntemleri karşılaştırılmış; iki tanısal testin birlikte kullanımıyla, özgüllükte belirgin düşme olmadan duyarlılığın artırılabileceği vurgulanmış, ancak PCR yönteminin GM antijen testine tanısal bir üstünlüğü saptanmamıştır32. Aspergillus PCR çalışmalarında duyarlılık aralığının değişken olması, yöntemin standardize edilememesinden kaynaklanmaktadır. Ekstraksiyon yöntemi, PCR protokolü, kullanılan primerler ve problardaki farklılıklar nedeniyle sonuçlar değişebilmektedir16,31. Aspergillus PCR çalışmalarının çoğu, hematolojik maligniteli immünosüpresif hasta grubunda yapılmış olup, YB hastalarında yöntemin tanısal etkinliğine dair veriler yetersizdir. Çalışmamızda, BAL Aspergillus PCR yönteminin, YB hasta grubundaki duyarlılık ve özgüllüğü sırasıyla %40 ve %93.9 olarak saptanmış; BAL GM antijen tespiti ile karşılaştırıldığında İPA için tanısal bir üstünlüğü tespit edilmemiştir. Sonuç olarak, nötropenik olmayan YB hastaları, yatış süresinin uzadığı ve yüksek doz kümülatif steroid kullanımının varlığı durumunda İPA gelişimi açısından değerlendirilmelidir. Bu hastaların BAL sıvısında GM antijenin saptanması, diğer tanısal yöntemlerle karşılaştırıldığında İPA tanısında etkin olarak kullanılabilir.
KAYNAKLAR
- De Pauw B, Walsh TJ, Donnelly JP, et al; European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group; National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Clin Infect Dis 2008; 46(12): 1813-21.
- Steinbach WJ, Marr KA, Anaissie EJ, et al. Clinical epidemiology of 960 patients with invasive aspergillosis from the PATH Alliance registry. J Infect 2012; 65(5): 453-64.
- Walsh TJ, Anaissie EJ, Denning DW, et al. Treatment of aspergillosis: clinical practice guidelines of the Infectious Diseases Society of America. Clin Infect Dis 2008; 46(3): 327-60.
- Meersseman W, Lagrou K, Maertens J, Van Wijngaerden E. Invasive aspergillosis in the intensive care unit. Clin Infect Dis 2007; 45(2):205-16.
- Bulpa P, Dive A, Sibille Y. Invasive pulmonary aspergillosis in patients with chronic obstructive pulmonary disease. Eur Respir J 2007; 30(4): 782-800.
- Kousha M, Tadi R, Soubani AO. Pulmonary aspergillosis: a clinical review. Eur Respir Rev 2011; 20(121):156-74.
- Trof RJ, Beishuizen A, Debets-Ossenkopp YJ, Girbes AR, Groeneveld AB. Management of invasive pulmonary aspergillosis in non-neutropenic critically ill patients. Intensive Care Med 2007; 33(10): 1694-703.
- Hachem R, Sumoza D, Hanna H, Girgawy E, Munsell M, Raad I. Clinical and radiologic predictors of invasive pulmonary aspergillosis in cancer patients: should the European Organization for Research and Treatment of Cancer/Mycosis Study Group (EORTC/MSG) criteria be revised? Cancer 2006; 106(7): 1581-6.
- Vandewoude KH, Blot SI, Depuydt P, et al. Clinical relevance of Aspergillus isolation from respiratory tract samples in critically ill patients. Crit Care 2006; 10(1): R31.
- Barberan J, Alcazar B, Malmierca E, et al; ASP Investigator Group. Repeated Aspergillus isolation in respiratory samples from non-immunocompromised patients not selected based on clinical diagnoses: colonisation or infection? BMC Infect Dis 2012; 12: 295.
- Meersseman W, Vandecasteele SJ, Wilmer A, Verbeken E, Peetermans WE, Van Wijngaerden E. Invasive aspergillosis in critically ill patients without malignancy. Am J Respir Crit Care Med 2004; 170(6): 621-5.
- Maertens JA, Klont R, Masson C, et al. Optimization of the cutoff value for the Aspergillus double-sandwich enzyme immunoassay. Clin Infect Dis 2007; 44(10): 1329-36.
- Maertens J, Verhaegen J, Demuynck H, et al. Autopsy-controlled prospective evaluation of serial screening for circulating galactomannan by a sandwich enzyme-linked immunosorbent assay for hematological patients at risk for invasive aspergillosis. J Clin Microbiol 1999; 37(10): 3223-8.
- Meersseman W, Lagrou K, Maertens J, et al. Galactomannan in bronchoalveolar lavage fluid: a tool for diagnosing aspergillosis in intensive care unit patients. Am J Respir Crit Care Med. 2008; 177(1): 27-34.
- Wheat LJ, Walsh TJ. Diagnosis of invasive aspergillosis by galactomannan antigenemia detection using an enzyme immunoassay. Eur J Clin Microbiol Infect Dis 2008; 27(4): 245-51.
- Sun W, Wang K, Gao W, et al. Evaluation of PCR on bronchoalveolar lavage fluid for diagnosis of invasive aspergillosis: a bivariate metaanalysis and systematic review. PloS One 2011; 6(12): e28467.
- He H, Ding L, Li F, Zhan Q. Clinical features of invasive bronchial-pulmonary aspergillosis in critically ill patients with chronic obstructive respiratory diseases: a prospective study. Crit Care 2011; 15(1): R5.
- Patterson TF. Aspergillus species, pp: 2958-73. In: Mandell GL Bennet J, Dolin R (eds), Principles and Practice of Infectious Diseases. 2005, 6th ed. Churchill Livingstone, Philadelphia.
- Kriengkauykiat J, Ito JI, Dadwal SS. Epidemiology and treatment approaches in management of invasive fungal infections. Clin Epidemiol 2011; 3: 175-91.
- Garnacho-Montero J, Amaya-Villar R. A validated clinical approach for the management of aspergillosis in critically ill patients: ready, steady, go! Crit Care 2006; 10(2): 132.
- Hartemink KJ, Paul MA, Spijkstra JJ, Girbes AR, Polderman KH. Immunoparalysis as a cause for invasive aspergillosis? Intensive Care Med 2003; 29(11): 2068-71.
- Cordonnier C, Botterel F, Ben Amor R, et al. Correlation between galactomannan antigen levels in serum and neutrophil counts in haematological patients with invasive aspergillosis. Clin Microbiol Infect 2009; 15(1): 81-6.
- Guo YL, Chen YQ, Wang K, Qin SM, Wu C, Kong JL. Accuracy of BAL galactomannan in diagnosing invasive aspergillosis: a bivariate metaanalysis and systematic review. Chest 2010; 138(4): 817-24.
- Zou M, Tang L, Zhao S, et al. Systematic review and meta-analysis of detecting galactomannan in bronchoalveolar lavage fluid for diagnosing invasive aspergillosis. PloS One 2012; 7(8): e43347.
- D'Haese J, Theunissen K, Vermeulen E, et al. Detection of galactomannan in bronchoalveolar lavage fluid samples of patients at risk for invasive pulmonary aspergillosis: analytical and clinical validity. J Clin Microbiol 2012; 50(4): 1258-63.
- Ansorg R, van den Boom R, Rath PM. Detection of Aspergillus galactomannan antigen in foods and antibiotics. Mycoses 1997; 40(9-10): 353-7.
- Boonsarngsuk V, Niyompattama A, Teosirimongkol C, Sriwanichrak K. False-positive serum and bronchoalveolar lavage Aspergillus galactomannan assays caused by different antibiotics. Scand J Infect Dis 2010; 42(6-7):461-8.
- Aubry A, Porcher R, Bottero J, et al. Occurrence and kinetics of false-positive Aspergillus galactomannan test results following treatment with beta-lactam antibiotics in patients with hematological disorders. J Clin Microbiol 2006; 44(2):389-94.
- Khot PD, Ko DL, Hackman RC, Fredricks DN. Development and optimization of quantitative PCR for the diagnosis of invasive aspergillosis with bronchoalveolar lavage fluid. BMC Infect Dis 2008; 8:73.
- Mengoli C, Cruciani M, Barnes RA, Loeffler J, Donnelly JP. Use of PCR for diagnosis of invasive aspergillosis: systematic review and meta-analysis. Lancet Infect Dis 2009; 9(2): 89-96.
- Reinwald M, Spiess B, Heinz WJ, et al. Diagnosing pulmonary aspergillosis in patients with hematological malignancies: a multicenter prospective evaluation of an Aspergillus PCR assay and a galactomannan ELISA in bronchoalveolar lavage samples. Eur J Haematol 2012; 89(2): 120-7.
- Avni T, Levy I, Sprecher H, Yahav D, Leibovici L, Paul M. Diagnostic accuracy of PCR alone compared to galactomannan in bronchoalveolar lavage fluid for diagnosis of invasive pulmonary aspergillosis: a systematic review. J Clin Microbiol 2012; 50(11): 3652-8.
İletişim (Correspondence):
Dr. Selçuk Özger,
Dr. Ersin Arslan Devlet Hastanesi,
Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Kliniği,
Şahinbey, Gaziantep, Türkiye.
Tel (Phone): +90 505 805 6042,
E-posta (E-mail): sozger@yahoo.com