Gıda Kökenli Salmonella enterica Suşlarının Patojenik Fenotiplerinin ve
Virülans Determinantlarının Caenorhabditis elegans Hayvan Modelinde İncelenmesi*
Investigation of Pathogenic Phenotypes and Virulence Determinants of Food-Borne
Salmonella enterica Strains in Caenorhabditis elegans Animal Model
Deniz AKSOY1, Ece ŞEN1,2
1 Trakya Üniversitesi Fen Fakültesi, Biyoloji Bölümü, Temel ve Endüstriyel Mikrobiyoloji Anabilim Dalı, Edirne.
1 Trakya University Faculty of Sciences, Department of Biology, Basic and Industrial Microbiology Section, Edirne, Turkey.
2 Trakya Üniversitesi, Fen Bilimleri Enstitüsü, Biyoteknoloji ve Genetik Anabilim Dalı, Edirne.
2 Trakya University, Institute of Natural Sciences, Biotechnology and Genetics Department, Edirne, Turkey.
* Bu çalışma, Trakya Üniversitesi Bilimsel Araştırma Projeleri Birimi (TÜBAP) tarafından 2013-59 numaralı proje ile maddi olarak desteklenmiştir. Çalışmanın bir kısmı 22. Ulusal Biyoloji Kongresi (23-27 Haziran 2014, Eskişehir)'nde poster olarak sunulmuştur.
ÖZ
Tifo dışı Salmonella enterica serotipleri ile kontamine gıdaların tüketiminin neden olduğu salmonellozlar, gıda kökenli hastalıkların başında gelmekte ve bu durum mikrobiyal gıda güvenliğini, önemli bir halk sağlığı sorunu haline getirmektedir. Bu çalışma, Edirne ilindeki gıda kaynaklı Salmonella enterica suşlarının antibiyotik dirençlerinin, serotiplerinin, plazmid profillerinin ve Caenorhabditis elegans hayvan modeli sisteminde patojenite potansiyellerinin belirlenmesi amacıyla gerçekleştirilmiştir. Çalışmada, tavuk karkaslarından izole edilmiş ve 26'sı (%81.25) Infantis, dördü (%12.5) Enteritidis, birer tanesi de (%3.1) Telaviv ve Kentucky serotiplerine dahil olan 32 Salmonella izolatı kullanılmıştır. İzolatların antibiyotik direnç profilleri, disk difüzyon ve buyyon mikrodilüsyon yöntemleriyle belirlenmiştir. İzolatların patojenite potansiyellerinin belirlenmesi amacıyla yeni bir C.elegans nematod model sistemi kullanılmıştır. Antibiyotik direnç profillerine göre 32 suştan birinin (%3) gentamisine, ikisinin (%6.2) siprofloksasine, üçünün (%9.4) ampisiline, 18'inin (%56.3) kanamisine, 19'unun (%60.8) neomisine, 25'inin (%78.1) tetrasikline, 25'inin (%78.1) trimetoprime, 26'sının (%81.2) nalidiksik aside, 27'sinin (%84.4) streptomisine ve tümünün (%100) sülfonamid bileşiklerine dirençli olduğu belirlenmiştir. Çalışılan 32 suşun hepsi kloramfenikol ve ampisillin/sulbaktama karşı duyarlı bulunmuştur. Streptomisin, nalidiksik asit, tetrasiklin, trimetoprim, sülfonilamid bileşikleri, kanamisin ve neomisine karşı yüksek düzeyde direnç belirlenmiştir. Plazmid analizi sonuçlarına göre altı izolatın (%18.75), büyüklükleri 1.2 ile 42.4 kb arasında değişen 1-3 adet plazmid taşıdığı belirlenmiştir. C.elegans nematod modeli sisteminde, her bir deney grubu için nematodların %50'sinin ölmesi için geçen gün (TD50) hesaplanmıştır. TD50 değerleri, pozitif kontrol olarak kullanılan S.Typhimurium ATCC 14028 ile beslenen nematod grubu için 4.2 ± 0.5 gün, negatif kontrol olarak kullanılan E.coli OP50 ile beslenen nematod grubu için ise 8.0 ± 0.02 gün olarak hesaplanmıştır. TD50 değeri, Salmonella izolatları ile beslenen nematod grupları için ise 3.4 - 7.3 gün arasında bulunmuştur. Pozitif kontrol grubundan elde edilen TD50 değeri ile deney gruplarından elde edilen TD50 değerleri arasındaki farklılığın istatistiksel olarak anlamlı olup olmadığı Student's t-testi ile analiz edilmiştir. Infantis serotipinden altı ve Enteritidis serotipinden dört adet olmak üzere toplam 10 izolatın (%31.25) C.elegans için patojen olmadığı; Infantis, Kentucky ve Telaviv serotiplerine ait izolatları içeren diğer 22 izolatın (%67.75) ise patojen olduğu belirlenmiştir (p< 0.05). Patojen izolatlardan 20'sinde (%90.9) çoklu ilaç direnci saptanmış ve üçünün, büyüklükleri 1.2 ile 42.4 kb arasında değişen 1-3 adet plazmid taşıdığı tespit edilmiştir. Elde edilen sonuçlar, antibiyotik direnci taşıyan Salmonella enterica suşlarının yaygınlığını vurgulamış ve yeni deney hayvanı enfeksiyon modelleri sayesinde çevresel ve gıda kökenli suşların patojenik potansiyellerinin incelenmesini hedefleyen çalışmalara pratik bir yaklaşım sağlamıştır. Bu çalışmada, C.elegans, yurdumuzda ilk kez gıda kökenli Salmonella serotiplerinin patojenite profillerinin saptanmasında kullanılmıştır.
Anahtar sözcükler: Salmonella; Caenorhabditis elegans; virülans; antibiyotik direnci; plazmid.
ABSTRACT
Salmonellosis, caused by non-typhoidal Salmonella enterica serovars with the consumption of contaminated food, is one of the leading food-borne disease that makes microbial food safety an important public health issue. This study was performed in order to determine the antibiotic resistance, serotyping, plasmid profiles and pathogenicity potentials of food-borne Salmonella isolates in Caenorhabditis elegans animal model system in Edirne province, located at Thrace region of Turkey. In this study, 32 Salmonella isolates, of which 26 belonged to Infantis, four to Enteritidis, one to Telaviv and one to Kentucky serovars, isolated from chicken carcasses were used. Antibiotic resistance profiles were determined by disc diffusion and broth microdilution methods. A new C.elegans nematode animal model system was used to determine the pathogenicity potential of the isolates. The antibiotic resistance profiles revealed that one (3.1%) isolate was resistant to gentamicin, two (6.2%) to ciprofloxacin, three (9.4%) to ampicillin, 18 (56.3%) to kanamycin, 19 (60.8%) to neomycin, 25 (78.1%) to tetracycline, 25 (78.1%) to trimethoprim, 26 (81.25%) to nalidixic acid, 27 (84.4%) to streptomycin and 32 (100%) to sulfonamide. All of the 32 strains were susceptible to chloramphenicol and ampicillin/sulbactam. High levels of resistance to streptomycin, nalidixic acid, tetracycline, trimethoprim, sulfonamide, kanamycin and neomycin was determined. According to the plasmid analysis, six isolates (18.75%) harboured 1-3 plasmids with sizes between 1.2 and 42.4 kb. In C.elegans nematode animal model system, the time (in days) required to kill 50% (TD50) of nematodes was calculated for each experimental group. TD50 values of the nematode group fed with S.Typhimurium ATCC 14028 that was used as the positive control and another group fed with E.coli OP50 as the negative control were 4.2 ± 0.5 days and 8.0 ± 0.02 days, respectively. TD50 of the groups fed with Salmonella isolates ranged between 3.4 and 7.3 days. The significance of the differences between TD50 values of the positive control and experimental groups was analysed by using Student's t test. Ten of the isolates (31.25%), of which six belonged to Infantis and four to the Enteritidis serotypes were non-pathogenic, and the rest 22 isolates including Infantis, Kentucky and Telaviv serovars (67.75%) were found to be pathogenic for the C.elegans animal system (p< 0.05). Twenty of the isolates (90.9%) which were determined as pathogens showed multiple drug resistance and three of them possessed 1-3 plasmids, sizes between 1.2 - 42.4 kb. The overall results underlined wide distribution of antibiotic-resistant Salmonella enterica strains and provided a practical alternative for studies aiming determination of pathogenic potential of environmental and food-borne strains through new experimental animal infection model. In this study, C.elegans was utilized for the first time to determine the profiles of pathogenicity of food-borne Salmonella serotypes in Turkey.
Keywords: Salmonella; Caenorhabditis elegans; virulence; antibiotic resistance; plasmid.
Geliş Tarihi (Received): 24.03.2015 • Kabul Ediliş Tarihi (Accepted): 02.07.2015
GİRİŞ
Tifo dışı (non-typhoidal) Salmonella enterica serotiplerinin neden olduğu salmonellozlar, dünya çapında önemli gıda kökenli hastalıkların başında gelmekte ve her yıl ölümle sonuçlanabilen yüz binlerce olgu görülmektedir1. Çeşitli hayvanların gastrointestinal sistemleri, Salmonella'yı da içeren enterik patojenler için başlıca kaynaklardır. Enfekte olmuş hayvanlar ile doğrudan temas, Salmonella enfeksiyonlarına neden olabilir; fakat insanlarda görülen salmonelloz olgularının büyük bir çoğunluğu kontamine gıdaların tüketimi ile ilişkilidir2,3. Özellikle kanatlı ürünleri, insanlarda gıda kökenli patojen enfeksiyonları için başlıca rezervuardır ve salmonelloz salgınları için önemli bir risk grubudur4,5. Tavuk eti başta olmak üzere, çiğ veya az pişmiş kontamine kanatlı etlerinin tüketimi, salmonelloza neden olabilmektedir. Bugüne kadar tavuk eti kaynaklı çeşitli salgınlar rapor edilmiştir6,7.
Salmonellozlar sadece olgu sayılarıyla değil, aynı zamanda antimikrobiyallere dirençli suşların artmasıyla da önemli bir halk sağlığı sorunudur. Antibiyotiklerin tıp ve veterinerlikte yaygın kullanımı nedeniyle antimikrobiyallere dirençli varyant bakteriler ortaya çıkmaktadır8,9. Tedavi gerektirmeyen gastroenterit olgularının yanı sıra, özellikle çocuklar, yaşlılar ve immün yetmezliği olan hastalarda ortaya çıkan invazif Salmonella spp. enfeksiyonlarında antimikrobiyal tedavi önerilmektedir10,11. Salgınlar veya sporadik olarak ortaya çıkan salmonelloz olguları üzerinde yapılan çalışmalar, enfeksiyonun şiddeti ile antimikrobiyal direnç arasındaki ilişkiyi ortaya koymuştur12,13.
Mikrobiyal patojenlerin tiplendirilmesi, enfeksiyonların tanı, tedavi ve epidemiyolojik olarak izlenmesinde önemli rol oynamaktadır. İzolatlar, serotiplendirme ve antibiyotik direnç profilleri gibi fenotipik özelliklerine göre veya moleküler tiplendirme teknikleri kullanılarak genotipleme yöntemleriyle tanımlanabilirler14.
Tifo dışı Salmonella spp. kökenlerinin patojeniteleri, fareden buzağıya kadar çeşitli hayvan modellerinde incelenmiştir; ancak bu omurgalı hayvan modelleri ile karşılaştırıldığında, omurgasız hayvan modeli ile çalışmak bütçe, organizmanın basit yapısı, izlenebilir yaşam süresi ve kolay üretilmesi gibi birçok özellik dikkate alındığında çok daha avantajlı hale gelmektedir15,16. Son yıllarda kullanılan omurgasız hayvan modellerinden birisi de, serbest olarak yaşayan ve bakteri ile beslenen bir toprak nematodu olan Caenorhabditis elegans'dır. C.elegans, Nematode Growth Medium (NGM) agarda üretilen, patojen olmayan E.coli OP50 ile beslendiği zaman, oda sıcaklığında yaklaşık iki haftalık bir yaşam döngüsüne sahiptir17,18. Ancak C.elegans, insan patojenleri ile beslendiğinde kısa sürede ölmektedir. İnsan patojenleri olan Salmonella Typhimurium, Serratia marcescens, Staphylococcus aureus, Vibrio cholerae ve Burkholderia pseudomallei suşları, besin kaynağı olarak verildiğinde C.elegans'ı öldürmektedir ve çeşitli bakteriyel virülans faktörlerinin, nematodlar ve insanda patogenezin ortaya çıkmasında rol oynadığı belirlenmiştir19,20,21,22.
Bu çalışmada Edirne ilindeki gıda kaynaklı Salmonella enterica suşlarının antibiyotik direnci, serotipleri, patojenik fenotipleri C.elegans deney hayvanı model sistemi ile incelenmiş ve suşların plazmid profilleri karşılaştırılmıştır. Böylece, C.elegans deney hayvanı sisteminde patojen olduğu saptanan kökenlerin, antibiyotik direnç durumları ile plazmid profilleri arasında korelasyon bulunup bulunmadığı araştırılmıştır.
GEREÇ ve YÖNTEM
Bakteri ve Nematod Suşları
Çalışmada, Salmonella suşları olarak, Trakya Üniversitesi Moleküler Mikrobiyoloji Laboratuvarı Kültür Koleksiyonunda bulunan, Edirne ilinde satışa sunulan tavuk karkaslarından izole edilen suşlar kullanıldı. C.elegans atasal suşu N2 ve E.coli OP50 suşu ise C.elegans Genetic Center (CGC), University of Minesota'dan temin edildi.
Serotiplendirme
Salmonella suşlarının serotiplendirilmesi Türkiye Halk Sağlığı Kurumu, Ulusal Enterik Patojenler Referans Laboratuvarı tarafından gerçekleştirildi.
Plazmid Analizi
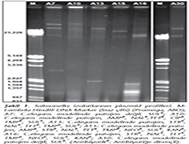
Plazmid izolasyonu, Kado ve Liu'nun23 yöntemi modifiye edilerek gerçekleştirildi. Analiz için, 1X Tris asetat EDTA (TAE) tamponu ile hazırlanan %0.7'lik agaroz jel kullanıldı. Elektroforez işlemi 100V sabit elektrik akımında başlatıldı ve 15 dk sonra örneklerin kuyudan çıkmasıyla 120V sabit elektrik akımında 3 saat süre ile gerçekleştirildi. Ardından jel, 2 µg/ml etidyum bromür içeren boya çözeltisinde 20 dk süre ile boyandı ve UV ışık altında görüntüleme sistemi kullanılarak (Cleaver, ABD) fotoğrafları çekildi. Plazmid büyüklükleri Lambda Hind III DNA Marker (Promega, ABD) kullanılarak hesaplandı.
Antimikrobiyal Duyarlılığın Belirlenmesi
Suşların antimikrobiyal duyarlılıkları, disk difüzyon metodu; antibiyotiklerin minimal inhibisyon konsantrasyonları (MİK) ise buyyon mikrodilüsyon metodu kullanılarak belirlendi24,25. Disk difüzyon metodunda; kloramfenikol (30 µg), ampisilin (10 µg), streptomisin (10 µg), gentamisin (10 µg), nalidiksik asit (30 µg), tetrasiklin (30 µg), siprofloksasin (5 µg), neomisin (10 µg), ampisilin/sulbaktam (10 µg), sülfanilamid (250 µg), seftiofur (30 µg), kanamisin (30 µg) ve trimetoprim (5 µg) olmak üzere 13 farklı antibiyotik diski kullanıldı.
Deney Hayvanı Modelinde Patogenezin Belirlenmesi
C.elegans eş zamanlı larvaların hazırlanması
C.elegans N2 suşu ‘'chunking'' metodu ile içerisinde E.coli OP50 üretilmiş NGM (Nematode Growth Medium) agar içeren petrilere (60 mm çaplı) aktarıldı ve 3 gün oda sıcaklığında inkübe edildi. İnkübasyon sonrası petriler 2 ml M9 tampon ile yıkandı. Yumurta taşıyan (gravid) nematodlar ve yumurtalar, pastör pipeti ile steril 15 ml'lik konik santrifüj tüplerine aktarıldı ve son hacim 3.5 ml'ye tamamlandı. Her bir tüpe 0.5 ml 5N NaOH ve 1 ml %5 sodyum hipoklorit solüsyonu eklendi ve oda sıcaklığında 10 dk inkübasyona bırakıldı. Tüpler, inkübasyon sırasında 2 dk aralıkla vorteks ile karıştırıldı ve 1300 g'de 30 sn santrifüj edildi. Süpernatan pastör pipeti ile atıldı. Tüplere 5 ml M9 tampon eklenerek vorteks ile birkaç sn karıştırıldı ve 1300 g'de 30 sn santrifüj edildi. Sediment M9 tampon solüsyonu ile 2 kez yıkandı. Son santrifüjden sonra sediment 7 ml M9 tamponda çözüldü ve 18 saat 25°C'de inkübe edildi. İnkübasyon sonrası yumurtalardan çıkan L1 larvalar 1300 g'de 30 sn santrifüjlenerek toplandı. Süpernatan 0.1 ml kalacak şekilde pastör pipeti ile uzaklaştırıldı ve kalan çözeltide sediment çözülerek ölü nematodlar ve yumurtalar E.coli OP50 ekili NGM agara aktarıldı. 28 saat 25°C'de inkübe edilen nematodların L4 larval evreye ulaşması sağlandı26.
C.elegans modelinde patojenite deneyleri
Deneyde kullanılacak olan ve LB sıvı besiyerinde 37°C'de 18 saat üretilen Salmonella spp. suşlarının yoğunlukları saptandı (OD600 0.5-0.6) ve 10 µl NGM agara ekildi. 37°C'de 18 saat inkübasyondan sonra petrilerin 22°C'ye soğuması beklendi ve 20 adet L4 dönemindeki larva, her bir petriye (35 mm çaplı) stereomikroskop (Olympus, Japonya) altında 4X büyütmede, platin çengel uçlu bir aktarıcı yardımı ile aktarıldı. 24 saat aralıklarla canlı ve ölü nematodların sayıları belirlendi ve ölenler uzaklaştırıldı. Nematodlar deney süresinde 48 saat aralıkla yeni hazırlanmış besiyerine aktarıldı. Deney süresince, platin uç ile mikroskop altında nazik dokunma sonucu tepki vermeyen nematodlar ölü kabul edildi. Petri duvarı ile besiyeri arasına sıkışarak ölen nematodlar analizden çıkarıldı. Deneye tüm nematodlar ölene kadar devam edildi22.
İstatistiksel Analiz
Mortalite ve sağkalım, GraphPad Prism programı kullanılarak analiz edildi. Nematodların %50'sinin ölmesi için geçen zaman (TD50), programdaki Y= Bottom + [Top–Bottom]/[1 + 10(logEC50–X)(Hill slope)] denklemi kullanılarak hesaplandı. X değeri olarak zaman (gün) logaritması, Y değeri olarak o gün için canlı nematodların yüzdesi yazıldı. Maksimum değer 100, minimum değer ise 0 olarak sabitlendi. Belirlenen EC50 değeri ise TD50 olarak değerlendirildi. TD50 değerleri arasındaki farklılığın önemi, Student's t-testi (p< 0.05) ile analiz edildi.
BULGULAR
Çalışmada kullanılan 32 Salmonella izolatının 26'sının (%81.25) Infantis, 4'ünün (%12.5) Enteritidis, 1'er tanesinin de (%3.125) Telaviv ve Kentucky serotiplerine dahil olduğu saptanmıştır.
Antibiyotik duyarlılık testi sonuçları, izolatların dokuz farklı direnç fenotipine sahip olduğunu göstermiştir. Toplam 32 suştan 26'sının (%81.3) çoklu ilaç direnci (en az 3 antibiyotiğe direnç) gösterdiği tespit edilmiştir. Suşların 1'i (%3.1) gentamisine, 2'si (%6.2) siprofloksasine, 3'ü (%9.4) ampisiline, 18'i (%56.3) kanamisine, 19'u (%60.8) neomisine, 25'i (%78.1) tetrasikline, 25'i (%78.1) trimetoprime, 26'sı (%81.2) nalidiksik aside, 27'si (%84.4) streptomisine ve tümü (n= 32, %100) sülfonilamid bileşiklerine dirençli bulunmuştur. Bütün suşların kloramfenikol ve ampisilin/sulbaktama karşı duyarlı olduğu saptanmıştır. Kullanılan antibiyotikler içerisinde; streptomisin (256 μg/ml), nalidiksik asit (512 μg/ml), tetrasiklin (> 512 μg/ml), trimetoprim (> 512 μg/ml), sülfonilamid bileşikleri (> 512 μg/ml), kanamisin (> 512 μg/ml) ve neomisin (> 512 μg/ml) için yüksek düzeyde direnç belirlenmiştir.
Çalışılan 32 Salmonella suşunun 26'sının (%81.25) plazmid içermediği, 6'sının (%18.75) ise büyüklükleri 1.2 ile 42.4 kb arasında değişen 1-3 adet plazmid taşıdığı belirlenmiştir (Şekil 1).
C.elegans model sistemi kullanılarak gerçekleştirilen sağkalım analizlerinde hesaplanan TD50 (nematodların %50'sinin ölmesi için geçen gün) değerleri; pozitif kontrol olarak kullanılan S.Typhimurium ATCC 14028 suşu ile beslenen nematod grubu için 4.2 ± 0.5 gün, negatif kontrol olarak kullanılan E.coli OP50 suşu ile beslenen nematod grubu için ise 8.0 ± 0.02 gün olarak hesaplanmıştır. Çalışmada kullanılan diğer gıda kökenli Salmonella izolatları ile beslenen nematod grupları için ise TD50 değerleri 3.4-7.3 gün arasında belirlenmiştir (Tablo I, Şekil 2). Yapılan istatistiksel analizde, Infantis serotipine dahil 6 ve Enteritidis serotipine dahil 4 tane olmak üzere toplam 10 izolatın (%31.25) yer aldığı deney gruplarındaki TD50 değerleri ile daha önce bu model sisteminde patojenitesi belirlenmiş olan S.Typhimurium ATCC 14028 kontrol suşunun kullanıldığı deney grubundan elde edilen TD50 değerleri arasında anlamlı bir fark olduğu belirlenmiştir (p< 0.05). Bu izolatların C.elegans model sistemi için patojen olmadığı belirlenmiştir. Infantis, Kentucky ve Telaviv serotiplerine ait izolatları içeren diğer 22 izolatın (%67.75) dahil olduğu deney gruplarından elde edilen TD50 değerleri ile S.Typhimurium ATCC 14028 kontrol suşu ile elde edilen TD50 değerleri arasında ise anlamlı bir fark olmadığı tespit edilmiş (p< 0.05) ve bu gruba dahil olan izolatlar da C.elegans model sistemi için patojen olarak tanımlanmışlardır. Patojen olarak tanımlanan bu izolatlardan 20 tanesi (%90.9) çoklu ilaç direnci göstermektedir ve 3 tanesi büyüklükleri 1.2 ile 42.4 kb arasında değişen 1-3 adet plazmid taşımaktadır.
Çalışmada kullanılan izolatların dahil olduğu serotipler, antibiyotik direnç fenotipleri, taşıdıkları plazmid sayıları ve büyüklükleri ve C.elegans model sistemi kullanılarak gerçekleştirilen sağkalım analizleri sonucu hesaplanan TD50 verileri Tablo I'de gösterilmiştir.
TARTIŞMA
Mikrobiyal gıda güvenliği, dünya çapında giderek artan bir toplum sağlığı sorunu haline gelmekte ve kontamine gıdaların tüketimi de, insan salmonelloz olgularının ortaya çıkmasında büyük önem taşımaktadır8. C.elegans model sistemiyle gerçekleştirilen bu çalışmada elde edilen sonuçlar, gıda kökenli Salmonella izolatlarının potansiyel patojenitesini ortaya koyması ve antibiyotik direnç profillerinin belirlenmesi bakımından önem taşımaktadır.
Bu çalışmada tanımlanan gıda kökenli Salmonella izolatlarının; Infantis, Enteritidis, Kentucky ve Telaviv olmak üzere dört farklı serovara dahil oldukları tespit edilmiştir. Bu serovarlar, Töreci ve arkadaşlarının27 Türkiye Salmonella serovarlarını belirledikleri çalışmalarında yer alan 129 serovar içerisinde yer almaktadır. İzolatların büyük bir kısmını oluşturan Infantis serotipi (%81.25), birçok ülkede tavuk başta olmak üzere, kanatlı etlerinden izole edilen serotiplerin başında gelmektedir28,29. Türkiye'den 2004 ve 2010 yılları arasında yedi farklı şehirde faaliyet gösteren hastane ve halk sağlığı laboratuvarlarından gönderilen izolatlarla gerçekleştirilen çalışmada da, Infantis serovarı en yaygın izolatlar arasında ikinci sırada yer almaktadır30. İzolatlarının dahil olduğu Enteritidis (%12.5) ve Kentucky (%3.1) serotipleri de tavuk eti izolatlarında sıklıkla rastlanan serotipler olmalarına rağmen, Telaviv (%3.1) nadir rastlanan serotipler arasında yer almaktadır. Bu serovar, daha önce Türkiye'de satışa sunulan kıymalardan ve sığır karkaslarından izole edilmiştir31,32. 2008-2011 yılları arasında Hacettepe Üniversitesi Tıp Fakültesi Klinik Mikrobiyoloji Laboratuvarında izole edilen suşlar ile yapılan bir çalışmada, bir tane Telaviv serovarı tespit edilmiştir33. Çalışmamızda, Türkiye'de nadir rastlanan serovarlar arasında yer alan bu serovarın farklı bir kaynaktan izolasyonunun gerçekleştirilmiş olması ve patojenitesinin çalışılması önem taşımaktadır. Yapılan literatür taramasında, Edirne ilinde gıdalardan soyutlanan Salmonella izolatlarına ilişkin bir çalışmaya rastlanmamıştır. Bu bölgede, Edirne yakınlarındaki bir askeri birlikte meydana gelen gıda kaynaklı salgından ve sporadik olgulardan izole edilen Enteritidis izolatlarının da yer aldığı çalışmada, bu izolatların tamamının çalışmada kullanılan antibiyotiklere karşı duyarlı olduğu ve salgın izolatlarının aynı plazmid profiline sahip olduğu belirlenmiştir34,35. Bu çalışmada yer alan dört Enteritidis izolatı sadece sülfonamide karşı direnç gösterirken, kullanılan diğer antibiyotiklere duyarlıdır ve üçü, büyüklükleri 1.5-35.8 kb arasında değişen 1-3 plazmid taşımaktadır. Bu izolatların antibiyotik direnç profilleri, daha önceki çalışmalardaki izolatlar ile benzerlik gösterirken, plazmid profilleri arasında bir benzerliğe rastlanamamıştır.
Çalışmamızda yer alan gıda kökenli Salmonella izolatlarının tamamı, en az bir antibiyotiğe dirençlidir. Bu durum, antibiyotiklerin hayvanlarda büyümeyi hızlandırmak için yem katkısı olarak kullanılmasının yanı sıra, hayvan yetiştiriciliğinde ve veterinerlikte kullanımı nedeniyle çiftlik ve kümes hayvanlarındaki mikrobiyal popülasyonlarda antibiyotiğe dirençli varyantların ortaya çıkmasının bir sonucudur13. Çalışmadaki Salmonella izolatlarının tamamı 1937'den beri terapötik olarak kullanımda olan sülfonamide karşı dirençlidir. Sülfonamid direnci, ilk olarak 1930'ların sonunda rapor edilmiştir ve günümüzde de geçerliliğini korumaktadır36. İzolatlarımızda rastlanan sülfonamid direnci, bu duruma örnek olarak verilebilir. İzolatlarımızda yüksek oranda direnç gözlemlenen streptomisin (%84.4), tetrasiklin (%78.1) ve neomisin (%60.8) de, veterinerlikte sıklıkla kullanılan ilaç grupları arasında yer almaları nedeniyle Salmonella izolatlarında direncin rastlandığı başlıca antibiyotikler arasındadır37. Çalışmamızdaki izolatlarda ayrıca, yüksek oranda (%79) nalidiksik asit direnci bulunmuştur. Yapılan çalışmalar, florokinolonların veterinerlikte kullanımlarının Salmonella'da nalidiksik asit direncinin ortaya çıkmasında ve dirençli suşların hayvansal gıdalar yoluyla insana geçmesinde ve yayılmasında rol oynadığını ileri sürmektedir38. Florokinolonlar yetişkinlerde salmonellozların tedavisinde sıklıkla kullanılmaktadır. Nalidiksik aside dirençli suşlarla enfekte olmuş bireylerde, bu tedavi başarısızlıkla sonuçlanabilmektedir39. Bu durum, nalidiksik aside dirençli ve aynı zamanda C.elegans model sisteminde patojenite potansiyellerinin de yüksek olduğu belirlenen izolatların, halk sağlığı açısından önemini artırmaktadır. Elde edilen bir diğer önemli sonuç, Infantis ve Kentucky serotiplerine dahil iki izolatın (%6.25), tedavide de kullanılan florokinolon grubuna dahil siprofloksasine karşı dirençli olmalarıdır. Türkiye'de florokinolonlara karşı direnç henüz yüksek düzeylerde değildir40,41. Bu suşlar için, C.elegans model sisteminde belirlenen yüksek patojenite potansiyelleri (her bir deney grubu için TD50 verileri sırasıyla 4.7 ve 4.9 gün) önem arz etmektedir.
Çalışmada, gıda kökenli Salmonella izolatlarının patojenite potansiyelleri C.elegans model sistemi kullanılarak belirlenmiştir. Elde edilen veriler, gıda kökenli Salmonella izolatlarının birbirlerinden farklı patojenite özellikleri gösterdiğini ortaya koymaktadır. C.elegans, 1960'lı yıllardan bu yana genetik model organizma olarak kullanılmakla birlikte, Salmonella'yı da içeren birçok insan patojeni için model sistem olarak kullanılması 2000'li yıllarda başlamıştır22. C.elegans N2 atasal suşunu model sistem olarak kullandığımız bu çalışmada, izolatların bu model sistem üzerindeki patojeniteleri her bir deney grubundaki izolatlar için hesaplanan TD50 verileri ile belirlenmiştir. C.elegans, laboratuvar ortamında E.coli OP50 suşu ile beslendiği zaman 22°C'de yaklaşık olarak iki haftalık bir yaşam süresine sahiptir. S.Typhimurium ATCC 14028 suşunun bu sistemde patojen olduğu ve E.coli OP50 ile kıyaslandığında, nematodlarda çok daha kısa bir sürede mortalite görüldüğü belirlenmiştir22. Çalışmamızda, gıda kökenli izolatların bu model sisteminde patojeniteleri belirlenirken, bu iki suş kontrol grubu olarak kullanılmıştır. Elde ettiğimiz sonuçlara göre, Infantis serotipine dahil altı ve Enteritidis serotipine dahil dört adet olmak üzere toplam 10 izolatın (%31.25), bu model sistemi için patojen olmadığı belirlenirken, Infantis, Kentucky ve Telaviv serotiplerine ait suşları içeren diğer 22 izolatın (%67.75) patojen olduğu görülmüştür. Daha önce yurtdışında yapılan çalışmalarda, farklı Salmonella serovarlarının bu model sisteminde farklı patojenite gösterdiği belirlenmiştir42,43. Çalışmamızda izolatların, antibiyotik direnç fenotipleri, plazmid profilleri ve C.elegans model sisteminde hesaplanan TD50 verileri arasında bir korelasyona rastlanmamıştır. Çalışmamızda patojen olarak tanımladığımız bu izolatlardan 20'si (%90.9) çoklu ilaç direnci göstermektedir. Bu izolatların, tüketime sunulan gıdalardan izole edilmiş olmaları, gıda güvenliği ve kontamine gıdaların tüketimi ile insanlarda ortaya çıkabilecek enfeksiyonlar açısından potansiyel tehlike olduğunu göstermektedir. Çalışmamızda C.elegans model sisteminde elde edilen sonuçlar, başka hayvan modeli sistemleri ile ve hastalardan izole edilen Salmonella suşlarından elde edilecek verilerle de karşılaştırılarak, Salmonella izolatlarının patojenite potansiyellerinin belirlenmesinde hızlı ve kolay bir yöntem olarak kullanılabilir. Bu çalışmada, yeni bir enfeksiyon modeli olarak nematodlar, mikroorganizmaların patojenitesinin incelenmesinde Türkiye'de ilk kez kullanılmıştır.
Çalışmamızın sonuçları, Türkiye'de mikrobiyal gıda güvenliğinin önemini ve antibiyotiklerin tıbbi kullanımlarının yanı sıra hayvan yetiştiriciliğinde ve veterinerlikte kullanımlarının da kontrol altında tutulmasının gerekliliğini ortaya koymaktadır. Bu çalışma, yeni bir enfeksiyon modeli sayesinde çevresel ve gıda kökenli suşların patojenik potansiyellerinin incelenmesi çalışmalarına pratik bir alternatif sağlaması bakımından önem taşımaktadır ve Salmonella izolatlarının in vivo patojenite determinantları çalışmalarına katkıda bulunacağı düşünülmektedir.
KAYNAKLAR
- World Health Organization. Salmonella (non-typhoidal) 2013. WHO, Geneva. Available at: http://www.who.int/mediacentre/factsheets/fs139/en/
- Hur J, Jawale C, Lee JH. Antimicrobial resistance of Salmonella isolated from food animals: a review. Food Res Int 2012; 45(2): 819-30.
- Hoelzer K, Moreno AI, Wiedmann M. Animal contact as a source of human non-typhoidal salmonellosis. Vet Res 2011; 42(34): 1-28.
- Antues P, Reu C, Sousa JC, Pexie L, Pestana N. Incidence of Salmonella from poultry products and their susceptibility to animal agents. Int J Food Microbiol 2003; 82(2): 97-103.
- Zhao C, Ge B, De Villena J, et al. Prevalence of Campylobacter spp., Escherichia coli, and Salmonella serovars in retail chicken, turkey, pork, and beef from the Greater Washington, D.C., area. Appl Environ Microbiol 2001; 67(12): 5431-6.
- Greig JD, Ravel A. Analysis of foodborne outbreak data reported internationally for source attribution. Int J Food Microbiol 2009; 130(2): 77-87.
- Panisello PJ, Rooney R, Quantick PC, Stanwell-Smith R. Application of foodborne disease outbreak data in the development and maintenance of HACCP systems. Int J Food Microbiol 2000; 59(3): 221-34.
- Foley SL, Lynne AM. Food animal-associated Salmonella challenges: pathogenicity and antimicrobial resistance. J Anim Sci 2008; 86(14 Suppl): E173-87.
- Schwarz S, Kehrenberg C, Walsh TR. Use of antimicrobial agents in veterinary medicine and food animal production. Int J Antimicrob Agents 2001; 17(6): 431-7.
- Glenn LM, Lindsey RL, Folster JP, et al. Antimicrobial resistance genes in multidrug-resistant Salmonella enterica isolated from animals, retail meats, and humans in the United States and Canada. Microb Drug Resist 2013; 19(3): 175-84.
- Carattoli A. Plasmid-mediated antimicrobial resistance in Salmonella enterica. Curr Issues Mol Biol 2003; 5(4): 113-22.
- Martin LJ, Fyfe M, Doré K, et al; Multi-Provincial Salmonella Typhimurium Case-Control Study Steering Committee. Increased burden of illness associated with antimicrobial-resistant Salmonella enterica serotype Typhimurium infections. J Infect Dis 2004; 189(3): 377-84.
- Tollefson L, Karp BE. Human health impact from antimicrobial use in food animals. Med Mal Infect 2004; 34(11): 514-21.
- Foley SL, Lynne AM, Nayak R. Molecular typing methodologies for microbial source tracking and epidemiological investigations of Gram-negative bacterial foodborne pathogens. Infect Genet Evol 2009; 9(4): 430-40.
- Tsolis RM, Xavier MN, Santos RL, Baumler AJ. How to become a top model: impact of animal experimentation on human Salmonella disease research. Infect Immun 2011; 79(5): 1806-14.
- Kurz CL, Ewbank JJ. Caenorhabditis elegans for the study of host–pathogen interactions. Trends Microbiol 2000; 8(3): 142-4.
- Brenner S. The genetics of Caenorhabditis elegans. Genetics 1974; 77(1): 71-94.
- Garsin DA, Sifri CD, Mylonakis E, et al. A simple model host for identifying Gram-positive virulence factors. Proc Natl Acad Sci USA 2001; 98(19): 10892-7.
- Tan MW, Majahan-Miklos S, Ausubel FM. Killing of Caenorhabditis elegans by Pseudomonas aeruginosa used to model mammalian bacterial pathogenesis. Proc Natl Acad Sci USA 1999; 96(2): 715-20.
- Aballay A, Yorgey P, Ausubel FM. Salmonella typhimurium proliferates and establishes a persistent infection in the intestine of Caenorhabditis elegans. Curr Biol 2000; 10(23): 1539-42.
- Kurz CL, Ewbank JJ. Caenorhabditis elegans: an emerging genetic model for the study of innate immunity. Nat Rev Genet 2003; 4(5): 380-90.
- Labrousse A, Chauvet S, Couillault C, Kurz CL, Ewbank JJ. Caenorhabditis elegans is a model host for Salmonella typhimurium. Curr Biol 2000; 10(23): 1543-5.
- Kado CI, Liu ST. Rapid procedure for detection and isolation of large and small plasmids. J Bacteriol 1981; 145(3): 1365-73.
- Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. Twenty-First Informational Supplement, M100-S21, 2011. CLSI, Wayne, PA.
- Wiegand I, Hilpert K, Hancock RE. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nat Protoc 2008; 3(2): 163-75.
- Ikeda T, Yasui C, Hoshino K, Arikawa K, Nishikawa Y. Influence of lactic acid bacteria on longevity of Caenorhabditis elegans and host defense against Salmonella enterica serovar Enteritidis. Appl Environ Microbiol 2007; 73(20): 6404-9.
- Töreci K, Erdem B, Öngen B. Türkiye'de 2011 yılı sonuna kadar izolasyonu bildirilen Salmonella Serovarları. Mikrobiyol Bul 2013; 47(3): 442-60.
- Velhner M, Kozoderovi G, Grego E, et al. Clonal spread of Salmonella enterica serovar Infantis in Serbia: acquisition of mutations in the topoisomerase genes gyrA and parC leads to ıncreased resistance to fluoroquinolones. Zoonoses Public Health 2014; 61(5): 364-70.
- Hauser E, Tietze E, Helmuth R, et. al. Clonal dissemination of Salmonella enterica serovar Infantis in Germany. Foodborne Pathog Dis 2012; 9(4): 352-60.
- Ozdemir K, Acar S. Plasmid profile and pulsed-field gel electrophoresis analysis of Salmonella enterica isolates from humans in Turkey. PLoS One 2014; 9(5): e95976.
- Erol İ. Ankara'da tüketime sunulan kıymalarda Salmonella'ların varlığı ve serotip dağılımı. Turk J Vet Anim Sci 1999; 23(4): 321-5.
- Küplülü Ö. Sığır karkaslarında Salmonella kontaminasyonu ve serotip dağılımı. Ankara Üniv Vet Fak Derg 1999; 46(1): 25-34.
- Gülmez D, Gür D, Hasçelik G, Güleşen R, Levent B. Ulusal Enterik Patojenler Laboratuvar Sürveyans Ağına (UEPLA) dahil olan bir üniversite hastanesinin deneyimleri: Dört yıllık Salmonella, Shigella ve Campylobacter Verileri. Türk Mikrobiyol Cem Derg 2012; 42(3): 85-92.
- Erdem B, Ercis S, Hascelik G, Gur D, Aysev AD. Antimicrobial resistance of Salmonella enterica group C strains isolated from humans in Turkey, 2000-2002. Int J Antimicrob Agents 2005; 26(1): 33-7.
- Us E, Erdem B, Tekeli A, et al. Investigation of Salmonella serotype Enteritidis isolates by plasmid profile analysis and pulsed field gel electrophoresis. Mikrobiyol Bul 2011; 45(2): 210-27.
- Davies J, Davies D. Origins and evolution of antibiotic resistance. Microbiol Mol Biol Rev 2010; 74(3): 417-33.
- McEwen SA, Fedorka-Cray PJ. Antimicrobial use and resistance in animals. Clin Infect Dis 2002; 34(3): 93-106.
- Angulo FJ, Nargund VN, Chiller TC. Evidence of an association between use of anti-microbial agents in food animals and anti-microbial resistance among bacteria ısolated from humans and the human health consequences of such resistance. J Vet Med B Infect Dis Vet Public Health 2004; 51(8-9): 374-9.
- Stevenson JE, Gay K, Barrett TJ, Medalla F, Chiller TM, Angulo FJ. Increase in nalidixic acid resistance among non-typhi Salmonella enterica isolates in the United States from 1996 to 2003. Antimicrob Agents Chemother 2007; 51(1): 195-7.
- Albayrak F, Cokca F, Erdem B, Aysev AD. Predictive value of nalidixic acid resistance for detecting salmonellae with decreased ciprofloxacin susceptibility. Int J Antimicrob Agents 2004; 23(4): 332-6.
- Ercis S, Erdem B, Hasçelik G, Gür D. Nalidixic acid resistance in Salmonella strains with decreased susceptibility to ciprofloxacin isolated from humans in Turkey. Jpn J Infect Dis 2006; 59(2): 117-9.
- Chai-Hoon K, Jiun-Horng S, Shiran MS, et al. Caenorhabditis elegans-based analysis of Salmonella enterica. Int Food Res J 2010; 17(4): 845-52.
- Hoffmann M, Zhao S, Pettengill J, et al. Comparative genomic analysis and virulence differences in closely related Salmonella enterica serotype Heidelberg ısolates from humans, retail meats, and animals. Genome Biol Evol 2014; 6(5): 1046-68.
İletişim (Correspondence):
Prof. Dr. Ece Şen,
Trakya Üniversitesi Fen Fakültesi,
Biyoloji Bölümü, Temel ve Endüstriyel
Mikrobiyoloji Anabilim Dalı, Balkan Yerleşkesi,
22030, Edirne, Türkiye.
Tel (Phone): +90 284 236 3771,
E-posta (E-mail): ecesen@trakya.edu.tr