Entamoeba
histolytica'nın Tanısında Direkt Mikroskopi, Kültür, ELISA ve
Moleküler Yöntemlerin Karşılaştırılması*
Comparison
of Direct Microscopy, Culture, ELISA and Molecular Methods for the
Diagnosis of Entamoeba histolytica
Nazmiye Ülkü TÜZEMEN1, Nihal DOĞAN2
1 Çankırı Devlet Hastanesi, Tıbbi Mikrobiyoloji Laboratuvarı, Çankırı.
1 Cankiri State Hospital, Medical Microbiology Laboratory, Cankiri, Turkey.
2 Osmangazi Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Eskişehir.
2 Osmangazi University Faculty of Medicine, Department of Medical Microbiology, Eskisehir, Turkey.
* Bu çalışma, Eskişehir Osmangazi Üniversitesi Bilimsel Araştırma Birimi tarafından desteklenmiştir (Proje no: 201111021; 27.05.2011).
ÖZET
Amebiyazis, Entamoeba histolytica'nın neden olduğu tüm dünyada yaygın olarak görülen bir parazit enfeksiyonudur. Gelişmekte olan ülkeler için halen önemli bir halk sağlığı sorunu olan amebiyazisin kısa zamanda ayırıcı tanısının yapılması tedavi açısından önem taşımaktadır. Tanıda en sık kullanılan yöntem direkt mikroskopi olmakla birlikte, patojen olmayan Entamoeba dispar ile ayırımının yapılamaması, etkenin saptanmasına yönelik daha güvenilir yöntemlerin kullanımını gündeme getirmiştir. Bu çalışmada, E.histolyticanın saptanmasında direkt mikroskopi, kültür, ELISA ve PCR yöntemleri ile alınan sonuçların karşılaştırılması ve yöntemlerin performanslarının değerlendirilmesi amaçlanmıştır. Çalışmaya, Ocak 2011-Mart 2013 tarihleri arasında hastaneye ishal yakınması ile başvuran çocuk ve erişkin hastalar ile tarama amacıyla ilköğretim okullarının öğrencilerinden rastgele alınan toplam 1049 örnek dahil edilmiştir. Direkt mikroskopik inceleme, lugol, serum fizy olojik, modifiye formol-etil asetat sedimentasyon ve trikrom boyama yöntemleri ile yapılmış; kültür için örnekler TYI-S-33 aksenik besiyerine ekilmiştir. Dışkı örneklerinde amip antijeni varlığı ticari bir ELISA kiti (TechLab, E.histolytica II, ABD) ile araştırılmıştır. Moleküler tanı için, QIAamp DNA Stool Mini Kit (Qiagen, ABD) ile DNA ekstraksiyonu yapıldıktan sonra, multipleks tandem gerçek zamanlı PCR (MT-PCR) yöntemi (AusDiagnostics Pty Ltd, Avustralya) uygulanmıştır. Çalışmamızda, tüm yöntemlerin uygulanabildiği 354 olguya ait örnek değerlendirmeye alınmış; bunların 84 (%23.7)'ünde direkt mikroskopi, 61 (%17.2)'inde trikrom boyama, 46 (%12.9)'sında kültür, 31 (%8.7)'inde ELISA ve 9 (%2.5)'unda PCR ile pozitiflik saptanmıştır. Direkt mikroskopide şüpheli amip kist/trofozoitleri görülen örneklerden; %54.7 (46/84)'si trikrom boyama, %39.3 (33/84)'ü kültür, %15.5 (13/84)'i ELISA ve %7.1 (6/84)'i PCR ile pozitif olarak saptanmıştır. Diğer taraftan MT-PCR ile E.histolytica pozitif bulunan dokuz örnekten altısı direkt mikroskopi, dördü trikrom boyama ve kültür, biri ise ELISA yöntemiyle pozitif bulunmuş; uygulanan tüm yöntemler ile pozitif sonuç veren sadece tek bir örneğin olduğu (%0.3) dikkati çekmiştir. Moleküler yöntem referans olarak kabul edildiğinde, direkt mikroskopi, trikrom boyama, kültür ve ELISA yöntemlerinin duyarlılık ve özgüllük değerleri sırasıyla; %66.7 ve %77.4, %44.4 ve %83.5, %44.4 ve %87.8, %11.1 ve %91.3 olarak hesaplanmıştır. Sonuç olarak, amebiyazisli hastaların laboratuvar tanısında, yöntemlerin mümkün olabildiğince kombine olarak kullanılması ve klinik bulgular ile birlikte değerlendirilmesinin en uygun yaklaşım olacağı kanısına varılmıştır.
Anahtar sözcükler: Entamoeba histolytica; tanı; direkt mikroskopi; kültür; ELISA; multipleks tandem PCR.
ABSTRACT
Amebiasis, a parasitic infection caused by Entamoeba histolytica, is one of the most common parasitic infections worldwide. Since it is still an important public health problem in developing countries, rapid differential diagnosis of amebiasis is crucial in terms of treatment. The most frequently used method for laboratory diagnosis is direct microscopy, however more reliable and specific methods are needed in order to differentiate the apathogenic Entamoeba dispar under the microscope. This study was conducted to compare the results of different methods namely, direct microscopy, culture, ELISA and PCR for the detection of E.histolytica in stool samples and to evaluate the performances of those methods. A total of 1049 stool samples collected from pediatric and adult patients who were admitted to hospital with diarrhea complaint between January 2011-March 2013, and randomly selected samples from primary school children, were included in the study. Direct microscopic examination was performed by native-lugol, physiological saline, modified formol-ethyl acetate sedimentation and trichrome staining methods. The stool samples were also inoculated into TYI-S-33 media for axenic cultivation of amoeba. The presence of amebic antigens in the samples were screened by a commercial ELISA kit (TechLab, E.histolytica II, USA). For the molecular diagnosis, a multiplex tandem real-time PCR (MT-PCR) kit (AusDiagnostics Pty Ltd, Australia) was used, after the extraction of DNAs with QIAamp DNA Stool Mini Kit (Qiagen, USA). A total of 354 samples which could be evaluated by all of the methods, were included in the study. Of the 354 stool samples, 84 (23.7%) were found E.histolytica/E.dispar positive by direct microscopy, 61 (17.2%) by trichrome staining, 46 (12.9%) by culture, 31 (8.7%) by ELISA and 9 (2.5%) by MT-PCR. Of direct microscopy positive samples 54.7% (46/84) were also positive with trichrome staining, 39.3% (33/84) with culture, 15.5% (13/84) with ELISA and 7.1% (6/84) with MT-PCR methods. On the other hand, of the nine MT-PCR positive samples, six were positive with direct microscopy, four with trichrome staining and culture, and one with ELISA. It was remarkable that only one (0.3%) sample yielded positive results with all of the diagnostic methods used. When MT-PCR was considered as the reference method, the sensitivity and specificity values of direct microscopy, trichrome staining, culture and ELISA methods were estimated as; 66.7% and 77.4%, 44.4% and 83.5%, 44.4% and 87.8%, 11.1% and 91.3%, respectively. In conclusion, if the circumstances allow, the use of all methods in combination and evaluation together with the clinical symptoms seems to be the best approaches for the laboratory diagnosis of patients with amebiasis.
Key words: Entamoeba histolytica; diagnosis; direct microscopy; culture; ELISA; multiplex tandem PCR.
Geliş Tarihi (Received): 18.09.2013 • Kabul Ediliş Tarihi (Accepted): 11.12.2013
GİRİŞ
Amebiyazis, Entamoeba histolytica'nın neden olduğu, tüm dünyada yaygın olarak görülen bir parazit enfeksiyonudur. Enfekte kişilerin dışkısıyla atılan dört çekirdekli kistler ile kontamine su ve gıdaların alınması ile bulaşan E.histolytica, bağırsak ve bağırsak dışı olarak iki farklı patoloji ile seyreden enfeksiyonlara neden olmaktadır1. Ülkemizdeki amip prevalansının ortalama %0.4-18.4 arasında olduğu ve Güney/Güneydoğu Anadolu bölgelerinde endemik olarak görüldüğü ifade edilmektedir2.
Tanıda en sık kullanılan yöntem direkt mikroskopi olmakla birlikte, patojen olmayan Entamoeba türlerinin neden olduğu yanılgılar, etkenin saptanmasına yönelik daha güvenilir yöntemlerin arayışına yol açmıştır3. Bu amaçla trikrom boyama ve kültür gibi yöntemlerin yanı sıra, ELISA ile dışkıda amip antijeni aranması ve polimeraz zincir reaksiyonu (PCR) gibi yöntemlerin, direkt mikroskopik bakı ile birlikte uygulanmasının tanıya önemli katkılar sağlayabileceği ileri sürülmüştür3,4. Bu çalışmada, E.histolyticanın saptanmasında direkt mikroskopi, kültür, ELISA ve polimeraz zincir reaksiyonu (PCR) yöntemleriyle alınan sonuçların karşılaştırılması ve yöntemlerin performanslarının değerlendirilmesi amaçlanmıştır.
GEREÇ ve YÖNTEM
Çalışmaya, 01.01.2011-29.03.2013 tarihleri arasında Eskişehir Osmangazi Üniversitesi Hastanesi ve Eskişehir Devlet Hastanesine ishal şikayetiyle başvuran çocuk ve erişkin hastaların dışkı örnekleri ile tarama amacıyla Eskişehir bölgesinde rastgele seçilen ilköğretim okullarındaki öğrencilerden -resmi izinler ve ailelerinin izniyle- alınan dışkı örnekleri olmak üzere toplam 1049 örnek dahil edildi.
Örneklerin tamamı mümkün olan en kısa sürede laboratuvara ulaştırıldı ve tüm işlemler biyogüvenlik kabini içerisinde yapıldı. Her örnek öncelikle kan-mukus varlığı yönünden makroskobik olarak incelendi. Direkt mikroskopi ve kültür yöntemleri taze dışkı örnekleri ile çalışıldı. Daha sonra örnekler ELISA ile antijen saptama ve moleküler yöntemlerde kullanılmak üzere fiksatif konmadan üç farklı ependorf tüpüne bölünerek -70ºC'de saklandı.
Mikroskopik Yöntemler
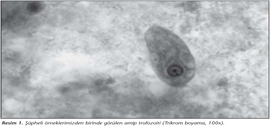
Dışkı örnekleri (n= 1049) öncelikle nativ-lugol ve serum fizyolojik (SF) yöntemiyle hazırlanıp preparatlar x10 ve x40 büyütmede incelendi3. Daha sonra örnekler, modifiye formol-etil asetat sedimentasyon yöntemiyle hazırlanıp mikroskopik incelemeleri yapıldı. Ayrıca, dışkı sedimentinden hazırlanan yayma preparatlar trikrom boyasıyla boyanarak immersiyon objektifinde incelendi3 (Resim 1).
Kültür Yöntemi
Tüm örnekler (n= 1049) TYI-S-33 aksenik besiyerine ekildi. Hazırlandıktan sonra 4ºC'de karanlıkta bekletilen taze besiyerleri, 35ºC'de 1-2 saat inkübasyona bırakılarak kontrolleri yapıldı. Ekim için dışkının varsa mukuslu ve kanlı kısımlarından örnek alınıp 35ºC'de 48 saat inkübe edildi. İnkübasyon sonrası kültürden pastör pipetiyle temiz bir lama ince tabaka halinde yayılıp, tam kurumadan trikrom boyama yapıldı. Boyanan örnekler 100x objektif ile incelendi. Üreme olmayan örnekler, üç kez daha taze besiyerine pasajlanıp 48 saat bekletilip tekrar değerlendirildikten sonra negatif olarak değerlendirildi.
ELISA ile Antijen Tespiti
Direkt mikroskopi ve kültür sonucunda şüpheli kist ve trofozoiti bulunan örnekler ile ishal nedeniyle gönderilen şüpheli örneklere (n= 360) ELISA testi uygulandı. Bu amaçla, çukurlarında E.histolytica/dispar adezin antijenine karşı monoklonal antikorların bulunduğu ticari ELISA kiti (TechLab, T5017 E.HISTOLYTICA II, Blacksburg, ABD) kullanıldı ve yöntem üretici firmanın önerilerine göre uygulandı.
Multipleks Gerçek Zamanlı PCR
Moleküler çalışmaya, elimizdeki kit sayısının sınırlı olması nedeniyle, direkt mikroskopi ve kültür yöntemleri ile kist/trofozoit varlığı saptanan örnekler ile rastgele seçilen parazit bulunmayan örnekler (n= 450) alındı. Örneklerden DNA ekstraksiyonu, QIAamp DNA Stool Mini Kit (Qiagen, ABD) kullanılarak üretici firmanın önerileri doğrultusunda yapıldı. Ekstrakte edilen örnekler çalışılıncaya kadar -20ºC'de saklandı.
Multipleks gerçek zamanlı PCR yöntemi, E.histolytica için peroksiredoksin (prx) gen bölgesinin hedeflendiği "Multiplex Tandem Real-Time PCR Kit" [Gastrointestinal Parasites-5 (Cryptosporidium spp., Dientamoeba fragilis, Entamoeba histolytica, Giardia intestinalis); AusDiagnostics Pty Ltd, Avustralya] kullanılarak, Easy-Plex (AusDiagnostics Pty Ltd, Avustralya) otomatize sisteminde gerçekleştirildi. Uygulama sırasında internal kontrolleri çalışmayan 23 örnek değerlendirme dışında bırakıldı.
İstatistiksel Analiz
Tüm veriler SPSS 15.0 programına girilerek yöntemler birbirleriyle karşılaştırıldı ve dağılım yüzde olarak tanımlandı.
BULGULAR
Çalışmamızda, toplam 1049 dışkı örneği direkt mikroskopi, trikrom boyama ve kültür yöntemleri ile incelenmiş; ancak bunlardan, tüm yöntemlerin uygulanabildiği 354 hasta örneği (kadın/erkek oranı: 1) değerlendirmeye alınmıştır. Değerlendirilen 354 dışkı örneğinin %23.7'sinde direkt mikroskopi, %17.2'sinde trikrom boyama, %12.9'unda kültür, %8.7'sinde ELISA ve %2.5'inde PCR ile pozitiflik saptanmıştır (Tablo I).
Direkt mikroskopi ile pozitif bulunan 84 örneğin 46'sı trikrom boyama, 33'ü kültür, 13'ü ELISA ve 6'sı moleküler yöntemle pozitif olarak saptanan örneklerdir (Tablo II). Direkt mikroskopik incelemede ayrıca toplam 125 örnekte diğer parazitlere [Blastocystis hominis (n= 64, %18.2), Giardia intestinalis (n= 18, %5.1), Entamoeba coli (n= 18, %5.1), Enterobius vermicularis (n= 12, %3.4), Ascaris lumbricoides (n= 6, %1.7), Endolimax nana (n= 5, %1.4), Strongyloides stercoralis (n= 1, %0.3), Pentatrichomonas hominis (n= 1, %0.3)] ait kist/yumurta varlığı tespit edilmiştir.
Trikrom boyama ile E.histolytica/E.dispar 61 (%17.2) örnekte tespit edilmiş; bunların 46'sının direkt mikroskopi, 38'inin kültür, 12'sinin ELISA ve 4'ünün PCR ile pozitif sonuç verdiği izlenmiştir (Tablo II).
Multipleks PCR ile 354 örnekten, 5 (%1.4)'inde E.histolytica, 64 (%18)'ünde D.fragilis, 7 (%2)'sinde G.intestinalis ve 2 (%0.6)'sinde Cryptosporidium spp. tek başlarına pozitif bulunurken, 4 (%1.1) örnekte E.histolytica + D.fragilis, 5 (%1.4) örnekte ise D.fragilis + G.intestinalis birlikteliği saptanmıştır. Buna göre PCR yöntemi ile 9 örneğin E.histolytica pozitif olduğu belirlenmiş; bunlardan 6'sının direkt mikroskopi, 4'ünün trikrom boyama ve kültür, 1'inin ise ELISA yöntemiyle pozitif sonuç veren örnekler olduğu izlenmiştir (Tablo II).
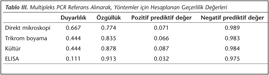
Çalışmamızda değerlendirilen tüm yöntemler ile E.histolytica pozitif olarak saptanan örnek sayısı 1 (%0.3) olarak saptanmıştır. Moleküler yöntem referans olarak kabul edildiğinde, direkt mikroskopi, trikrom boyama, kültür ve ELISA yöntemlerinin duyarlılık, özgüllük, pozitif ve negatif prediktif değerleri Tablo III'te gösterilmiştir.
TARTIŞMA
Amebiyazis, dünyada en yaygın görülen paraziter hastalıklardan birisidir. Tropik ve subtropik bölgelerde oranı %50-80'lere ulaşabilen hastalığın dünya nüfusuna oranı %10 civarındadır1,2. Olguların %90'ı belirtisiz olarak seyreder3. Okul, kreş, hastane, cezaevleri gibi toplu halde yaşanan yerlerde daha sıklıkla ve salgınlar halinde görülmektedir. Dünyada her yıl 500 milyon kişinin E.histolytica ve ona mikroskobik olarak benzeyen E.dispar ile enfekte olduğu, bunların önemli bir miktarının kolit veya karaciğer apsesine yakalandığı ve 40-100 bin kadarının öldüğü tahmin edilmektedir3.
Ülkemizin değişik bölgelerinde son altı yıl içinde yapılan çeşitli çalışmalarda, E.histolytica/E.dispar prevalansının %0.2 ile %45.9 arasında değişen oranlarda bildirildiği görülmektedir5,6,7,8,9,10,11,12,13,14,15,16,17,18. Bizim çalışmamızda ise bu oran -PCR sonucu dikkate alındığında- %2.5 (9/354) olarak bulunmuştur. Bölgeler arasında saptanan oranlardaki farklılıkların, başta sosyoekonomik durum ve eğitim düzeyi olmak üzere, çalışmalarda kullanılan yöntemlerin farklı olması ve farklı grupların seçiminden kaynaklandığı düşünülmektedir.
E.histolytica tanısında PCR yöntemi, 1990'lı yılların başında kullanıma girmiş; 1991 yılında ise tek gen amplifikasyonu ile E.histolytica ve E.dispar ayrımı yapılmıştır3. Daha sonraları E.histolytica tanısında gerçek zamanlı PCR ve multipleks gerçek zamanlı PCR da kullanılmaya başlanmıştır. PCR, klinik ve epidemiyolojik çalışmalar için DSÖ tarafından temel tanı yöntemlerinden biri olarak kabul edilmektedir19. Zira geleneksel mikroskopi yönteminin duyarlılığı ve seçiciliği, son zamanlarda önemli bir problem olarak karşımıza çıkmaktadır. Dışkıda makrofajlar veya E.dispar ve E.moshkovskii gibi patojen olmayan türlerin bulunması yanlış pozitifliklere neden olmakta; direkt mikroskopinin duyarlılığı en iyi koşullarda %10-60 arasında değişmektedir3,20,21. Tuncay ve arkadaşları4, saptadıkları 41 E.histolytica/E.dispar olgusundan ancak 25'ini mikroskopik inceleme ile tanımlayabilmişlerdir. Dağcı ve arkadaşları22 da, mikroskopik inceleme ile E.histolytica/E.dispar kist/trofozoiti saptanan yedi dışkı örneğini PCR yöntemi ile değerlendirmişler ve tümünün E.dispar olduğunu bildirmişlerdir. Bizim çalışmamızda direkt mikroskopinin duyarlılığı %66.7 olarak bulunmuştur (Tablo III). Dolayısıyla mikroskopik inceleme E.histolytica tanısında yetersiz kalmakta ve duyarlılık ve özgüllüğü yüksek gelişmiş tanı yöntemlerine gereksinim duyulmaktadır23.
Günümüzde her ne kadar, amebiyazis tanısı için moleküler yöntemlerin kullanılması öneriliyorsa da, dışkıda bulunan inhibitör maddeler ve dışkıdan DNA ekstraksiyonunun zor olması moleküler yöntemler için bir dezavantaj oluşturmaktadır. Ayrıca, ekstraksiyonun yapılacağı dışkı örneğinde parazit yükünün düşük olması da yalancı negatif sonuçlar oluşturmaktadır. Pınar ve arkadaşlarının24, dışkı örneklerinden duyarlı bir DNA saflaştırma protokolü geliştirme ile ilgili yaptıkları çalışmada, "QIAamp DNA Stool Minikit" (Qiagen, Almanya) protokolü uyarlanarak, bir gece boyunca proteinaz K ve sodyum dodesil sülfat (SDS) inkübasyonu eklenmiştir. Araştırıcılar, üç farklı DNA saflaştırma protokolünün (özgün yöntem, setiltrimetil amonyum bromür yöntemi, uyarlanmış yöntem) duyarlılık üzerine etkinliğini, gerçek zamanlı kantitatif PCR sisteminde (Artus RealArtTM E.histolytica RG PCR Kit, Qiagen, Almanya) değerlendirmişler ve en duyarlı yöntemin uyarlanmış yöntem olduğunu bildirmişlerdir24. Bizim çalışmamızda ise özgün yöntem kullanılmıştır1.
Stark ve arkadaşları25, PCR yöntemi ile antijen saptama kitlerini (Entamoeba CELISA PATH ve TechLab E.histolytica II kit) karşılaştırmışlar; PCR yöntemi referans kabul edildiğinde CELISA PATH kitinin duyarlılığını %28, özgüllüğünü %100 olarak belirlemişlerdir. Araştırıcılar, TechLab E.histolytica II kitini PCR ile karşılaştırdıklarında, diğer Entamoeba türleriyle çapraz reaksiyon vermesi nedeniyle yalancı pozitif reaksiyonların olduğunu bildirmişler; ELISA kitlerinin PCR yöntemine kıyasla 1000-10.000 kat daha az duyarlı olduğunu ve endemik olmayan bölgelerde kullanılmasının uygun olmadığını ifade etmişlerdir25. Bizim bölgemiz endemik olmayan bir bölge olup, çalışmamızda kullanılan TechLab E.histolytica II kitinin duyarlılığı %11.1 olarak saptanmıştır. Zeyrek ve arkadaşlarının26 çalışmasında, direkt mikroskopi ile şüpheli bulunan 87 dışkı örneğinin %21.7'sinde ELISA ile, %26.4'ünde ise trikrom boyama yöntemi ile E.histolytica/E.dispar pozitifliği tespit edilmiştir. Bu araştırıcılar, E.histolytica/E.dispar sıklığını trikrom boyama ile %1.4 (23/1600), ELISA yöntemiyle %1.2 (19/1600) olarak bildirmişlerdir26. Tanyüksel ve arkadaşlarının27 yaptığı çalışmada da, ülkemizin endemik bölgesi olan Van ve Şanlıurfa'da 380 dışkı örneği direkt mikroskopi ve ELISA (TechLab E.histolytica II) yöntemi ile araştırılmış; örneklerin %24'ü trikrom boyama, %13'ü ELISA ile pozitif bulunmuş, mikroskopi ile pozitif bulunan 91 örneğin 14 (%15)'ü ELISA ile pozitif sonuç vermiştir. Bizim çalışmamızda, direkt mikroskopi ile olası pozitif bulunan 84 dışkının 13 (%15.4)'ünde ELISA ile E.histolytica/E.dispar antijen pozitifliği bulunurken, 46 (%54.7)'sında trikrom boyama yöntemiyle E.histolytica/E.dispar kompleksi pozitif olarak saptanmıştır. Buna göre, E.histolytica/E.dispar sıklığı trikrom boyama ile %17.2 (61/354), ELISA yöntemiyle %8.7 (31/354) olarak belirlenmiştir.
Stark ve arkadaşlarının28, bizim çalışmamızda kullandığımız multipleks tandem PCR (MT-PCR) kiti ile yaptıkları çalışmada, MT-PCR ile gerçek zamanlı PCR arasında %100 uyum olduğu; her iki yöntemin de duyarlılık ve özgüllüğünün %100 olduğu belirlenmiştir. Bu araştırıcılar, ishalli hastalara ait 472 dışkı örneğinin 28'inde G.intestinalis, 26'sında D.fragilis, 11'inde E.histolytica ve dokuzunda Cryptosporidium spp. tespit etmişlerdir28. Bizim çalışmamızda da, MT-PCR ile 354 örneğin yedisinde G.intestinalis, 64'ünde D.fragilis, beşinde E.histolytica, ikisinde Cryptosporidium spp., dördünde E.histolytica + D.fragilis ve beşinde G.intestinalis + D.fragilis saptanmış; E.histolytica sıklığı %2.5 (9/354) olarak izlenmiştir. MT-PCR pozitif örneklerden altısı direkt mikroskopi, dördü trikrom boyama ve kültür, biri ise ELISA yöntemiyle pozitif bulunmuş; uygulanan tüm yöntemler ile pozitif sonuç veren sadece tek bir örneğin olduğu (%0.3) dikkati çekmiştir. Sonuç olarak, amebiyazisli hastaların laboratuvar tanısında, yöntemlerin mümkün olabildiğince kombine olarak kullanılması ve klinik bulgular ile birlikte değerlendirilmesinin en uygun yaklaşım olacağı kanısına varılmıştır.
KAYNAKLAR
- John DT, Petri WA Jr (eds). Lumen-dwelling protozoa, pp: 22-45. In: Markell and Voge's Medical Parasitology. 2006, 9th ed. Saunders Elsevier, Philadelphia.
- Yakut M, Özden A. Amip, amebiasis ve ilişkili hastalıklar. Güncel Gastroenteroloji Derg 2008; 12(2): 81-97.
- Tanyuksel M, Petri WA Jr. Laboratory diagnosis of amebiasis. Clin Microbiol Rev 2003; 16(4): 713-29.
- Tuncay S, Inceboz T, Över L ve ark. Dışkıda Entamoeba histolytica'nın saptanmasında kullanılan yöntemlerin birlikte değerlendirilmesi. Turkiye Parazitol Derg 2007; 31(3): 188-93.
- Arslan MO, Sari B, Kulu B, Mor N. The prevalence of intestinal parasites in children brought to the Kars Maternal and Children's Hospital with complaints of gastrointestinal symptoms. Turkiye Parazitol Derg 2008; 32(3): 253-6.
- Ataş AD, Alim A, Ataş M, Artan MO. The investigation of intestinal parasites in two primary schools in different social-economic districts of the city of Yozgat, Turkey. Turkiye Parazitol Derg 2008; 32(3): 261-5.
- Yaman O, Yazar S, Ozcan H, et al. Distribution of intestinal parasites in patients presenting at the parasitology laboratory of the medical school of Erciyes University between the years of 2005 and 2008. Turkiye Parazitol Derg 2008; 32(3): 266-70.
- Delialioglu N, Aslan G, Ozturk C, Ozturhan H, Sen S, Emekdas G. Detection of Entamoeba histolytica antigen in stool samples in Mersin, Turkey. J Parasitol 2008; 94(2): 530-2.
- Kurt O, Demirel M, Ostan I, et al. Investigation of the prevalence of amoebiasis in Izmir province and determination of Entamoeba spp. using PCR and enzyme immunoassay. New Microbiol 2008; 31(3): 393-400.
- Tamer GS, Caliskan S, Willke A. Distribution of intestinal parasites among patients who presented at the parasitology laboratory of the Kocaeli University School of Medicine Hospital. Turkiye Parazitol Derg, 2008; 32(2): 126-9.
- Doğan N, Demirüstü C, Aybey A. Eskişehir Osmangazi Üniversitesinin beş yıllık bağırsak paraziti prevalansının türlere ve cinsiyetlere göre dağılımı. Turkiye Parazitol Derg 2008; 32(2): 120-5.
- Usluca S, Inceboz T, Over L, et al. The distribution of intestinal parasites detected in the Dokuz Eylul University Medical Faculty Hospital between 2005 and 2008. Turkiye Parazitol Derg 2010; 34(1): 27-31.
- Koçak Tufan Z, Altun S, Bulut C, Kınıklı S, Demiröz AP. Protozoal antigen positivity in diarrheal patients admitted to emergency service: a point prevalence study. Mikrobiyol Bul 2011; 45(4): 765-7.
- Malatyalı E, Ozçelik S, Celiksöz A. The investigation of Entamoeba histolytica prevalence in some villages of Sivas by ELISA method.Turkiye Parazitol Derg 2011; 35(1): 6-9.
- Akyar I, Gültekin M. Five year surveillance of Entamoeba histolytica and Giardia antigen of stool samples by ELISA method. Turkiye Parazitol Derg 2012; 36(1): 12-6.
- Alver O, Özakın C, Töre O. The distribution of intestinal parasites detected in the Uludag University Medical Faculty Hospital between 2009-2010. Turkiye Parazitol Derg 2012; 36(1): 17-22.
- Yılmaz H, Taş-Cengiz Z, Ceylan A, Ekici A. The distribution of intestinal parasites in people admitted to the Yüzüncü Yıl University Parasitology Laboratory of Health Research and Training Hospital, in 2009. Turkiye Parazitol Derg 2012; 36(2): 105-8.
- Zeyrek FY, Turgay N, Unver A, Ustün S, Akarca U, Töz S. Differentiation of Entamoeba histolytica/ Entamoeba dispar by the polymerase chain reaction in stool samples of patients with gastrointestinal symptoms in the Sanliurfa Province. Turkiye Parazitol Derg 2013; 37(3): 174-8.
- Singh A, Houpt E, Petri WA. Rapid diagnosis of intestinal parasitic protozoa, with a focus on Entamoeba histolytica. Interdiscip Perspect Infect Dis 2009; 2009: 547090.
- Göğebakan M, Aksaray N, Yılmaz HL ve ark. Bağırsak amebiyazisli çocuklarda serolojik yöntemlerin tanısal değeri. Türkiye Klinikleri J Pediatr 2001; 10(4):190-6.
- Ramana K, Kranti P. Conventional microscopy versus molecular and immunological methods in the diagnosis of amoebiasis. Ann Med Health Sci Res 2012; 2(2): 211-2.
- Dagci H, Erdogan DD, Toz SO, Kurt O, Ustun S, Akarca U. Differentiation of Entamoeba histolytica and Entamoeba dispar by PCR: a preliminary study in Izmir, Turkey. New Microbiol 2007; 30(1): 45-8.
- Khairnar K, Parija SC. A novel nested multiplex polymerase chain reaction (PCR) assay for differential detection of Entamoeba histolytica, E.moshkovskii and E.dispar DNA in stool samples. BMC Microbiol 2007; 7: 47.
- Pınar A, Akyön Y, Alp A ve ark. Dışkı örneklerinde gerçek zamanlı polimeraz zincir reaksiyonu ile Entamoeba histolytica saptanmasında duyarlı bir DNA saflaştırma protokolü uyarlanması. Mikrobiyol Bul 2010; 44(3): 453-9.
- Stark D, van Hal S, Fotedar R, et al. Comparison of stool antigen detection kits to PCR for diagnosis of amebiasis. J Clin Microbiol 2008; 46(5): 1678-81.
- Zeyrek FY, Özbilge H, Yüksel MF ve ark. Şanlıurfa'da parazit faunası ve ELISA yöntemi ile dışkıda Entamoeba histolytica/Entamoeba dispar sıklığı. Turkiye Parazitol Derg 2006; 30(2): 95-8.
- Tanyuksel M, Yilmaz H, Ulukanligil M, et al. Comparison of two methods (microscopy and enzyme-linked immunosorbent assay) for the diagnosis of amebiasis. Exp Parasitol 2005; 110(3): 322-6.
- Stark D, Al-Qassab SE, Barratt JL, et al. Evaluation of multiplex tandem real-time PCR for detection of Cryptosporidium spp., Dientamoeba fragilis, Entamoeba histolytica, and Giardia intestinalis in clinical stool samples. J Clin Microbiol 2011; 49(1): 57-62.
İletişim (Correspondence):
Uzm. Dr. Nazmiye Ülkü Tüzemen,
Çankırı Devlet Hastanesi,
Tıbbi Mikrobiyoloji Laboratuvarı,
18100 Çankırı, Türkiye.
Tel (Phone): +90 531 793 3059,
E-posta (E-mail): ulku_tuzemen@yahoo.com.tr