İlaç,
Kozmetik ve Gıda Ürünlerinde Kullanılan Bazı Koruyucuların Antimikrobiyal ve
Antibiyofilm Etkisinin Araştırılması
Investigation
of Antimicrobial and Antibiofilm Effects of Some Preservatives Used in Drugs,
Cosmetics and Food Products
Nihal GÜVEN1, Fatma KAYNAK ONURDAĞ1,2
1 Gazi Üniversitesi Eczacılık Fakültesi, Farmasötik Mikrobiyoloji Anabilim Dalı, Ankara.
1 Gazi University Faculty of Pharmacy, Department of Pharmaceutical Microbiology, Ankara, Turkey.
2 Trakya Üniversitesi Eczacılık Fakültesi, Farmasötik Mikrobiyoloji Anabilim Dalı, Edirne.
2 Trakya University Faculty of Pharmacy, Department of Pharmaceutical Microbiology, Edirne, Turkey.
ÖZET
Mikrobiyal kontaminasyonu önlemek amacıyla gıdalara, ilaçlara ve diğer farmasötik ürünlere koruyucu maddeler ilave edilmektedir. Koruyucuların antimikrobiyal aktivitelerinin saptanması ve koruyucu etkinlik testlerinin yapılmasında, standart test organizmalarının vejetatif üreme şekilleri kullanılır. Ancak, canlı dokular, medikal implantlar, endüstriyel veya içme suyu sistemlerinin boruları, doğal akuatik sistemler, cam ve plastik yüzeyler gibi birçok farklı yüzeyde mikrobiyal biyofilm oluşumu görülebilir. Çalışmamızda ilaç, kozmetik ve gıda ürünlerinde kullanılan bazı koruyucuların, antimikrobiyal ve antibiyofilm etkilerinin araştırılması ve bu ürünlerde yaygın kullanım alanına sahip cam yüzeyde oluşan mikrobiyal biyofilm formlarına karşı kullanılabilecek, minimum biyofilm inhibisyon konsantrasyonu (MBİK) değerleri ile planktonik formlarının minimum inhibisyon konsantrasyonu (MİK) değerlerinin kıyaslanması amaçlanmıştır. Mikroorganizma olarak; Pseudomonas aeruginosa ATCC 27853, Salmonella Thyphimurium SL1344, Staphylococcus aureus ATCC 6538, Staphylococcus epidermidis NCTC 11047, Enterococcus faecalis ATCC 29212, Candida albicans ATCC 10231 standart suşları, koruyucu olarak; sodyum nitrit, metil paraben, propil paraben, potasyum sorbat ve sodyum benzoat ve antimikrobiyal ajan olarak; ampisilin, vankomisin, gentamisin, siprofloksasin, amfoterisin B ve itrakonazol kullanılmıştır. MİK değerleri, CLSI M100-S18 ve M27-A3 önerileri doğrultusunda saptanmıştır. MBİK değerlerinin saptanmasında BioTimer (BT) yöntemi kullanılmıştır. Fenol kırmızısı veya resazurinin renk değiştirdiği süreye karşı çizilen log10CFU (koloni oluşturan ünite) grafikleri kullanılarak "CFU/cam boncuk" değerleri hesaplanmıştır. Tüm deneyler, pH: 7, pH: 6.5, pH: 6 ve pH: 5.5 olacak şekilde dört farklı pH değerindeki besiyerleriyle yapılmıştır. Mikroorganizmaların planktonik formlarına olan etkiye bakıldığında S.aureus ve E.faecalis dışındaki tüm mikroorganizmalar için en etkili koruyucu sodyum benzoat olarak tespit edilmiştir. S.aureus ve E.faecalis için ise en etkili koruyucu propil parabendir. Propil paraben ayrıca S.epidermidis için de etkili bulunmuştur. Bununla birlikte, biyofilm formlarına karşı etkiye bakıldığında, inokulüm miktarları mikrodilüsyon yönteminde kullanılan inokulüm miktarına eşit, daha düşük ya da daha yüksek olduğu durumlarda dahi çalışmamızda kullanılan koruyucuların etkisiz oldukları görülmektedir. Çalışmamızda elde edilen veriler doğrultusunda; ilaç, kozmetik ve gıda ürünlerinde mikrobiyal kontaminasyonu önlemek amacıyla kullanılan koruyucuların, mikroorganizmaların biyofilm formlarına etkili olmadıkları tespit edilmiştir. Çalışmamızın, bu konuda yapılacak olan ileri çalışmalar için yol gösterici olabileceği düşünülmektedir.
Anahtar sözcükler: Koruyucu; biyofilm; antimikrobiyal aktivite.
ABSTRACT
Preservatives are added to food, drugs and other pharmaceutical products to avoid microbial contamination. For antimicrobial activity testing and preservative efficacy testing, vegetative forms of the standard test organisms are used. However, microbial biofilm formation may occur on living tissues, medical implants, industrial or drinking water pipes, natural aquatic systems, glass and plastic surfaces. In our study, it was aimed to determine the antimicrobial and antibiofilm effects of some preservatives used in drug, cosmetics and food products and to compare the minimum biofilm inhibitory concentration (MBIC) of microbial biofilm formed on glass surfaces which are commonly used in those areas and the minimum inhibitory concentration (MIC) values of the planktonic forms. In the study Pseudomonas aeruginosa ATCC 27853, Salmonella Thyphimurium SL1344, Staphylococcus aureus ATCC 6538, Staphylococcus epidermidis NCTC 11047, Enterococcus faecalis ATCC 29212 and Candida albicans ATCC 10231 were used as the standard strains; sodium nitrate, methylparaben, prophylparaben, potassium sorbate and sodium benzoate as the preservatives; ampicillin, vancomycin, gentamicin, ciprofloxacin, amphotericin B and itraconazole as the antimicrobial agents. MIC values were determined through the guidelines of CLSI M100-S18 and M27-A3 protocols. BioTimer method was used to determine the MBIC values. The value of "colony forming unit (CFU)/glass beads" was calculated using the graphics drawn by plotting the time of color change for phenol red or resazurin against log10CFU. All experiments were done with four media at different pH values namely pH: 7, pH: 6.5, pH: 6 and pH: 5.5. According to the results of tests on planktonic forms of the microorganisms, sodium benzoate was determined to be the most effective preservative against all the microorganisms tested except S.aureus and E.faecalis. The most effective preservative against S.aureus and E.faecalis was prophylparaben. Prophylparaben was also effective against S.epidermidis. However, in our study it was determined that preservatives were not effective against biofilm forms even if the inoculum was lower, equal to or higher than the inocula of the planktonic forms. The data obtained from this study indicated that preservatives used to prevent microbial contamination in pharmaceutical, cosmetic and food products, are not effective against biofilm forms of the microorganisms. This study is thought to be a guide for further studies to be held in the investigation of antimicrobial and antibiofilm effects of preservatives used in drugs, cosmetics and food industry.
Key words: Preservatives; biofilm; antimicrobial activity.
Geliş Tarihi (Received): 03.09.2013 - Kabul Ediliş Tarihi (Accepted): 26.11.2013
GİRİŞ
Mikrobiyal kontaminasyonu önlemek ve mikroorganizmaların çoğalmasını durdurmak amacıyla gıdalara, ilaçlara ve diğer farmasötik ürünlere ilave edilen koruyucular, ürünün içeriğinde ve formülasyonunda bulunmayan, sonradan eklenen maddelerdir1,2,3,4. Koruyucuların eklenmesiyle, kontaminasyona bağlı olarak üründe meydana gelebilecek bozulmanın engellenmesinin yanı sıra, oluşabilecek sağlık sorunlarının önüne geçilmesi ve tüketicinin korunması hedeflenir5,6. Koruyucuların antimikrobiyal aktivitelerinin saptanması ve koruyucu etkinlik testlerinin yapılmasında, standart test organizmalarının vejetatif şekilleri kullanılır7,8,9,10. Özellikle likit preparatlar mikrobiyal üreme için, bunların ambalajları ise biyofilm oluşumu için uygun ortam oluşturmaktadır. Canlı veya cansız yüzeylerde oluşabilen biyofilm içerisindeki mikroorganizmaların vejetatif formlarına kıyasla daha dirençli olabildikleri bilinmektedir11,12.
Günümüzde ambalaj sanayiinde, mikrobiyal gelişmeyi baskılamak amacıyla yeni materyaller ve teknolojiler geliştirilmektedir. Ancak, ne kadar mükemmel hazırlanmış olursa olsun, ambalajlanmış ürünlerin yüzeylerinde, üretim, depolama, taşıma, satışa sunma ve servis aşamaları sırasında, üretici ve satıcıdan, iç-dış çevresel faktörlerden dolayı bulaşmalar meydana gelebilmektedir13. En çok mikrobiyolojik kontaminasyon görülen hammadde grupları; doğal maddeler, karbonhidratlar ve glikozitler, yüksek molekül ağırlıklı alkoller, yağ asitleri ve esterleri, protein ve protein türevleri, talk, kaolin, mısır nişastası ve sudur14. Su, özellikle farmasötik ürünlerdeki en önemli kontaminasyon kaynağı olup, depolanma sırasındaki durgun su, mikroorganizmaların üremesi ve biyofilm oluşturması açısından önemli bir ortamdır15.
Bir ürün, aseptik şartlarda işlem görmüş ve üretim sırasında kontamine olmamış olsa da, primer ambalaj kaplarına aktarıldığında hala mikroorganizmalarla karşılaşma riski taşır. Ambalajın ve kapağın şekli, ürünün kullanımı esnasında mikrobiyal kontaminasyonu önlemede önemlidir16. Kozmetik ürünlerin, şurup formundaki bazı ilaçların ve bazı gıdaların ambalajları açılıp kapanarak tekrar kullanılan özelliktedir6,17. Ancak açılır kapanır bir primer ambalaj, kullanıcı tarafından açık bırakıldığında, hiçbir koruyucu özelliği kalmamaktadır. Bu durumda, ortamda antimikrobiyal maddelerin bulunması da stres faktörü olarak biyofilm oluşumunu teşvik edebilmektedir18. Bu çalışmada; ilaç, kozmetik ve gıda ürünlerinde kullanılan bazı koruyucuların, yaygın kullanım alanına sahip cam yüzeyde mikrobiyal biyofilm oluşumunu inhibe eden minimum konsantrasyonlarının saptanması ve planktonik formlarına karşı etki eden minimum inhibisyon konsantrasyonu (MİK) ile kıyaslanması amaçlanmıştır.
GEREÇ ve YÖNTEM
Mikroorganizmalar, Koruyucular ve Antimikrobiyal İlaçlar
Çalışmamızda standart mikroorganizma olarak Pseudomonas aeruginosa ATCC 27853, Salmonella Thyphimurium SL1344, Staphylococcus aureus ATCC 6538, Staphylococcus epidermidis NCTC 11047, Enterococcus faecalis ATCC 29212 ve Candida albicans ATCC 10231 suşları; koruyucu olarak sodyum nitrit, metil paraben, propil paraben, potasyum sorbat ve sodyum benzoat; antimikrobiyal ilaç olarak ise ampisilin, vankomisin, gentamisin, siprofloksasin, amfoterisin B ve itrakonazol kullanıldı.
MİK Değerlerinin Saptanması
Bu amaçla mikrodilüsyon yöntemi kullanıldı ve yöntem CLSI (Clinical Laboratory Standards Institute) önerileri doğrultusunda uygulandı9,10. İnkübasyon sonrası, kuyucuklardaki üremeyi inhibe eden en düşük madde konsantrasyonu MİK olarak değerlendirildi.
Minimum Biyofilm İnhibisyon Konsantrasyonu (MBİK) Değerlerinin Saptanması
Suşların MBİK değeri, BioTimer (BT) yöntemi ile araştırıldı19. Bu yöntemde P.aeruginosa için resazürin içeren MHB (Mueller Hinton Broth), S.aureus, S.epidermidis, E.faecalis, S.Thyphimurium için fenol kırmızısı içeren glukozlu MHB ve C.albicans için fenol kırmızısı içeren glukozlu SLM (Sabouraud Liquid Medium) besiyerleri kullanıldı. Fenol kırmızılı besiyeri 1 litrede 21 gr MHB veya 30 gr SLM, 25 mg fenol kırmızısı ve 10 gr glukoz; resazürinli besiyeri ise 21 gr/L MHB ve 10 mg/L resazürin içermekte idi. Koruyucuların aktiviteleri değişebileceğinden, tüm deneyler, pH: 7, pH: 6.5, pH: 6 ve pH: 5.5 olacak şekilde dört farklı pH değerindeki besiyeri ile yapıldı.
Yirmi dört kuyucuklu mikroplakların A1 ve C1 kuyucuklarına 1.8 ml, diğer kuyucuklarına 1 ml indikatörlü besiyeri eklendi. İlk kuyucuğa 0.2 ml bakteri ya da maya süspansiyonu eklenerek 2 ml'ye tamamlandı. Bakteri veya maya süspansiyonu çift katlı olarak sulandırıldı; 12. kuyucuktan dışarıya 1 ml atıldı. Bu işlem tüm mikroorganizmalar ve besiyerleri için tekrarlandı. Dilüsyon işleminden sonra her kuyucuktan 10 µl alınarak, bakteriler için Mueller Hinton agar (MHA), C.albicans için Sabouraud dekstroz agar (SDA) besiyerlerine ekildi ve steril eküvyon ile plak yüzeyine yayıldı. Daha sonra mikroplaklar ve katı besiyerleri inkübasyona kaldırıldı. İnkübatörün içerisine kurulan bir düzenek yardımıyla mikroplakların dakikada bir fotoğrafı çekildi ve her kuyucuğun renginin, fenol kırmızılı besiyeri için kırmızıdan sarıya döndüğü, resazürinli besiyeri için maviden pembeye döndüğü süre tespit edildi. İnkübasyon sonunda katı besiyerlerindeki koloniler sayılarak besiyerinin renk değiştirdiği süreye karşı log10CFU (colony forming unit) grafiği çizildi.
Mikroorganizmaların biyofilm oluşturması için; bakteriler 37°C'de %5 glukoz içeren MHA ve C.albicans 35°C'de %5 glukoz içeren SDA besiyerinde 16-24 saat inkübe edildikten sonra, bakteriler %5 glukoz içeren MHB ve C.albicans %5 glukoz içeren SLM besiyerine pasajlandı ve 5 mm çapında cam boncuk varlığında 16-24 saat inkübe edildi. İnkübasyon sonrası kolonize olan cam boncuklar PBS (0.01 M potasyum fosfat tamponu) ile üç kez yıkanıp 1 ml fenol kırmızılı veya resazürinli besiyeri bu boncuklarla inoküle edildi. Antibiyotik ve koruyucu içermeyen kontrol kuyucuğunun renk değiştirdiği süre not edildi. Süre/log10CFU eğrisi kullanılarak, cam boncukta oluşan biyofilmde bulunan mikroorganizma sayısı hesaplandı. Biyofilmdeki mikroorganizma sayısı "CFU/cam boncuk" olarak kaydedildi (Tablo I).
Koruyucular ve antibiyotiklerin sulandırımları 24 kuyucuklu mikroplaklarda, 12 sulandırım olacak şekilde pH: 7, pH: 6.5, pH: 6 ve pH: 5.5 besiyerinde tekrarlandı. Her sulandırım 1 cam boncukla inoküle edildi. 16-24 saat inkübasyonu takiben renk değişimine neden olmayan en düşük ilaç konsantrasyonu MBİK olarak saptandı.
Mikroorganizmaların biyofilm oluşturduğunun doğrulanması ve cam boncuklarda biyofilm oluşumunun gösterilmesi için modifiye bir mikrotitre plak yöntemi kullanıldı20. Suşlarda biyofilm oluşumunun gösterilmesi için %5 glukoz içeren besiyerlerinde üretilen mikroorganizmalar inkübasyonu takiben %5 glukoz içeren sıvı besiyerlerine aktarıldı. Sıvı kültürden 100'er µl alınarak 96 kuyucuklu mikroplağın 6 kuyucuğuna aktarıldı; inkübasyondan sonra kuyucuklar PBS ile yıkandı. 150 µl metanol ile 10 dakika fikse edildikten sonra 150 µl kristal viyole eklenerek 20 dakika boyandı. Plaklar, musluk suyu ile yıkandıktan sonra 150 µl %33'lük glasiyal asetik asit eklendi ve kuyucuğun renginin mavi-mor olması biyofilm varlığı olarak değerlendirildi.
Cam boncuklarda biyofilm oluşumunun doğrulanması için, cam boncuklar, PBS ile yıkandıktan sonra 150 µl metanol içerisinde 10 dakika fikse edildi. Sonra 150 µl kristal viyole içerisinde 20 dakika boyandı. Musluk suyu ile yıkandıktan sonra %33'lük glasiyel asetik asit içerisinde bekletildi ve boncuğun içinde bulunduğu kuyucuğun renginin mavi-mor olması biyofilm varlığı olarak değerlendirildi.
BULGULAR
Her mikroorganizma için, indikatörlü besiyerlerinin bulunduğu kuyucukların renginin değiştiği süreler, bu kuyucuklardan katı besiyerine yapılan pasajlarda üreyen koloni sayıları kullanılarak çizilen süre/log10CFU grafiğinin eğimi, biyofilm oluşan cam boncuğun bulunduğu, antibiyotik ve koruyucu içermeyen kontrol kuyucuğunun renk değiştirdiği süre (dakika) ve bu sürenin grafiğin eğimine eklenmesiyle hesaplanan CFU/cam boncuk değerleri Tablo I'de verilmiştir.
MİK değerlerinin tespit edildiği mikrodilüsyon yönteminde, CLSI M100-S18 önerileri doğrultusunda bakteriler için ilk inokulüm olarak 106 CFU/mL, CLSI M27-A3 önerileri doğrultusunda C.albicans için 2.5 x 103 CFU/mL kullanılmıştır. S.Thyphimurium, S.aureus ve E.faecalis biyofilm formları için tüm pH değerlerinde saptanan ilk inokulüm konsantrasyonları (İİK), planktonik formların İİK'den daha düşüktür. S.epidermidis için tüm pH değerlerinde ve P.aeruginosa için pH: 7 ve pH: 6'da saptanan İİK, planktonik formların İİK ile uyumlu iken; P.aeruginosa için pH: 6.5 ve pH: 5.5'da, C.albicans için ise tüm pH değerlerinde saptanan İİK, planktonik formların İİK'den daha fazladır (Tablo I). Çalışmamızda kalite kontrolü için kullanılan standart ilaçlar için saptanan MİK değerleri, CLSI9,10 tarafından önerilen sınır değerler arasındadır.
P.aeruginosa suşuna karşı elde edilen MBİK değerleri MİK değerleriyle kıyaslandığında; sodyum nitrit (SN) için 64-512 kat, metil paraben (MP) için 16-256 kat, propil paraben (PP) için yaklaşık 1024-2048 kat, potasyum sorbat (PS) için 256-512 kat, sodyum benzoat (SB) için 8192-16.384 kat, gentamisin için yaklaşık 4-32 kat daha fazla bulunmuştur. Koruyucular ve gentamisinin P.aeruginosa ATCC 27853 için MİK ve MBİK değerleri Tablo II'de verilmiştir.
S.Thyphimurium'un cam boncuktaki İİK, planktonik formların İİK'ndan daha düşük olmasına rağmen MBİK değerleri MİK değerlerinden daha yüksektir. MBİK değerleri MİK değerleri ile kıyaslandığında; SN için 64-1024 kat, MP için 64-256 kat, PP için 256-2048 kat, PS için yaklaşık 1024-16.384 kat, SB için yaklaşık 8192-16.384 kat, siprofloksasin için yaklaşık 2-16 kat daha fazladır. Koruyucular ve siprofloksasinin S.Thyphimurium SL1344 için MİK ve MBİK değerleri Tablo III'te verilmiştir.
S.aureus'un cam boncuktaki İİK, planktonik formların İİK'den daha düşüktür ancak MBİK değerleri MİK değerlerinden; SN için 128-512 kat, MP için 32-128 kat, PP için yaklaşık 512-2048 kat, PS için 64-128 kat, SB için 512-1024 kat, vankomisin için yaklaşık 8 kat, ampisilin için yaklaşık 1-8 kat daha fazladır. Koruyucular, vankomisin ve ampisilinin S.aureus ATCC 6538 için MİK ve MBİK değerleri Tablo IV'te verilmiştir.
E.faecalis'in cam boncuktaki İİK da, planktonik formların İİK'den daha düşüktür ve MBİK değerleri MİK değerleri ile kıyaslandığında; SN için 128-256 kat, MP için 32-64 kat, PP için 64-128 kat, PS için 64-128 kat, SB için 256-1024 kat, vankomisin için yaklaşık 1-2 kat, ampisilin için yaklaşık 1-16 kat daha fazladır. Koruyucular, vankomisin ve ampisilinin E.faecalis ATCC 29212 için MİK ve MBİK değerleri Tablo V'te verilmiştir.
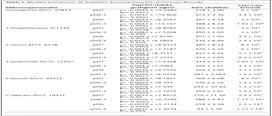
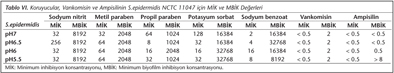
S.epidermidis'in cam boncuktaki İİK, planktonik formların İİK ile benzerdir ve MBİK değerleri MİK değerlerinden daha yüksek bulunmuştur. S.epidermidis'e karşı elde edilen MBİK değerleri MİK değerleri ile kıyaslandığında; SN için 32-256 kat, MP için 32-64 kat, PP için 16-128 kat, PS için 128-2048 kat, sodyum benzoat için 1024-8192 kat, vankomisin için yaklaşık 4 kat, ampisilin için yaklaşık 1-16 kat daha fazladır. Koruyucular, vankomisin ve ampisilinin S.epidermidis NCTC 11047 için MİK ve MBİK değerleri Tablo VI'da verilmiştir.
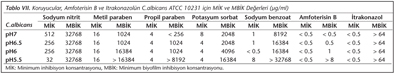
C.albicans'ın cam boncuktaki İİK, planktonik formların İİK'den daha yüksektir. MBİK değerlerinin MİK değerlerinden daha yüksek olması bu konsantrasyon farklılığına da bağlanabilir. MBİK değerleri MİK değerlerinden; SN için 64-1024 kat, MP için yaklaşık 64-1024 kat, PP için yaklaşık 64-2048 kat, PS için 256-4096 kat, SB için yaklaşık 4096-32.768 kat, amfoterisin B için yaklaşık 1-16 kat, itrakonazol için yaklaşık 128 kat daha fazladır. Koruyucular, amfoterisin B ve itrakonazolün C.albicans ATCC 10231 için MİK ve MBİK değerleri Tablo VII'de verilmiştir.
TARTIŞMA
Mikroorganizmalar, bulundukları ortamdaki yüzeyin özelliklerine göre biyofilm oluşturmaktadır12. İlaç, kozmetik ve gıda ürünlerinde kullanılan ambalaj materyalinde biyofilm oluşumu, koruyucu etkinlik testinden geçerek, ürünün içerisine, yeterli miktarda ve dozda eklenmiş olan koruyucuların etkisiz kalması ile sonuçlanabilir. Yapılan çalışmalarda, biyofilm oluşturan mikroorganizmaların biyofilm formlarının antibiyotik ve biyositlere planktonik formlarına kıyasla çok daha dirençli oldukları gösterilmiştir21,22. Bu durumda, biyofilm formlarının, koruyuculara da planktonik formlarına kıyasla daha dirençli olması beklenmektedir.
S.enteritidis ve S.Typhimurium gıda kaynaklı Salmonella enfeksiyonlarının en sık görülen sebepleridir ve içerisinde plastik, cam ve paslanmaz çeliğin de yer aldığı birçok farklı yüzeyde biyofilm oluşturma yeteneğine sahip serotiplerdir23,24. Wong ve arkadaşları25, biyofilm içerisindeki Salmonella'ların, planktonik formlarına kıyasla dezenfektanlara daha dirençli olduklarını rapor etmiştir. Mahami ve arkadaşlarının26 çalışmasında, S.aureus'un biyofilm formlarının antimikrobiyal ilaçlara planktonik formlarından daha dirençli olduğu bildirilmiştir. S.aureus biyofilmlerinin duyarlılıklarının araştırıldığı bir çalışmada da, MBİK değerleri çalışmaya alınan tüm antibiyotikler için > 2048 µg/ml iken, MİK değerlerinin 0.0008-32 µg/ml arasında olduğu saptanmıştır27. Qu ve arkadaşları28 ise, düşük doğum ağırlıklı bebeklerden izole edilen koagülaz negatif stafilokokların oluşturduğu biyofilmin değişik aşamalarına antibiyotiklerin etkisini araştırmışlardır. Bu araştırıcılar, biyofilm oluşumunun ilk aşamasındaki tutunma fazında, biyofilm üzerine etkili ilaç konsantrasyonlarının MİK değerleri ile benzer olduğunu; ancak ileri aşamalardaki etkili antibiyotik konsantrasyonlarının MİK değerlerinden yüksek olduğunu ifade etmişlerdir28. İlginç olarak çalışmada, planktonik formlar durağan fazda iken elde edilen MİK değerlerinin, biyofilm formlarına etkili konsantrasyonlarla benzer olduğu saptanmıştır28.
Moliz ve arkadaşları29, klorhekzidin verniklerinin E.faecalis'in hem planktonik hem de biyofilm formlarına karşı etkili olduğunu; Oliveira ve arkadaşları30 da, tarım ızgaralarında biyofilm oluşturan enterokokların biyofilm formlarının antibiyotiklere karşı yüksek dirence sahip olduğunu göstermişlerdir. Sandoe ve arkadaşları31 ise çalışmalarında ampisilin, vankomisin ve linezolidin enterokok biyofilmlerine karşı etkinliğini Calgary biyofilm yöntemiyle araştırmış ve in vitro koşullarda biyofilm içerisindeki enterokokları eradike edebilmek için çok yüksek doz antibiyotik kullanılması gerektiğini bildirmişlerdir.
Candida biyofilmleri ile ilgili olarak yapılan çalışmalarda, kateter yüzeylerinde en fazla biyofilm oluşumunun C.albicans'da görüldüğü ve antifungal ilaçlara karşı C.albicans biyofilminin oldukça yüksek direnç gösterdiği belirtilmiştir32,33,34. Kaynak Onurdağ ve arkadaşları34, Candida türlerinin planktonik ve biyofilm formlarının antifungal ilaçlara karşı duyarlılıklarını Calgary biyofilm (CB) ve BioTimer (BT) yöntemi kullanarak karşılaştırmışlar; CB yöntemi ile elde edilen minimum biofilm eradikasyon konsantrasyon (MBEK) değerlerinin MİK değerlerinden daha yüksek olduğunu saptamışlar ve BT yönteminin daha güvenilir olduğunu vurgulamışlardır.
Sunulan bu çalışmada, ilaç, kozmetik ve gıda ürünlerinde kullanılan bazı koruyucu maddeler ile tedavide kullanılan antibiyotiklerin, standart mikroorganizma suşlarının planktonik ve biyofilm formlarına karşı antimikrobiyal etkinliği araştırılmış; MİK ve MBİK değerleri karşılaştırılmıştır. Çalışmamızda, mikroorganizmaların planktonik formlarına olan etkiye bakıldığında S.aureus ve E.faecalis hariç diğer mikroorganizmalar için en etkili koruyucu maddenin sodyum benzoat olduğu; S.aureus ve E.faecalis için ise en etkili koruyucunun propil paraben olduğu tespit edilmiştir. Propil paraben ayrıca S.epidermidis için de etkili bulunmuştur. Çalışmamızda yalnızca C.albicans için ve bazı pH aralıklarında P.aeruginosa için cam boncukta oluşan biyofilm içerisindeki mikroorganizmaların ilk inokulüm konsantrasyonları, planktonik formların ilk inokulüm konsantrasyonlarından fazladır. Bu koşullar için, MBİK değerlerinin MİK değerlerinden daha yüksek olması bu konsantrasyon farklılığına bağlanabilir. Bununla birlikte, biyofilm formlarına karşı etkiye bakıldığında, çalışmamızda kullanılan koruyucuların çok yüksek MBİK değerleri ile etkisiz oldukları görülmektedir (Tablo II-VII). Sonuçlarımız, diğer araştırıcıların21,22,23,24,25,26,27,28,29,30,31,32,33,34,35 bulguları ile uyumlu bulunmuştur. Bu durum, özellikle tekrar tekrar açılıp kapanarak kullanılan ambalajlar için bir risk oluşturmaktadır ve elde edilen veriler doğrultusunda üründe kullanılan koruyucu konsantrasyonlarının biyofilm oluşması durumunda etkili olmayabileceği sonucuna varılmıştır.
MİK değerleri, koruyucuların optimum olarak etki gösterdiği pH koşullarına göre değişebilmektedir. Ancak çalışmamızın sonuçlarında da görüldüğü gibi koruyucuların ve antimikrobiyal ilaçların biyofilm formlarına olan etkileri söz konusu olduğunda bu durum her zaman geçerli olmamaktadır. Aynı koruyucuların farklı mikroorganizmaların biyofilm formları üzerine en fazla etkili oldukları pH değerlerinde meydana gelen farklılıklar, koruyucunun özelliğinden çok biyofilmin yapısına ve koruyucuya en fazla geçirgen olduğu pH aralığına bağlanabilir. Sonuç olarak, çalışmamızda elde edilen veriler doğrultusunda; ilaç, kozmetik ve gıda ürünlerinde mikrobiyal kontaminasyonu önlemek amacıyla kullanılan koruyucuların, mikroorganizmaların biyofilm formlarına etkili olmadıkları tespit edilmiştir. Kullanılan koruyucuların konsantrasyonlarının artırılması, bu ürünleri kullanacak olan kişiler üzerine de toksik etki yapabileceğinden, ambalajlarla yapılacak ileri çalışmalar ile biyofilm oluşumunun engellenmesine yönelik çözümler bulunmasının daha doğru olacağı düşünülmektedir.
KAYNAKLAR
- Sasseville D. Hypersensitivity to preservatives. Dermatol Ther 2004; 17(3): 251-63.
- Ova G. Koruyucular, s: 105-38. Altuğ T (ed), Gıda Katkı Maddeleri. 2009, 3. Baskı. Sidas Basım, İzmir.
- Novak JS, Sapers GM, Juneja VK (eds). Microbial Safety of Minimally Processed Foods.2003, CRC Press, Taylor & Francis, Washington DC.
- Campana R, Scesa C, Patrone V, Vittoria E, Baffone W. Microbiological study of cosmetic products during their use by consumers: health risk and efficacy of preservative systems. Lett Appl Microbiol 2006; 43(3): 301-6.
- Kaynak Onurdağ F, Özgen S, Abbasoğlu D. Microbiological investigation of used cosmetic samples. Hacettepe University Journal of the Faculty of Pharmacy 2010; 30(1): 1-16.
- Çevikbaş A, Rayaman E, Gürer SÜ, Derici K, Uğurlu T. Koruyucuların etkinliklerinin saptanması, s: 533-42. Abbasoğlu U, Çevikbaş A (ed), Farmasötik Mikrobiyoloji. 2011, 1.baskı. Efil Yayınevi, Ankara.
- Abbasoğlu U, Kaynak Onurdağ F. Antimikrobiyal aktivite testleri, s: 527-32. Abbasoğlu U, Çevikbaş A (ed), Farmasötik Mikrobiyoloji. 2011, 1. Baskı. Efil Yayınevi, Ankara.
- Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing.6th Informational Supplement.M100-S18, 2008. CLSI, Wayne, PA.
- Clinical and Laboratory Standards Institute. Reference method for broth dilution antifungal susceptibility testing of yeast. Approved Standard. M27-A3, 2008. CLSI, Wayne, PA.
- Packaging Technology. Biofilm development on packaging materials. Published online: 2011. Available from: http://packagingtech.net/33-biofilm-development-on-packaging-materials.html
- Donlan RM. Biofilms: microbial life on surfaces. Emerg Infect Dis 2002; 8(9): 881-90.
- Ayçiçek H, Küçükkaraarslan A. Metal meşrubat kutu dış yüzeylerinin mikrobiyel profili. YYÜ Vet Fak Derg 2003; 14(1): 118-23.
- Kapucu E, Kahveci H, Susam Ö, Çanta Y. İlaçların ve kozmetik ürünlerin geliştirilme süreçleri ve doğa üzerine etkileri. Erişim: http://kisi.deu.edu.tr/bulent.cavas/ders/bok5.pdf
- Çevikbaş A, Derici K, Uğurlu T. Farmasötik endüstrisinde mikrobiyal kontaminasyon, s: 393-403. Abbasoğlu U, Çevikbaş A (ed), Farmasötik Mikrobiyoloji. 2011, 1. Baskı. Efil Yayınevi, Ankara.
- Brannan DK, Dille JC. Type of closure prevents microbial contamination of cosmetics during consumer use. Appl Environ Microbiol 1990; 56 (5): 1476-9.
- Brannan DK, Dille JC, Kaufman DJ. Correlation of in vitro challenge testing with consumer use testing for cosmetic products. Appl Environ Microbiol 1987; 53(8): 1827-32.
- Türetgen İ. Su Sistemlerinde Mikrobiyal Biyofilm Oluşumunun İncelenmesi. Doktora Tezi, 2005. İstanbul Üniversitesi, İstanbul.
- Pantanella F, Valenti P, Frioni A, Natalizi T, Coltella L, Berlutti F. BioTimer Assay, a new method for couting Staphylococcus spp. in biofilm without sample manipulation applied to evaluate antibiotic susceptibility of biofilm. J Microbiol Methods 2008; 75(3): 478-84.
- Abdi-Ali A, Mohammadi-Mehr M, Agha Alaei Y. Bactericidal activity of various antibiotics against biyofilm-producing Pseudomonas aeruginosa. Int J Antimicrob Agents 2006; 27(3): 196-200.
- Tote K, Horemans T, Berghe DV, Maes L, Cos P. Inhibitory effect of biocides on the viable masses and matrices of Staphylococcus aureus and Pseudomonas aeruginosa biofilms. Appl Environ Microbiol 2010; 76(10): 3135-42.
- Cernohorska L, Votava M. Antibiotic synergy against biofilm-forming Pseudomonas aeruginosa. Folia Microbiol 2008; 53(1): 57-60.
- Rodrigues D, Cerca N, Teixeira P, Oliveira R, Ceri H, Azeredo J. Listeria monocytogenes and Salmonella enterica enteritidis biofilms susceptibility to different disinfectants and stress response and virulence gene expression of surviving cells. Microb Drug Resist 2011; 17(2): 181-9.
- Bayhan Öktem A, Kaynak Onurdağ F, Er B, Demirhan B.A research of Salmonella spp. in egg and egg products and survival of Salmonella in different temperatures. Turk J Pharm Sci 2009; 6(3): 147-54.
- Wong HS, Townsend KM, Fenwick SG, Trengove RD, O'Handley RM. Comparative susceptibility of planktonic and 3-day-old Salmonella Typhimurium biofilms to disinfectants. J Appl Microbiol 2010; 108(6): 2222-8.
- Mahami T, Adu-Gyamfi A, Owulah C. Comparative susceptibility of in vitro biofilm and planctonic cells of Staphylococcus aureus to antimicrobials. Afr J Microbiol Res 2010; 4(12): 1209-14.
- Pettit RK, Weber CA, Pettit GR. Application of a high throughput Alamar blue biofilm susceptibility assay to Staphylococcus aureus biofilms.Ann Clin Microbiol Antimicrob 2009; 8:28.
- Qu Y, Daley AJ, Istivan TS, Garland SM, Deighton MA. Antibiotic susceptibility of coagulase-negative staphylococci isolated from very low birth weight babies: comprehensive comparisons of bacteria at different stages of biofilm formation. Ann Clin Microbiol Antimicrob 2010; 9:16.
- Arias-Moliz MT, Ferrer-Luque CM, González-Rodriguez MP, Navarro-Escobar E, Antunes de Freitas MF, Baca P. Antimicrobial activity and Enterococcus faecalis biofilm formation on chlorhexidine varnishes. Med Oral Patol Oral Cir Bucal 2012; 17(4): e705-9.
- Oliveira M, Santos V, Fernandes A, Bernardo F, Vilela CL. Antimicrobial resistance and in vitro biofilm-forming ability of enterococci from intensive and extensive farming broilers. Poult Sci 2010; 89(5): 1065-9.
- Sandoe JA, Wysome J, West AP, Heritage J, Wilcox MH. Measurement of ampicillin, vancomycin, linezolid and gentamicin activity against enterococcal biofilms. J Antimicrob Chemother 2006; 57(4):767-70.
- Haswer SP, Douglas LJ. Biofilm formation by Candida species on the surface of catheter materials in vitro. Infect Immun 1994; 62(3):915-21.
- Haswer SP, Douglas LJ. Resistance of Candida albicans biofilms to antifungal agents in vitro. Antimicrob Agents Chemother 1995; 39(9):2128-31.
- Chandra J, Kuhn DM, Mukherjee PK, Hoyer LL, McCormick T, Ghannoum MA. Biofilm formation by the fungal pathogen Candida albicans: development, architecture and drug resistance. J Bacteriol 2001; 183(18): 5385-94.
- Kaynak Onurdağ F, Ozgen S, Abbasoğlu U, Gürcan IS. Comparison of two different methods for the investigation of in vitro susceptibilities of planktonic and biofilm forming Candida species to antifungal agents. Mikrobiyol Bul 2010; 44 (4): 619-31.
İletişim (Correspondence):
Uzm. Dr. Fatma Kaynak Onurdağ,
Trakya Üniversitesi Eczacılık Fakültesi
Farmasötik Mikrobiyoloji Anabilim Dalı,
22030, Edirne, Türkiye.
Tel (Phone): +90 284 235 0180-21,
E-posta (E-mail): fatmakaynak@trakya.edu.tr