Böbrek Nakil Alıcılarının Serum ve Plazma Örneklerinde Bartonella henselae Antikorlarının Araştırılması*
Investigation of Bartonella henselae Antibodies in Serum and Plasma Samples of Kidney Transplant Patients
Özgün KİRİŞ SATILMIŞ1, Yüksel AKKAYA2, Çağrı ERGİN3, İlknur KALELİ3, Belda DURSUN4, Çağatay AYDIN5
1 Sorgun Devlet Hastanesi, Mikrobiyoloji Laboratuvarı, Yozgat.
1 Sorgun State Hospital, Microbiology Laboratory, Yozgat, Turkey.
2 Kadın Doğum ve Çocuk Hastalıkları Hastanesi, Mikrobiyoloji Laboratuvarı, Bingöl.
2 Gynecology, Obstetric and Pediatric Diseases Hospital, Microbiology Laboratory, Bingol, Turkey.
3 Pamukkale Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Denizli.
3 Pamukkale University Faculty of Medicine, Department of Medical Microbiology, Denizli, Turkey.
4 Pamukkale Üniversitesi Tıp Fakültesi, İç Hastalıkları Anabilim Dalı, Denizli.
4 Pamukkale University Faculty of Medicine, Department of Internal Medicine, Denizli, Turkey.
5 Pamukkale Üniversitesi Tıp Fakültesi, Genel Cerrahi Anabilim Dalı, Denizli.
5 Pamukkale University Faculty of Medicine, Department of General Surgery, Denizli, Turkey.
* XXXIV. Türk Mikrobiyoloji Kongresi (7-11 Kasım 2011, Girne, KKTC)'nde poster olarak sunulmuştur.
ÖZET
Organ nakli, son dönem böbrek hastalıklarında hayat kalitesini artıran önemli bir tedavi seçeneğidir. Böbrek nakil alıcılarında, doku atılımının önlenmesi amacıyla uygulanan immünsüpresif tedavi enfeksiyonlara yatkınlık oluşturmaktadır. Sağlıklı bireylerde sistemik, yaygın ve sessiz klinik tablolara neden olan Bartonella henselae, immünsüpresif hastalarda tedavi edilmediği takdirde ölümle sonuçlanabilen enfeksiyonlara yol açabilmektedir. B.henselae enfeksiyonlarının tanısında serolojik yöntemler, uygulamalarının pratik olması ve hızlı sonuç vermeleri nedeniyle tercih edilmektedir. Son yıllarda literatürde özellikle karaciğer ve böbrek organ nakilleri sonrasında bartonelloz kliniğinin görüldüğüne dair raporlar artmıştır. Bu çalışmada, böbrek nakil alıcılarının serum ve plazma örneklerinde B.henselae'ye karşı saptanan antikor seropozitifliğinin sunulması amaçlanmıştır. Çalışmamızda, hem böbrek nakli olmuş hastalarda antikor seropozitifliğinin belirlenmesi, hem de serum ve plazma örneklerinden elde edilen sonuçlar arasında farklılık olup olmadığı değerlendirilmiştir. Çalışmaya, Pamukkale Üniversitesi Sağlık, Araştırma ve Uygulama Merkezi Organ Nakli Biriminde takip edilen 59 böbrek nakil alıcısından (32 erkek, 27 kadın; yaş aralığı: 20-65 yıl) toplanan serum ve plazma örnekleri dahil edilmiştir. Liyofilize B.henselae ATCC 49882 (Houston-1) suşu süspanse edildikten sonra, B.henselae'nin Vero hücre kültürlerine ko-kültüvasyonu Zbinden ve arkadaşları [Clin Diagn Lab Immunol 1995; 2(6): 693-5] tarafından belirtilen şekilde yapılmıştır. Hücrelerin tek tabaka oluşumu sağlandıktan sonra, flasklar içinde ko-kültüvasyona alınmıştır. Enfekte hücreler ile kaplanan lamlar kullanılarak gerçekleştirilen in house immünofloresan antikor (IFA) yöntemiyle B.henselae antikorlarının varlığı 1/64 tarama dilüsyonunda serum ve plazma örneklerinde araştırılmıştır. Çalışmamızda, hastaların serum ve plazma örneklerinde B.henselae antikor pozitifliği sırasıyla %16.9 (10/59) ve %6.8 (4/59) oranında tespit edilmiştir (Cohen = 0.37). Saptanan kappa değeri, serum ve plazma örnekleri ile alınan sonuçların orta uyumlu olduğunu göstermektedir. Her ne kadar genel uygulama olarak serolojik yöntemlerde serum, moleküler yöntemlerde ise plazma örneklerinin kullanımı tercih edilmekteyse de, plazma örnekleri ile çalışılan IFA yönteminde yalancı negatiflik oranlarının artacağı akılda tutulmalıdır.
Anahtar sözcükler: Bartonella henselae; transplantasyon; seroprevalans; immünofloresan antikor; serum; plazma.
ABSTRACT
Solid organ transplantation is an important therapeutic choice to improve the life quality of patients with end-stage renal disease. Renal transplant recipients have to take immunosuppressive therapy to prevent transplant rejection. However, this treatment increases susceptibility to infection. Bartonella henselae causes systemic, disseminated and silent manifestations in healthy individuals, while the mortality rate is high in immunosuppressive patients in the case of untreated bartonellosis. The diagnosis of B.henselae infections is usually based on serological methods since they are practical, simple and rapid. Recent reports indicated that bartonellosis seen after liver or kidney transplantation have been increased. The aim of this study was to present the antibody seropositivity of B.henselae detected in the serum and plasma samples of renal transplant recipients. This study was aimed to evaluate the antibody seroprevalence in renal transplant recipients and also to compare the antibody results obtained from serum and plasma samples. A total of 59 renal transplant recipients (32 male, 27 female; age range: 20-65 years) followed by Transplantation Unit of Health, Research and Training Center of Pamukkale University, were included in the study. After suspension of lyophilised B.henselae ATCC 49882 (Houston-1); B.henselae co-cultivation to Vero cell culture was performed by the method recommended by Zbinden et al. [Clin Diagn Lab Immunol 1995; 2(6): 693-5]. The cells were taken to co-cultivation in flasks after development of monolayers. In house immunofluorescence antibody (IFA) method was performed with the use of infected cell-coated slides. B.henselae antibodies were studied at 1/64 screening dilution both in serum and plasma samples. In our study B.henselae antibody positivity rates found in serum and plasma samples of the patients were 16.9% (10/59) and 6.8% (4/59), respectively (Cohen = 0.37). This detected kappa value indicated that the results of serum and plasma samples revealed fair agreement. It should be kept in mind that the use of plasma samples in IFA tests would increase the false negative results. Thus the results of this study supported the general approach for the preference of serum samples for serological tests.
Key words: Bartonella henselae; transplantation; seroprevalance; immunofluorescent antibody; serum; plasma.
Geliş Tarihi (Received): 10.03.2012 • Kabul Ediliş Tarihi (Accepted): 29.06.2012
GİRİŞ
Son dönem böbrek yetmezliğinde organ nakli sağkalımı uzatan bir tedavi seçeneğidir1. Ancak nakledilen organın atılımının engellenmesi için uygulanan immünsüpresif tedavi, enfeksiyon riskini artırmaktadır. Özellikle kronik, latent ve subklinik enfeksiyona neden olan mikroorganizmalar, nakil sonrası dönemde ciddi klinik tablolara neden olabilmektedir. Bu enfeksiyon etkenlerinden biri de sağlıklı bireylerde çoğunlukla subklinik tablolara neden olan Bartonella henselae'dir. Son yıllarda literatürde özellikle karaciğer ve böbrek organ nakilleri sonrasında bartonelloz kliniğinin görüldüğüne dair raporlar artmıştır2,3,4,5,6,7,8.
Bartonella cinsi üyeleri, fakültatif hücre içi bakteriler olup, vektörlerle bulaşan, rutin kültürlerde zor üreyen, hemotropik gram-negatif basillerdir. Bu cins içinde en az altı türün (B.henselae, B.bacilliformis, B.quintina, B.elizabetheae, B.vinsonii, B.koehlerae) insanlarda hastalık yapabildiği bildirilmiştir. Kedi tırmığı hastalığı, Carrion hastalığı, siper ateşi, basiller anjiyomatöz, peliozis hepatit, kronik bakteriyemi, endokardit, kronik lenfadenopati ve nörolojik bozukluklar, etiyolojisinde Bartonella türlerinin bulunduğu hastalıklardır. En yaygın bulunduğu doğal konak kedilerdir. İnsandaki enfeksiyonlar kedi tırmalaması, ısırması ya da yalamasının sonucu gelişir; ancak artropod ısırmasıyla bulaş da bildirilmektedir9,10,11,12.
B.henselae enfeksiyonlarına yanıt, enfekte konağın immün durumuna bağlıdır. İmmün sistemi sağlıklı bireylerde enfeksiyon 2-4 ayda sonlanan immün yanıtla birlikte lenfatiklerde sınırlı kalırken, immünsüpresif hastalar basiller anjiyomatöz için risk altındadır11. AIDS hastalığı ve organ nakli olan immün düşkün hastalarda kedi tırmığı hastalığı lenf nodlarından yayılabilmekte, nöroretinit ve koryoretinite neden olabilmektedir2,3,4,5,6,7,8,13,14,15,16,17,18. İnsanlarda B.henselae'ye karşı antikor seroprevalansı toplumlara ve çevresel özelliklere göre farklılık gösterebilir. Ülkemizde ise sağlıklı kişilerde bartonelloz seroprevalansı hakkında veriler henüz çok azdır19,20. İmmün sistemi baskılanan bir grup olarak organ nakil alıcılarında bartonelloz oranı ise henüz bilinmemektedir.
B.henselae tanısında lenf nodundan veya enfekte dokulardan alınan biyopsi örneklerinde PCR yöntemi tanı koydurucudur. Ancak invazif işlem gerektirmeyen serolojik testler [immünofloresan antikor (IFA), ELISA, Western blot] tanıda ilk basamağı oluşturur21. Organ nakil hastalarının nakil sonrası kontrol muayenelerinde çeşitli testler için serum ve plazma örnekleri laboratuvarlara gönderilmektedir. Son yıllarda kullanılan IFA tekniğiyle antikorların varlığı serumda aranmaktadır. Sunulan araştırmada böbrek nakil alıcılarında B.henselae'ye karşı antikor seroprevalansının serum ve plazma örneklerinde araştırılması amaçlanmıştır.
GEREÇ ve YÖNTEM
Araştırmaya Pamukkale Üniversitesi Sağlık, Araştırma ve Uygulama Merkezi Organ Nakli Biriminde takip edilen 59 böbrek nakil alıcısı (32 erkek, 27 kadın; yaş aralığı: 20-65 yıl) dahil edildi. Hastaların serum ve plazma [etilendiamin tetraasetik asit (EDTA)'li tüp] örnekleri çalışma gününe kadar -20°C'de saklandı.
B.henselae'ye karşı antikor varlığının saptanmasında IFA tekniği kullanıldı. Kısaca; B.henselae ATCC 49882 (Houston-1) suşu %5 defibrine at kanlı beyin-kalp infüzyon (BKI) agar besiyerlerinde, nemli ve %10 CO2 sağlayan etüvde 45 gün süresince inkübe edildi. Üreyen bakterilerin Vero hücrelerinde eş kültürü Zbinden ve arkadaşları22 tarafından belirtilen şekilde yapıldı. Eş kültüre alınan bakteriler 37°C'de %10'luk CO2 ve nem sağlayan etüvde bir hafta inkübasyona bırakıldı. Süre sonunda eş kültüre hücreler Tip II güvenlik kabini içinde steril pastör pipeti yardımıyla steril cam tüplere alındı. Hücreler Yılmaz ve arkadaşlarının19 tanımladığı şekilde, modifiye bir işlem olarak 56°C'de 30 dakika su banyosunda bekletildi ve B.henselae antijenlerinin inaktivasyonu sağlandı. İnaktivasyon sonrasında hücreler teflon kaplı lamlar üzerine kaplandı. Kurutma işleminden sonra lamlar -20˚C'de aseton ile 15 dakika tespit edildi ve çalışma süresine kadar -70°C'de saklandı. Çalışma kapsamına alınan serum ve plazma örnekleri için Regnery ve arkadaşlarının23 oluşturduğu protokol uygulandı. Yağı alınmış süt tozunun %5'lik çalışma solüsyonu, %1 Tween-20 içeren fosfat tamponlu tuzlu su (PBS) ile hazırlandı. Serum ve plazma örneklerinde 1/64 dilüsyonda IFA tekniğiyle B.henselae antikorlarının varlığı hücre kültürü serisinden hazırlanan antijenlerle kaplanmış lamlar üzerinde araştırıldı. İki pozitif (++) ve üzeri floresan yansıma alınması pozitif reaksiyon olarak kabul edildi. In-house olarak hazırlanan antijen kaplı lamların çalışılması esnasında internal kontrol olarak daha önceden kedi tırmığı hastalığı tanısı alan bir hastanın serum örneği pozitif kontrol olarak kullanıldı24.
BULGULAR
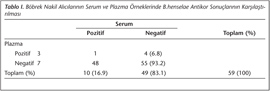
Çalışmamızda, 59 böbrek nakil alıcısında B.henselae antikor pozitifliği serum ve plazma örneklerinde sırasıyla %16.9 ve %6.8 oranında saptanmıştır (Tablo I). Test edilen iki örnek grubu arasındaki rastlantısal olmayan uyum orta derecede uyumlu (Cohen κ değeri= 0.37) olarak değerlendirilmiştir. Çalışmaya alınan alıcıların hiçbirinde akut rejeksiyon gelişmemiştir.
TARTIŞMA
Sağlıklı bireylerden farklı olarak, immün sistemi baskılanmış kişilerde B.henselae gibi sessiz seyreden ve zor tanı konulan enfeksiyonlar daha belirgin bir klinik tablo oluşturmaktadır. İmmün yanıttaki yetersizlikler farklı mikroorganizmaların, normal konakta oluşturduğu beklenen tabloların yanında, patojenitesine göre farklı klinik vermelerine neden olmaktadır. B.henselae immünitesi sağlam konakta yaygın olarak kedi tırmığı hastalığı ve lenfadenopati etiyolojisinde rol alırken, organ nakli sonrasında özellikle izole anjiyoproliferatif yapıların baskın olduğu klinik tablolar meydana getirmiştir. Zor tanı konulan enfeksiyonların birçoğunda olduğu gibi, ulaşılabilen literatürde organ nakli yapılmış hastalarda görülen B.henselae enfeksiyonları ile ilgili az sayıda olgu sunumu ve araştırma bulunmaktadır.
B.henselae'nin laboratuvar tanısındaki zorluklar ve farklılıklardan dolayı, çeşitli risk gruplarına ait seroprevalans taramaları henüz araştırma aşamasında olup, literatürde veri sınırlıdır. Moleküler tanımlama için uygun örneğin elde edilebildiği durumlar dışında, günümüzde B.henselae enfeksiyonlarının laboratuvar tanısında IFA testi en sık tercih edilen tekniktir. Antikor varlığının saptanmasına yönelik testlerde, bartonellozun konaktaki durumu hakkında yeterli bilgi bulunamamaktadır25. Ulaşılabilen literatürde farklı ülkelerdeki çeşitli risk gruplarında yapılan toplum seroprevalans taramalarında büyük farklılıklar olduğu görülmektedir. Bu durum kontrol amaçlı negatif popülasyon grubunun oluşturulmasındaki güçlüğü göstermektedir25,26. Diğer önemli bir sorun da Coxiella burnettii, Rickettsia rickettsii, Ehrlichia chaffeensis, Treponema pallidum, Francisella tularensis, Mycoplasma pneumoniae ve Chlamydia trachomatis türleri arasında görülebilen çapraz serolojik reaksiyonlardır25,27. Çapraz reaksiyonların çoğunluğu C.burnettii ile oluşmaktadır. Bu durumun aşılması için kullanılan çoğu seroprevalans araştırmasında eşik (cut-off) dilüsyon değeri 1/64 olarak kabul edilmiştir28,29. İmmünsüpresif bir grup olarak kabul edilen organ nakil hastalarında ise bu konuda ulaşılabilen literatürde olgu sunumları haricinde veri bulunamamıştır. Ülkemizde farklı merkezlerden yapılmış bartonelloz olgu sunumları bulunmaktadır. B.henselae seroprevalansı Denizli bölgesi gönüllü kan vericilerinde %6; veteriner ve hayvan yetiştiricilerinde ise Aydın bölgesinde %30, Denizli bölgesinde %12.5 olarak bildirilmiştir19,20. Araştırmamızda böbrek nakil alıcılarının serum örneklerinde bulduğumuz %16.9 oranı bu oranlardan yüksektir. Bu durum çalışma grubumuzun immün süpressif katılımcılardan oluşması ve bu nedenle enfeksiyona yatkın olmalarına bağlanabilir.
Organ nakil alıcılarında Bartonella enfeksiyonları, sağlam konakta görülen enfeksiyonlara göre daha farklı tablolar oluşturmuştur. Karaciğer nakli sonrasında farklı araştırıcılar karaciğerde Bartonella spp. kaynaklı granülomatöz lezyonlar bulunduğunu rapor etmişlerdir2,3,7. Bazı araştırıcılar etkenin vericiden geçtiğini düşündüklerini bildirmiştir2,6. Vassallo ve arkadaşları29 allojenik kemik iliği nakli olan dört hastada oral kavitedeki psödomembranöz anjiyomatöz papillamatozu Bartonella spp. ile ilişkili bulmuşlardır. Böbrek nakil alıcıları ile ilgili olgu sunumlarında, tipik klinik tabloların yanı sıra atipik tablolar da bildirilmiştir. Rheault ve arkadaşları4, ikinci kez böbrek nakli yapılmış, ateş ve lenfadenopatisi olan 19 yaşında bir hastada B.henselae tespit etmişlerdir. Kısa süreli azitromisin tedavisinden sonra nüks gözlenmiş ve böbrek nakil alıcıları gibi immün düşkün hastalarda bartonellozun ilk teşhis edildiğinde antibiyotik tedavisinin uzun tutulması gerektiği vurgulanmıştır4. Bir başka raporda, 25 yaşındaki böbrek nakil alıcısında sistemik B.henselae enfeksiyonuna bağlı gelişen peliozis hepatit ve hemato-hepato-renal sendom bildirilmiştir16. Dharnidharka ve arkadaşları18 böbrek nakli olan üç çocuk hastadan ikisinde kedi tırmığı hastalığını akut rejeksiyonla ilişkilendirmişlerdir. Patel ve arkadaşları13 da, bilateral böbrek nakli olan hastada gelişen koriyoretinopatide etken olarak B.henselae'yi tespit etmişlerdir. Caniza ve arkadaşları30 dört kez böbrek nakli olmuş, 17 yaşında ateşli bir hastada pulmoner nodül tespit etmişler, açık akciğer biyopsisi sonucunda B.henselae saptamışlardır. Karras ve arkadaşlarının5 çalışmasında, hemofagositik sendromlu 17 böbrek nakil alıcısından birinde hemofagositik sendrom B.henselae ile ilişkilendirilmiştir. Juskevicius ve Vnencak-Jones15 ise ikinci kez böbrek nakli olan ve ateş pikleri gözlenen hastada yapılan fizik muayenede aksiller lenfadenopati bulmuşlar ve hastada etken olarak B.henselae tespit etmişlerdir.
Genel olarak IFA tekniği ile yapılan araştırmalarda serum örnekleri tercih edilirken plazma örnekleri PCR yöntemlerinde kullanılmaktadır. Plazma, serumdan farklı olarak antikoagülan (oksalat, sitrat, EDTA, florür vb.) içermektedir. Böbrek nakil alıcılarının plazmalarında bulduğumuz pozitiflik oranı (%6.8) serum sonuçlarından (%16.9) düşüktür. Bu durumun EDTA'lı ortamda elektrolit dengesinin farklı olmasından kaynaklandığı ve sonuç olarak antijen-antikor birleşmesinde farklılık oluşturduğu düşünülebilir. İstatistiksel olarak saptanan Cohen kappa değerine göre; plazma ve serum örnekleri ile alınan sonuçlar orta derecede uyumludur. Buna göre İFA yönteminde serum yerine plazma kullanılabilirse de, literatürde yer alan araştırmaların çoğunluğu serum ile yapılmıştır. Plazma elde etme yöntemine göre antikor düzeylerinin farklı olabileceği de göz önüne alındığında, B.henselae antikorlarının IFA tekniği ile araştırılmasında serum örneklerinin kullanılmasının daha uygun olacağı görüşündeyiz.
Literatürde geniş kapsamlı çalışmalardan ziyade olgu sunumlarının olması, çalışmamızın verilerini karşılaştırmayı zorlaştırmaktadır. Organ bağışının yetersiz olduğu ülkelerde ve nakledilen organın korunmasının önemi göz önüne alındığında, tanısı zor da olsa yapılabilen mikroorganizmalar tekrar önem kazanmıştır. Bu hastalarda Bartonella bakterilerine bağlı tipik ve atipik klinik tabloların dikkate alınması ve buna yönelik inceleme yapılması önemlidir. Böbrek nakil alıcılarında Bartonella türlerine bağlı tablolara yatkınlığın ve akut rejeksiyon gelişmesi ilişkisinin netleşmesi için daha geniş kapsamlı çalışmalara ihtiyaç vardır. Araştırmaya alınan olgular içinde akut rejeksiyon gelişmese de, böbrek nakil alıcılarındaki seropozitiflik oranının sağlıklı gönüllülerdeki oranlardan yüksek olması, bu konunun daha kapsamlı veri serileri ile araştırılması gerekliliğini düşündürmektedir.
KAYNAKLAR
- Xue JL, Ma JZ, Louis TA, Collins AJ. Forecast of the number of patients with end-stage renal disease in the United States to the year 2010. J Am Soc Nephrol 2001; 12(12): 2753-8. [Özet] [Tam Metin] [PDF]
- Scolfaro C, Mignone F, Gennari F, et al. Possible donor-recipient bartonellosis transmission in a pediatric liver transplant. Transpl Infect Dis 2008; 10(6): 431-3. [Özet]
- Thudi KR, Kreikemeier JT, Phillips NJ, Salvalaggio PR, Kennedy DJ, Hayashi PH. Cat scratch disease causing hepatic masses after liver transplant. Liver Int 2007; 27(1): 145-8. [Özet]
- Rheault MN, van Burik JA, Mauer M, et al. Cat-scratch disease relapse in a kidney transplant recipient. Pediatr Transplant 2007; 11(1): 105-9. [Özet]
- Karras A, Thervet E, Legendre C; Groupe Coopératif de transplantation d'Ile de France. Hemophagocytic syndrome in renal transplant recipients: report of 17 cases and review of literature. Transplantation 2004; 77(2): 238-43. [Özet]
- Velho PE. Blood transfusion as an alternative bartonellosis transmission in a pediatric liver transplant. Transpl Infect Dis 2009; 11(5): 474.
- Humar A, Salit I. Disseminated Bartonella infection with granulomatous hepatitis in a liver transplant recipient. Liver Transpl Surg 1999; 5(3): 249-51. [Özet]
- Bonatti H, Mendez J, Guerrero I, et al. Disseminated Bartonella infection following liver transplantation. Transpl Int 2006; 19(8): 683-7. [Özet] [Tam Metin] [PDF]
- Rolain JM, Brouqui P, Koehler JE, Maguina C, Dolan MJ, Raoult D. Recommendations for treatment of human infections caused by Bartonella species. Antimicrob Agents Chemother 2004; 48(6): 1921-33. [Tam Metin] [PDF]
-
Chomel BB, Kasten RW. Bartonellosis, an increasingly recognized
zoonosis. J Appl Microbiol 2010; 109(3): 743-50.
[Özet] [Tam Metin] [PDF] - Florin TA, Zaoutis TE, Zaoutis LB. Beyond cat scratch disease: widening spectrum of Bartonella henselae infection. Pediatrics 2008; 121(5): e1413-25. [Özet] [Tam Metin] [PDF]
- Breitschwerdt EB, Kordick DL. Bartonella infection in animals: carriership, reservoir potential, pathogenicity, and zoonotic potential for human infection. Clin Microbiol Rev 2000; 13(3): 428-38. [Özet] [Tam Metin] [PDF]
- Patel SJ, Petrarca R, Shah SM, et al. Atypical Bartonella henselae chorioretinitis in an immunocompromised patient. Ocul Immunol Inflamm 2008; 16(1): 45-9. [Özet]
- Atamanyuk I, Raja SG, Kostolny M. Bartonella henselae endocarditis of percutaneously implanted pulmonary valve: a case report. J Heart Valve Dis 2011; 20(1): 94-7. [Özet]
- Juskevicius R, Vnencak-Jones C. Pathologic quiz case: a 17-year-old renal transplant patient with persistent fever, pancytopenia, and axillary lymphadenopathy. Bacillary angiomatosis of the lymph node in the renal transplant recipient. Arch Pathol Lab Med 2004; 128(1): e12-4. [Tam Metin] [PDF]
- Ahsan N, Holman MJ, Riley TR, Abendroth CS, Langhoff EG, Yang HC. Peloisis hepatis due to Bartonella henselae in transplantation: a hemato-hepato-renal syndrome. Transplantation 1998; 65(7): 1000-3. [Özet]
- Lienhardt B, Irani S, Gaspert A, Weishaupt D, Boehler A. Disseminated infection with Bartonella henselae in a lung transplant recipient. J Heart Lung Transplant 2009; 28(7): 736-9. [Özet]
- Dharnidharka VR, Richard GA, Neiberger RE, Fennell RS 3rd. Cat scratch disease and acute rejection after pediatric renal transplantation. Pediatr Transplant 2002; 6(4): 327-31. [Özet]
- Yılmaz C, Ergin Ç, Kaleli İ. Pamukkale Üniversitesi Kan Merkezi'ne başvuran donörlerde Bartonella henselae seroprevalansının araştırılması ve risk faktörlerinin irdelenmesi. Mikrobiyol Bul 2009; 43(3): 391-401. [Özet] [PDF]
- Sayin-Kutlu S, Ergin C, Kutlu M, Akkaya Y, Akalin S. Bartonella henselae seroprevalence in cattle breeders and veterinarians in the rural areas of Aydin and Denizli, Turkey. Zoonoses Public Health 2012; 59(6): 445-9. [Özet]
-
Vermeulen MJ, Herremans M, Verbakel H, et al. Serological testing for Bartonella
henselae infections in the Netherlands: clinical evaluation of
immunofluorescence assay and ELISA. Clin Microbiol Infect 2007; 13(6): 627-34.
[Özet] [Tam Metin] [PDF] - Zbinden R, Höchli M, Nadal D. Intracellular location of Bartonella henselae cocultivated with Vero cells and used for an indirect fluorescent-antibody test. Clin Diagn Lab Immunol 1995; 2(6): 693-5. [Özet] [PDF]
- Regnery RL, Olson JG, Perkins BA, Bibb W. Serological response to 'Rochalimaea henselae'' antigen in suspected cat-scratch disease. Lancet 1992; 339(8807): 1443-5. [Özet]
- Kaçar N, Taşlı L, Demirkan N, Ergin Ç, Ergin Ş. HIV-negative case of bacillary angiomatosis with chronic hepatitis B. J Dermatol 2010; 37(8): 722-5. [Özet]
- Maurin M, Rolain JM, Raoult D. Comparison of in-house and commercial slides for detection by immunofluorescence of immunoglobulins G and M against Bartonella henselae and Bartonella quintana. Clin Diagn Lab Immunol 2002; 9(5):1004-9. [Özet] [Tam Metin] [PDF]
- Herremans M, Vermeulen MJ, Van de Kassteele J, Bakker J, Schellekens JF, Koopmans MP. The use of Bartonella henselae-specific age dependent IgG and IgM in diagnostic models to discriminate diseased from non-diseased in cat scratch disease serology. J Microbiol Methods 2007; 71(2): 107-13. [Özet]
- Vermeulen MJ, Verbakel H, Notermans DW, Reimerink JH, Peeters MF. Evaluation of sensitivity, specificity and cross-reactivity in Bartonella henselae serology. J Med Microbiol 2010; 59(Pt 6): 743-5. [Tam Metin] [PDF]
-
Rolain JM, Gouriet F, Enea M, Aboud M, Raoult D. Detection by
immunofluorescence assay of Bartonella henselae in lymph nodes from
patients with cat scratch disease. Clin Diagn Lab Immunol 2003; 10 (4): 686-91.
[Özet] [Tam Metin] [PDF] - Vassallo C, Ardigò M, Brazzelli V, et al. Bartonella-related pseudomembranous angiomatous papillomatosis of the oral cavity associated with allogeneic bone marrow transplantation and oral graft-versus-host disease. Br J Dermatol 2007; 157(1): 174-8. [Özet]
- Caniza MA, Granger DL, Wilson KH, et al. Bartonella henselae: etiology of pulmonary nodules in a patient with depressed cell-mediated immunity. Clin Infect Dis 1995; 20(6): 1505-11. [Özet]
İletişim (Correspondence):
Uzm. Dr. Özgün Kiriş Satılmış,
Sorgun Devlet Hastanesi,
Mikrobiyoloji Laboratuvarı,
Sorgun, Yozgat, Türkiye.
Tel (Phone): +90 354 415 1215,
E-posta (E-mail): ozgunkiris@hotmail.com