Rektal Sürüntü Örneklerinde Karbapeneme Dirençli Klebsiella
pneumoniae Taranmasında
Klasik Yöntemlerle Ertapenemli EMB Besiyerinin Karşılaştırılması
Comparison
of Ertapenem-EMB Agar with Traditional Methods for Screening
Carbapenem-Resistant
Klebsiella pneumoniae from Rectal Swabs
Duygu PERÇİN, Selcan ÇOLAKOĞLU, Süleyman DURMAZ, Pınar EKİNCİOĞLU
Erciyes Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Kayseri.
Erciyes University Faculty of Medicine, Department of Medical Microbiology, Kayseri, Turkey.
ÖZET
Tüm dünyada sıklığı giderek artan karbapeneme dirençli Klebsiella pneumoniae (KDKP) suşlarıyla oluşan enfeksiyonların önlenmesinde, hastalarda rektal kolonizasyonun belirlenmesi, enfeksiyon kontrol protokollerinin en önemli basamağıdır. Bu çalışmada, rektal sürüntü örneklerinin KDKP yönünden taranmasında 2 mg/L ertapenem içeren EMB agar besiyerinin, çeşitli uluslararası kılavuzlarda önerilen direkt ekim üzerine ertapenem diski yöntemi ve 2 mg/L ertapenem içeren triptik soy buyyonda zenginleştirme yöntemiyle karşılaştırılması ve kolonize hastalarda hakim beta-laktamazların araştırılması amaçlanmıştır. Bu amaçla hazırlanan zorlaştırıcı simülasyon testi ile besiyerlerinin saptayabildiği en düşük inokulüm belirlenmiştir. Besiyerinin rektal sürüntülerde KDKP saptama yeteneği 801 hastanın klinik örneği kullanılarak değerlendirilmiştir. İzole edilen K.pneumoniae suşlarının karbapenemlere duyarlılık durumu E-test yöntemiyle, beta-laktamaz varlığı modifiye Hodge testi (MHT) ile, karbapenemaz genleri ise multipleks polimeraz zincir reaksiyonu (PCR) yöntemiyle araştırılmıştır. Zorlaştırıcı simülasyon testiyle saptanabilen en düşük inokülum, ertapenemli EMB besiyerinde 50 CFU/mL, ertapenemli triptik soy buyyonda 1 x 105, direkt ekim yönteminde ise 1 x 103 olarak bulunmuştur. İzole edilen 33 suşun 13 (%39.4)'ünde PCR ile herhangi bir direnç geni saptanamazken, 20 pozitif suşun 19 (%95)'unda blaOXA-48, 1 (%5)'inde ise blaIMP saptanmıştır. Pozitif suşların tamamının imipenem ve ertapeneme dirençli, 2 (%10)'sinin ise doripenem ve meropeneme duyarlı olduğu belirlenmiştir. Direnç geni gösterilemeyen tüm suşlarda MHT negatif iken, blaOXA-48 saptanan ve doripenem ve meropeneme duyarlı olan bir suş dışında tüm direnç geni pozitif suşlar MHT pozitif bulunmuştur. PCR sonuçlarına göre üç yöntemin duyarlılığı eşit ve %80 olarak tespit edilmiştir. Testlerin özgüllük, pozitif ve negatif prediktif değerleri sırasıyla ertapenemli EMB için %15.4, %59 ve %33.3; direkt ekim için %23, %61.5 ve %42.9; ertapenemli buyyon için ise %61.5, %76 ve %66.6 olarak saptanmıştır. Her üç yöntem için ortalama süre (izolasyon + tanımlama + duyarlılık + MHT) ertapenemli EMB besiyeri ile 48 saat, diğer yöntemlerde ise 96 saat olarak belirlenmiştir. Sonuç olarak, duyarlı ve hızlı bir yöntem olması nedeniyle, ertapenemli EMB besiyeri, laboratuvar iş yükünü artırmaksızın güvenle kullanılabilecek bir besiyeridir.
Anahtar sözcükler: Karbapenem; ertapenem; EMB agar; Klebsiella pneumoniae; beta-laktamazlar.
ABSTRACT
Detection of rectal colonization with carbapenem-resistant Klebsiella pneumoniae (CRKP) is the most important step in the infection control protocols in order to prevent infections caused by CRKP which has an increasing incidence all over the world. In this study, it was aimed to compare the detection rate of 2 mg/L ertapenem EMB agar medium with the other methods recommended by various international guidelines. These methods include direct plate method using ertapenem disc, enrichment method in tryptic soy broth containing 2 mg/L ertapenem and the investigation of the predominant beta-lactamases in the colonized patients. The lowest inoculum detected by different methods was determined by using simulative challenge test prepared for this purpose. The ability to detect CRKP from rectal swabs was evaluated by using the clinical specimens of 801 patients. For all bacteria isolated, carbapenem susceptibility was evaluated by using E-test method, the presence of beta-lactamases was determined by using modified Hodge test (MHT), and the carbapenemase genes were investigated by using multiplex polymerase chain reaction (PCR). The lowest inoculum detected by ertapenem-EMB agar was 50 CFU/mL whereas the lowest inocula were 1 x 105 and 1 x 103, respectively by tryptic soy broth with ertapenem and direct plate method. No resistance gene were identified by PCR in 13 (39.4%) of 33 isolates, whereas blaOXA-48 was detected in 19 (95%) and blaIMP in 1 (5%) of 20 positive isolates. All of the positive strains were resistant to imipenem and ertapenem, while 2 (10%) strains were found to be susceptible to doripenem and meropenem. While MHT was negative in all strains which were negative for resistance genes, all resistance gene positive strains except one blaOXA-48 strain that was also sensitive to doripenem and meropenem, were found to be positive with MHT. According to the results of PCR, the sensitivities of the three methods were found to be 80%. The specificities, positive and negative predictive values were found to be 15.4%, 59% and 33.3% for ertapenem-EMB agar, 23%, 61.5% and 42.9% for broth with ertapenem and 61.5%, 76% and 66.6% for direct plate method, respectively. Average labor time of the methods (isolation + identification + sensitivity + MHT) was determined as 48 hours for ertapenem-EMB agar, whereas it was 96 hours for the other methods. In conclusion, since ertapenem-EMB agar method is a sensitive and rapid method, it can be used safely for the preliminary detection of CRKP without increasing the workload of the laboratory.
Key words: Carbapenem; ertapenem; EMB agar; Klebsiella pneumoniae; beta-lactamases.
Geliş Tarihi (Received): 02.02.2012 • Kabul Ediliş Tarihi (Accepted): 21.03.2012
GİRİŞ
Karbapeneme dirençli Klebsiella pneumoniae (KDKP) suşlarıyla oluşan enfeksiyonlar, özellikle kritik hastalarda morbidite ve mortaliteyi artıran ve bütün dünyada sıklığı giderek artan bir problemdir1,2. Direnç mekanizması çoğunlukla, KPC, NDM-1, OXA-48 ve IMP tipi beta-laktamazlarla ilişkilidir3,4. Belli karbapenemazların bazı coğrafik bölgelerde daha sık görüldüğü bildirilmektedir. Yunanistan, İsrail ve Amerika Birleşik Devletleri (ABD)'nden bildirilen suşlarda KPC hakim iken, Uzak Doğu, Hindistan ve Pakistan'dan bildirilen izolatlarda NDM beta-laktamazlar hakimdir3. OXA-48 ise ilk kez Türkiye'den bildirilmiş, daha sonra Orta Asya ve Avrupa'dan da bildirimler olmuştur4,5. Bu izolatlar genellikle çoklu dirençli olduğundan tedavi seçeneği son derece kısıtlıdır. Bu enfeksiyonların önlenmesinde rektal sürüntü örneklerinden tarama yapılması ve pozitif hastaların izolasyonu önerilmektedir1,6. Bu amaçla, direkt ekim üzerine ertapenem diski yöntemi, ertapenem içeren triptik soy buyyonda zenginleştirme, CHROMAgar KPC gibi yöntemler kullanılmakta ve önerilmektedir7,8,9. Ancak CHROMAgar KPC dışındaki yöntemlerde izolasyon süresi 96 saate kadar uzamaktadır. Bu da kolonize hastaların izolasyonunu geciktirmektedir.
Bu çalışmada, rektal sürüntü örneklerinin KDKP yönünden taranmasında 2 mg/L ertapenem içeren EMB agar besiyerinin, çeşitli uluslararası kılavuzlarda önerilen direkt ekim üzerine ertapenem diski yöntemi ve 2 mg/L ertapenem içeren triptik soy buyyonda zenginleştirme yöntemiyle karşılaştırılması ve hastanemizde izole edilen KDKP suşlarında hakim beta-laktamazların araştırılması amaçlanmıştır.
GEREÇ ve YÖNTEM
Zorlaştırıcı Simülasyon Testi
KDKP olarak önceden doğrulanmış sekiz klinik izolatın serum fizyolojik içerisinde 1 x 105-50 CFU/ml arasında 10 farklı dilüsyonu hazırlandı. Zorlaştırıcı simülasyon testi için her bir dilüsyonun içine son konsantrasyon 1 x 104 CFU/ml olacak şekilde imipeneme dirençli Acinetobacter baumannii, vankomisine dirençli Enterococcus faecium ve Candida albicans eklendi. Hazırlanan kültür karışımları üç farklı yöntemin KDKP taranmasındaki etkinliğini test etmek üzere kullanıldı.
Yöntem 1: Bu yöntem için 1 L EMB agar distile su içinde hazırlanıp otoklavlandı. Agar 50°C'ye kadar soğuduktan sonra içerisine 2 mg/L ertapenem (Merck Sharp Dohme, Türkiye) eklendi ve petrilere 4 mm yükseklik olacak şekilde dökülerek donmaya bırakıldı. Her bir dilüsyondan 100'er µl kültür karışımı 2 mg/L ertapenem içeren EMB agar yüzeyine ekilerek 37°C'de bir gece inkübasyona bırakıldı.
Yöntem 2: Her bir dilüsyondan 100'er µl kültür karışımı 10 µg ertapenem diski içeren 5 ml triptik soy buyyona ekilerek 37°C'de bir gece inkübe edildi. İnkübasyon sonrası ertapenemli triptik soy buyyondan EMB agara pasaj yapılarak tekrar bir gecelik inkübasyona bırakıldı.
Yöntem 3: Direkt ekim yöntemi için yine 100'er µl kültür karışımı antibiyotik içermeyen EMB agar yüzeyine ekildikten sonra ilk kadrana 10 µg ertapenem diski yerleştirilerek 37°C'de bir gece inkübasyona bırakıldı. Ertapenem diski etrafındaki 21 mm zon çapı içerisinde üreyen bakteriler değerlendirmeye alındı. Sınır değerin belirlenmesinde Pasteran ve arkadaşlarının10 önerileri dikkate alındı.
İnkübasyon sonrasında her üç yönteme ait tüm dilüsyonlarda laktoz-pozitif mukoid kolonilerin varlığı değerlendirildi.
Tarama Kültürlerinde Besiyerinin Değerlendirilmesi
Besiyerlerinin rektal sürüntü örneklerinde KDKP varlığını saptama yeteneğini test etmek için yoğun bakım ünitelerinde yatmakta olan hastalara ait 801 örnek zorlaştırıcı simülasyon testinde anlatıldığı şekilde üç farklı yöntemle ekilerek sonuçlar değerlendirildi.
Suşların Tanımlanması ve Duyarlılık Testleri
Herhangi bir yöntemle pozitif bulunan tüm suşlar rutin mikrobiyolojik yöntemlerle tanımlandı. Suşların imipenem, meropenem, ertapenem ve doripeneme direnç durumu E-test (BioMerieux, Fransa) yöntemiyle belirlendi. E-test sonuçları Clinical and Laboratory Standards Institute (CLSI) kriterlerine göre değerlendirildi11. Suşlarda beta-laktamaz varlığını doğrulamak üzere Clinical and Laboratory Standards Institute (CLSI) önerileri doğrultusunda Modifiye-Hodge testi (MHT) uygulandı11.
Polimeraz Zincir Reaksiyonu (PCR) ile Beta-Laktamaz Kodlayan Genlerin Belirlenmesi
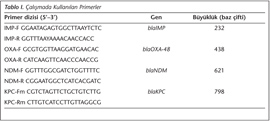
Herhangi bir yöntemle pozitif bulunan tüm suşlara Poirel ve arkadaşları12 tarafından önerilen primerler kullanılarak, blaIMP, blaKPC, blaNDM ve blaOXA-48 için multipleks PCR uygulandı (Tablo I). PCR koşulları 94°C'de 10 dakika; 36 döngü olacak şekilde 94°C'de 30 saniye, 52°C'de 40 saniye, 72°C'de 50 saniye ve sonrasında 72°C'de 5 dakika olarak uygulandı. PCR ürünleri %2 agaroz jel içinde 100 V'da bir saat yürütüldü.
BULGULAR
Zorlaştırıcı simülasyon testiyle ertapenemli EMB besiyeri (Yöntem 1) 50 CFU/ml'lik en düşük inokulümü saptayabilirken, bu değer ertapenemli triptik soy buyyonda (Yöntem 2) 1 x 105, direkt ekim yönteminde (Yöntem 3) ise 1 x 103 olarak bulunmuştur.
Rektal sürüntü örneklerinden bir veya daha fazla yöntemle farklı hastalardan izole edilen 33 izolatın 13 (%39.4)'ünde PCR ile herhangi bir direnç geni saptanamazken, 20 pozitif suşun 19 (%95)'unda blaOXA-48, 1 (%5)'inde ise blaIMP saptanmıştır. PCR ile beta-laktamaz geni gösterilen 20 suşun tamamı imipenem ve ertapeneme dirençli bulunmuş; suşların 2 (%10)'sinin doripenem ve meropeneme duyarlı olduğu belirlenmiştir (Tablo II). Direnç geni gösterilemeyen tüm suşlarda MHT negatif iken, blaOXA-48 saptanan bir suşta da MHT negatif bulunmuştur. Bu suş aynı zamanda doripenem ve meropeneme de duyarlıdır.
PCR sonuçlarına göre üç yöntemin duyarlılığı eşit (%80) olarak tespit edilmiştir. Testlerin özgüllük, pozitif prediktif değer (PPD) ve negatif prediktif değer (NPD) sonuçları sırasıyla Yöntem 1 için %15.4, %59 ve %33.3; Yöntem 2 için %23, %61.5 ve %42.9; Yöntem 3 içinse %61.5, %76 ve %66.6 olarak bulunmuştur. Çalışmalar sırasında, döküldükten sonra 48 saatten uzun bekleyen ertapenemli EMB besiyerlerinde yanlış pozitiflik oranının arttığı gözlenmiştir.
Her üç yöntem için ortalama süre (izolasyon + tanımlama + duyarlılık + MHT için), Yöntem 1'de 48 saat, Yöntem 2 ve 3'te ise 96 saat olarak belirlenmiştir.
TARTIŞMA
Çok ilaca dirençli (ÇİD) mikroorganizmalarla gelişen enfeksiyonları ve salgınları önlemeye yönelik uygulanan tüm enfeksiyon kontrol önlemlerine rağmen, KDKP enfeksiyonları tüm dünyada artan sıklıkta bildirilmektedir1,2. ÇİD mikroorganizmalarla asemptomatik kolonizasyonda sık karşılaşılan bir durumdur. Calfee ve arkadaşları13, yoğun bakım ünitelerinde yatan hastalarda KDKP kolonizasyon oranının %37 olduğunu saptamışlardır. Yüksek riskli ünitelerde aktif sürveyans çalışmasıyla KDKP ile kolonizasyonun belirlenmesi ve hızla temas önlemleri alınması sayesinde ciddi salgınların önlendiğine yönelik yayınlar mevcuttur6,14.
Birçok beta-laktam antibiyotik besiyerinde stabil olmadığı için, dirençli gram-negatif bakterilerin taramasında kullanılabilen ticari besiyerleri son derece sınırlıdır. KDKP taraması için Centers for Disease Control and Prevention (CDC)15 tarafından önerilen yöntem, çalışmamızda Yöntem 2 adıyla kullandığımız 10 µg ertapenem diski içeren 5 ml triptik soy buyyona ekim yöntemidir. Ancak bu yöntemle sonuç verme süresi ortalama dört gündür. Bu süre erken izolasyon önlemlerinin bu kadar önemli olduğu durumlarda kabul edilebilir bir süre değildir. Ben-David ve arkadaşları6, kolonize hastaların %12'sinde kolonizasyonun hastaneye yatıştan sonraki ilk 48 saat içinde oluştuğunu göstermişlerdir. Bu nedenle daha hızlı yöntemlere ihtiyaç vardır. Bu amaçla üretilen CHROMAgar KPC besiyeri ile izolasyon ve tanımlama süresi 48 saate düşürülmüştür9. Ancak bu besiyeri hem fiyatının pahalı olması hem de henüz Türkiye'de satışta olmaması nedeniyle kullanılamamaktadır. Bu nedenle bu çalışmada değerlendirmeye alınmamıştır.
KPC şüpheli bakteriler hangi yöntemle izole edilirse edilsin tüm suşlara doğrulama yapılmalıdır. MHT, karbapenemaz varlığı için duyarlılığı ve özgüllüğü yüksek bir doğrulama testi olarak bildirilmekte ve önerilmektedir11,16. Bununla birlikte özellikle genişlemiş spektrumlu beta-laktamaz üreten suşlarda yanlış pozitif sonuçlar da bildirilmiştir10,17. Çalışmamızda yanlış pozitif suşa rastlanmamış, OXA-48 pozitif bulunan 1 (%5) suşta MHT negatif bulunmuştur. Girlich ve arkadaşları16, NDM-1 üreten suşlarda MHT duyarlılığının %50 olduğunu, ancak besiyerine ZnSO4 eklenmesiyle duyarlılığın %85.7'ye yükseldiğini bildirmişlerdir.
Tarama besiyerlerindeki bu problemler nedeniyle araştırıcılar direkt örnekten ya da rektal sürüntüden PCR ile karbapenemazları tespit etmeye yönelik çalışmalar yapmaktadırlar. KPC ya da NDM-1 taşıyan K.pneumoniae suşlarında gerçek zamanlı PCR (Rt-PCR) yöntemiyle başarılı sonuçlar alınmaktadır18,19. Ancak bu yöntemler hem çok pahalı olmaları hem de karbapenem direncine yol açan bazı direnç genlerini ve mekanizmalarını kaçırması nedeniyle taramalarda çok fazla kullanım alanı bulamamıştır. Çalışmamızda izole edilen KDKP suşlarında hakim olan karbapenemaz OXA-48'dir. Dolayısıyla, KPC ve NDM-1'e yönelik bir Rt-PCR yöntemi kullanılsaydı, bu suşlar gözden kaçabilirdi.
Ertapenemli EMB besiyeri, zorlaştırıcı simülasyon testinde en yüksek performansı gösterdiğinden, dışkı örneklerinde az sayıda bakteriyi yakalayabilmesi bir avantajdır. Besiyerinin duyarlılık, özgüllük, PPD ve NPD değerleri direkt ekim üzerine ertapenem diski yöntemiyle eş değer, ertapenem içeren triptik soy buyyonda zenginleştirme yöntemine göre daha düşüktür. NPD'nin düşük olması, besiyerinde kullanılan ertapenem miktarıyla (2 µg/ml) ilişkili olabilir. Ertapenem miktarı CLSI11 sınır değerleri kullanılarak 0.25 µg/ml olarak değiştirildiğinde gerçek negatif sonuçların artacağı kanaatindeyiz. Ayrıca, kullanım sırasında besiyerinin taze olmasına özen gösterilmelidir. Zira taze hazırlanmayan besiyerlerinde yanlış pozitif sonuçlar artmaktadır.
Besiyerinde laktoz pozitif, mukoid Klebsiella kolonileri saf halde ürediğinden tanımlama ve duyarlılık için ek pasajlara ihtiyaç kalmamaktadır. Diğer yöntemlere göre 48 saat erken sonuç verilebildiğinden hastaların erken izolasyonu mümkün olmaktadır. Sonuç olarak, bu özellikleri nedeniyle, ertapenemli EMB besiyeri, özellikle bütçesi kısıtlı hastanelerde laboratuvar iş yükünü artırmaksızın güvenle kullanılabilecek bir besiyeridir.
KAYNAKLAR
- Centers for Disease Control and Prevention. Guidance for control of infections with carbapenem-resistant or carbapenemase-producing Enterobacteriaceae in acute care facilities. MMWR 2009; 58(10): 256-60. [Özet]
- Schwaber MJ, Carmeli Y. Carbapenem-resistant Enterobacteriaceae: a potential threat. JAMA 2008; 300(24): 2911-3.
- Bush K. Alarming β-lactamase-mediated resistance in multidrug-resistant Enterobacteriaceae. Curr Opin Microbiol 2010; 13(5): 558-64. [Özet]
- Gülmez D, Woodford N, Palepou MF, et al. Carbapenem-resistant Escherichia coli and Klebsiella pneumoniae isolates from Turkey with OXA-48-like carbapenemases and outer membrane protein loss. Int J Antimicrob Agents 2008; 31(6): 523-6. [Özet]
-
Carrer A, Poirel L, Eraksoy H, Cagatay AA, Badur S, Nordmann P. Spread
of OXA-48-positive carbapenem-resistant Klebsiella pneumoniae isolates
in Istanbul, Turkey. Antimicrob Agents Chemother 2008; 52(8): 2950-4.
[Özet] [Tam Metin] [PDF] -
Ben-David D, Maor Y, Keller N, et al. Potential role of active
surveillance in the control of a hospital-wide outbreak of carbapenem-resistant
Klebsiella pneumoniae infection. Infect Control Hosp Epidemiol 2010;
31(6): 620-6.
[Özet] [Tam Metin] [PDF] - Landman D, Salvani JK, Bratu S, Quale J. Evaluation of techniques for detection of carbapenem-resistant Klebsiella pneumoniae in stool surveillance cultures. J Clin Microbiol 2005; 43(11): 5639-41. [Özet] [Tam Metin] [PDF]
- Cohen Stuart J, Leverstein-Van Hall MA; Dutch Working Party on the Detection of Highly Resistant Microorganisms. Guideline for phenotypic screening and confirmation of carbapenemases in Enterobacteriaceae. Int J Antimicrob Agents 2010; 36(3): 205-10. [Özet]
- Panagea T, Galani I, Souli M, Adamou P, Antoniadou A, Giamarellou H. Evaluation of CHROMagar KPC for the detection of carbapenemase-producing Enterobacteriaceae in rectal surveillance cultures. Int J Antimicrob Agents 2011; 37(2): 124-8. [Özet]
-
Pasteran F, Mendez T, Guerriero L, Rapoport M, Corso A. Sensitive
screening tests for suspected Class A carbapenemase production in species Enterobacteriaceae.
J Clin Microbiol 2009; 47(6): 1631-9.
[Özet] [Tam Metin] [PDF] - Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing. Twenty-First Informational Supplement. 2011, CLSI Document M100-S21. CLSI, Wayne, PA.
- Poirel L, Walsh TR, Cuvillier V, Nordmann P. Multiplex PCR for detection of acquired carbapenemase genes. Diagn Microbiol Infect Dis 2011; 70(1): 119-23. [Özet]
-
Calfee D, Jenkins SG. Use of active surveillance cultures to detect
asymptomatic colonization with carbapenem-resistant Klebsiella pneumoniae
in intensive care unit patients. Infect Control Hosp Epidemiol 2008; 29(10):
966-8.
[Özet] [Tam Metin] [PDF] -
Gardam MA, Burrows LL, Kus JV, et al. Is surveillance for multidrug
resistant Enterobacteriaceae an effective infection control strategy in
the absence of an outbreak? J Infect Dis 2002; 186(12): 1754-60.
[Özet] [Tam Metin] [PDF] - Centers for Disease Control and Prevention. Department of Health and Human Services. Laboratory protocol for detection of carbapenem-resistant or carbapenemase-producing Klebsiella spp. and E.coli from rectal swabs. http://www.cdc.gov/ncidod/dhqp/pdf/ar/Klebsiella-or-Ecoli.pdf [accessed 27 June 2010].
- Girlich D, Poirel L, Nordmann P. Value of the modified Hodge test for detection of emerging carbapenemases in Enterobacteriaceae. J Clin Microbiol 2012; 50(2): 477-9. [Özet] [Tam Metin] [PDF]
-
Wang P, Chen S, Guo Y, et al. Occurrence of false positive results for
the detection of carbapenemases in carbapenemase-negative Escherichia coli
and Klebsiella pneumoniae isolates. PLoS One 2011; 6(10):e26356.
[Özet] [Tam Metin] [PDF] - Cole JM, Schuetz AN, Hill CE, Nolte FS. Development and evaluation of real-time PCR assay for detection of Klebsiella pneumoniae carbapenemase genes. J Clin Microbiol 2009; 47(2): 322-6. [Özet] [Tam Metin] [PDF]
- Diene S, Bruder N, Raoult D, Rolain JM. Real-time PCR assay allows detection of New Delhi metallo--lactamase (NDM-1)-encoding gene in France. Int J Antimicrob Agent 2011; 37(6): 544-6. [Özet]
İletişim (Correspondence):
Prof. Dr. Duygu Perçin,
Erciyes Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
38039 Kayseri, Türkiye.
Tel (Phone): +90 352 207 6666-23383,
E-posta (E-mail): duygu.percin@hotmail.com