Spiramisin ve Beta-Glukan Kombinasyonu Etkinliğinin Akut
Toksoplazmozlu
Fare Modelinde Araştırılması ve IL-10, IL-12 ve TNF-α Düzeylerinin Belirlenmesi
Investigation
of Combined Effectiveness of Spiramycin and Beta-Glucan in Mice Models of
Acute Toxoplasmosis and Determination of IL-10, IL-12 and TNF-α Levels
Özden
BÜYÜKBABA BORAL1, Gülden SÖNMEZ TAMER2, Sema KEÇELİ ÖZCAN2,
Neşe SÖNMEZ1, Halim İŞSEVER3,
Fatma TEKELİ4
1 İstanbul Üniversitesi İstanbul Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, İstanbul.
1 Istanbul University Faculty of Istanbul Medicine, Department of Medical Microbiology, Istanbul, Turkey.
2 Kocaeli Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Kocaeli.
2 Kocaeli University Faculty of Medicine, Department of Medical Microbiology, Kocaeli, Turkey.
3 İstanbul Üniversitesi İstanbul Tıp Fakültesi, Halk Sağlığı Anabilim Dalı, İstanbul.
3 Istanbul University Faculty of Istanbul Medicine, Department of Public Health, Istanbul, Turkey.
4 İstanbul Üniversitesi İstanbul Tıp Fakültesi, Deney Hayvanları Biyolojisi ve Biyomedikal Uygulama Teknikleri Anabilim Dalı,
İstanbul.
4 Istanbul University Faculty of Istanbul Medicine, Department of Experimental Animal Biology and Biomedical Practice,
Istanbul, Turkey.
ÖZET
Koksidiyan bir protozoon olan Toxoplasma gondii'nin neden olduğu toksoplazmoz, gebelik sırasında geçirildiğinde fetal enfeksiyon gelişimi için yüksek risk taşımaktadır. Enfekte olan/olma riski taşıyan gebelerde, parazitin fetüse geçişinin ve enfeksiyon gelişiminin önlenmesinde oral spiramisin tedavisi önerilmektedir. Diğer taraftan, beta-glukanın, immün sistemi stimüle ettiği ve fagositer hücrelerin aktivitesini artırdığı gösterilmiş; birçok enfeksiyonun tedavisinde immünomodülatör etkiye sahip olduğu belirtilmiştir. Bu çalışmada; deneysel olarak T.gondii ile enfekte edilen farelerde, beta-glukanın tek başına ve ayrıca spiramisin ile kombinasyonunun tedavi etkinliğinin ve interlökin (IL)-10, IL-12, tümör nekroz faktörü (TNF)-a sitokin düzeylerine etkili olup olmadığının araştırılması amaçlanmıştır. Bunun için, Hayvan Deneyleri Etik Kurulu onayı ile, her biri sekiz BALB/c tipi fareden oluşan dört deney grubu oluşturulmuş ve tüm fareler T.gondii RH suşu (Refik Saydam Hıfzıssıhha Merkezi, Salgın Hastalıklar Müdürlüğü, Parazitoloji Laboratuvarı, Ankara) suşu ile enfekte edilmiştir. Enfeksiyon, 2 x 102/ml trofozoit içeren süspansiyondan farelere intraperitoneal yolla 2 ml verilerek oluşturulmuştur. Enfeksiyondan 24 saat sonra, kontrol grubu dışında, beta-glukan grubuna 3 mg/gün beta-glukan [Poly-b-(1-> 3) glucopyranose] oral gavaj ile, spiramisin grubuna 200 mg/kg/gün spiramisin oral gavaj ile, beta-glukan-spiramisin (BG-S) grubuna 3 mg/gün beta-glukan ve 200 mg/kg/gün spiramisin birlikte aynı yolla verilmiş, aynı uygulamalara yedi gün devam edilmiştir. Sekizinci günde tüm fareler uyutularak, periton sıvıları alınmış ve Thoma lamında sayım yapılarak 1 ml'deki trofozoit sayıları belirlenmiştir. Ayrıca kalp kanları alınarak serum örneklerinde IL-10, IL-12 ve TNF-α düzeyleri ticari ELISA kiti (eBioscience Platinum, Avusturya) ile araştırılmıştır. BG-S grubundaki trofozoit sayısı kontrol, beta-glukan ve spiramisin gruplarındaki trofozoit sayısından anlamlı derecede düşük bulunmuştur (p< 0.05). Beta-glukan ve spiramisin gruplarındaki trofozoit sayısı kontrol grubuna göre anlamlı bir düşüş göstermiş (p< 0.05); ancak bu iki grup arasında farklılık görülmemiştir. Spiramisin ve BG-S gruplarında belirlenen IL-10 düzeyi kontrol grubu ile karşılaştırıldığında, anlamlı bir düşüş saptanmış (p< 0.05); spiramisin ve BG-S grubundaki IL-10 düzeyi, beta-glukan grubu ile karşılaştırıldığında anlamlı bir düşüş gözlenmemiştir (p< 0.05). Tüm gruplarda IL-12 düzeyleri arasında fark saptanmamış; beta-glukan, spiramisin ve BG-S gruplarındaki TNF-α düzeyinin kontrol grubuna göre anlamlı bir düşüş gösterdiği belirlenmiştir (p< 0.05). Sonuç olarak, ulaşılabilen literatür taramaları ışığında, akut toksoplazmozun tedavisinde beta-glukan + spiramisin kombinasyonu etkinliğinin incelendiği ilk araştırma olan çalışmamızın bulguları, bu iki madde arasında bir sinerji olduğu fikrini vermiştir.
Anahtar sözcükler: Toxoplasma gondii; beta-glukan; spiramisin; IL-10; IL-12; TNF-α.
ABSTRACT
Toxoplasmosis which is caused by Toxoplasma gondii, has a high risk of fetal infection development if the infection occurs during pregnancy. Treatment with oral spiramycin is recommended during pregnancy in order to prevent the transmission of protozoa to fetus and development of infection. Since beta-glucan is known to stimulate the immune system and increase the phagocytic activity of the cells, it has been shown to exhibit immunomodulatory effect on many infectious diseases. The objectives of this study were to investigate the effectiveness of beta-glucan alone and in combination with spiramycin and to determinate the levels of interlökin (IL)-10, IL-12 and tumor nekrosis factor (TNF)-a in mice experimentally infected with T.gondii. For this purpose, four experimental groups each consisting of eight BALB/c mice, were formed with the approval of Ethics Committee for the Animal Experiments. All the mice were infected with 2 ml of suspension containing 2 x 102/ml of trophozoite prepared from T.gondii RH strain (Refik Saydam National Public Health Agency, Parasitology Laboratory of Communicable Diseases Research Department, Ankara, Turkey), by intraperitoneal injection. Twenty-four hours after the infection, beta-glucan (3 mg/day) was given to the beta-glucan group, spiramycin (200 mg/kg/day) to the spiramycin group, beta-glucan (3 mg/day) plus spiramycin (200 mg/kg/day) to the beta-glucan-spiramycin (BG-S) group by oral gavage. The fourth group which was the control group was infected but untreated. The above administration was carried out for seven days. On the 8th day, under anaesthesia, 1 ml normal saline was given into the peritoneum, drawn back later and the number of trophozoites in 1 ml of peritoneal fluid was determined by counting them on the Thoma slide. Moreover, by drawing the heart blood; IL-10, IL-12, TNF-α levels were determined in serum samples by ELISA method (eBioscience Platinum, Austria). The number of trophozoites in the BG-S group was found significantly lower than the number of trophozoites in control, beta-glucan and spiramycin groups (p< 0.05). There was no significant difference between the beta-glucan and spiramycin groups, however the number of trophozoites in both groups was significantly lower than the number of trophozoites in the control group (p< 0.05). There was a certain decrease in IL-10 level in spiramycin and BG-S groups, compared to the control group, in addition when IL-10 levels in spiramycin and BG-S groups were compared with BG group, a significant decrease was noticed (p< 0.05). There was no difference in IL-12 levels between the groups, while there was a certain decrease in TNF-α level in beta-glucan, spiramycin, BG-S group in comparison to the control group. Within the reach of our literature survey, this study is the first research in which the effectiveness of the combination of beta-glucan and spiramycin in the treatment of acute toxoplasmosis was investigated. The results of our study suggested that there might be synergy between beta-glucan and spiramycin in the treatment of acute toxoplasmosis.
Key words: Toxoplasma gondii; beta-glucan; spiramycin; IL-10; IL-12; TNF-α.
Geliş Tarihi (Received): 25.11.2011 • Kabul Ediliş Tarihi (Accepted): 04.01.2012
GİRİŞ
Toksoplazmoz, bir hücre içi protozoonu olan Toxoplasma gondii'nin insanlarda oluşturduğu zoonotik bir enfeksiyondur. Sağlıklı bireylerdeki T.gondii enfeksiyonları genellikle asemptomatik seyirlidir. Bununla beraber hastaların %10-20'sinde akut enfeksiyon görülür1. Gebelik sırasında annede görülen T.gondii enfeksiyonu fetal enfeksiyon gelişimi için yüksek risk taşır. Örneğin; Amerika Birleşik Devletleri (ABD)'nde her yıl 500-5000 yenidoğanın konjenital toksoplazmozlu olduğu belirlenmiştir2. Toksoplazmozun standart tedavisinde primetamin-sülfadiazin kombinasyonu kullanılır. Ancak bu kombinasyonun yüksek derecede toksik etkilerinin olması, uzun süre kullanımını kısıtlar3,4. Ayrıca, teratojen etkisi nedeniyle gebelik süresi < 18 hafta olan kadınlarda kullanılmamaktadır. Bu nedenlerle, anneden bebeğe plasenta yoluyla geçişi ve bunu izleyen fetal toksoplazma enfeksiyonunu önlemede oral spiramisin tedavisi önerilmektedir. Makrolid bir antibiyotik olan spiramisinin iyi tolere edildiği, nadir yan etkilerinin olduğu ve plasenta dokusunda birikip fetal dolaşıma geçerek konjenital toksoplazmoz riskini yaklaşık %60 oranında azalttığı bilindiğinden, gebelerde akut ve konjenital toksoplazmozun tedavisinde spiramisin kullanılır1,2. Aynı gruptaki diğer makrolidlerle benzer etki mekanizmasına sahip olmasına karşın, konak hücre içine penetrasyonunun hızlı ve güçlü olması nedeniyle, spiramisinin toksoplazmoz tedavisindeki etkinliği daha üstündür. Örneğin; makrofaj içindeki spiramisin konsantrasyonu, serum konsantrasyonundan 10-20 kat daha yüksektir3.
Hem insanlarda hem de hayvanlarda akut toksoplazma enfeksiyonuna karşı dirençte NK, Th1 tip CD4+ T hücreleri ve antikorların önemli rol oynadığı bilinmektedir. Bu hücreler koruyucu etkilerini interlökin (IL)-1, IL-2, IL-12, interferon (IFN)-g ve tümör nekroz faktörü (TNF)-a gibi proinflamatuvar sitokinleri salgılayarak sağlar. Bununla beraber Th2 tip CD4+ T hücreleri tarafından salgılanan maddeler (örn. IL-10), Th1 hücrelerini baskılar ve onların sitokinlerine karşıt etki yaratır. Dolayısıyla IL-10, süpresif bir sitokin ve güçlü bir antiinflamatuvar ajan olarak kabul edilir4. Beta-glukanın fonksiyonel fagositik hücreler olan granülosit, monosit, makrofaj ve dendritik hücrelerin fagositoz yeteneğini artırdığı bilinmektedir5. Bu nedenle glukan türevi maddelerin bakteriyel, fungal, paraziter ve viral enfeksiyonların tedavisinde immünomodülatör olarak denendiği çok sayıda çalışma yapılmasına karşın, bu maddelerin biyolojik etkilerinin nasıl ortaya çıktığına ilişkin bilgiler kısıtlıdır. Beta-glukan, enfeksiyonlara karşı konağın immün sistemini stimüle ederek, hümoral ve hücresel immüniteyi değiştirir. Beta-glukan aracılığıyla NK, makrofaj, monosit ve nötrofillerin aktive olduğu, total lökosit sayısının arttığı, IL-1, TNF-α ve prostaglandin E2 üretiminin de uyarıldığı gösterilmiştir5,6.
Bu çalışmada; deneysel olarak T.gondii ile enfekte edilen farelerde, beta-glukanın tek başına ve ayrıca spiramisin ile kombinasyonunun tedavi etkinliğinin ve IL-10, IL-12, TNF-α sitokin düzeylerine etkili olup olmadığının araştırılması amaçlanmıştır.
GEREÇ ve YÖNTEM
Çalışmada altı haftalık 18-20 g BALB/c dişi fareler kullanıldı. Fareler İstanbul Üniversitesi, DETAE Deney Hayvanları Biyolojisi ve Biyomedikal Uygulama Teknikleri Anabilim Dalı Laboratuvarından temin edildi ve 20-22°C'de %50-60 nem oranında 12 saat aydınlık, 12 saat karanlık döngüye sahip ortamda, her kafeste dörder fare olacak şekilde deney boyunca izlendi. Yem ve suları ad-libidum olarak sağlandı. Çalışma için HADYEK (Hayvan Deneyleri Etik Kurulu)'den 2011/49 karar numarasıyla onay alındı.
Fareler, dört ayrı grup ve her bir grupta toplam sekiz adet olacak şekilde ayrıldı. Grup I, kontrol grubu; Grup II, beta-glukan tedavi grubu; Grup III, spiramisin tedavi grubu; Grup IV ise beta-glukan-spiramisin (BG-S) tedavi grubunu oluşturdu. Tüm fare grupları T.gondii RH suşu (Refik Saydam Hıfzıssıhha Merkezi, Salgın Hastalıklar Müdürlüğü, Parazitoloji Laboratuvarı, Ankara) trofozoitleri ile intraperitoneal yolla enfekte edildi. Bu amaçla, pasajı sürdürülen T.gondii RH suşu ile enfekte fareden 72 saat sonra alınan periton sıvısındaki trofozoitler, Thoma lamında sayılarak 2 x 102 trofozoit/ml olacak şekilde serum fizyolojik ile hazırlandı7. Bu süspansiyondan 2 ml periton içi yoldan verilerek tüm fareler enfekte edildi. Enfeksiyondan 24 saat sonra beta-glukan grubundaki farelere 3 mg beta-glukan [Poly-b-(1-> 3) glucopyranose; Mustafa Nevzat İlaç San. AŞ, İstanbul] 0.2 ml distile suda çözündürülerek oral gavaj ile verildi ve bir hafta boyunca aynı saatte aynı miktar ve yoldan olacak şekilde inokülasyona devam edildi8. Enfeksiyondan 24 saat sonra spiramisin grubundaki farelere 200 mg/kg/gün olacak şekilde spiramisin (Sanofi Aventis; Eczacıbaşı İlaç Pazarlama AŞ, İstanbul) 0.2 ml oral gavaj ile verildi ve bir hafta boyunca aynı saatte ve aynı miktarda uygulamaya devam edildi7. Enfeksiyondan 24 saat sonra BG-S grubuna 3 mg beta-glukan 0.2 ml ve 200 mg/kg/gün spiramisin 0.2 ml olacak şekilde oral gavaj ile verildi ve bir hafta boyunca aynı saatte ve aynı dozda tedaviye devam edildi.
Bir hafta sonra tüm fareler 0.1 mg/kg ketamin (IM) ile uyutularak kalp kanları alındı ve serumları ayrılarak -70°C'de saklandı. Ayrıca, tüm farelerin periton sıvıları 1 ml steril serum fizyolojik ile yıkanarak steril tüplere alındı ve Thoma lamında sayım yapılarak her bir farenin periton sıvısının ml'sindeki trofozoit sayısı hesaplandı. Serum örneklerinde IL-10, IL-12 ve TNF-α düzeyleri, ELISA (eBioscience Platinum, Avusturya) yöntemi ile belirlendi.
İstatistiksel değerlendirmeler, Kruskall-Wallis nonparametrik varyans analiziyle, çoklu karşılaştırmalar Newman-Keuls yöntemiyle yapıldı. İstatistiksel anlamlılık p< 0.05 ve iki yönlü olarak değerlendirildi.
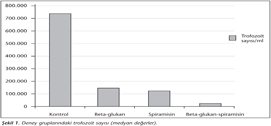
BULGULAR
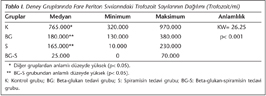
Araştırmamızda, T.gondii RH suşu ile enfekte edildikten sonra beta-glukan, spiramisin, beta-glukan + spiramisin kombinasyonuyla tedavi edilen üç ayrı deney grubundaki farelerin periton sıvılarındaki ortalama trofozoit sayısı ile, kontrol grubunun trofozoit sayıları karşılaştırılmıştır (Tablo I, Şekil 1). Kontrol grubundaki farelerin periton sıvısındaki trofozoit sayısının, diğer üç gruba göre istatistiksel yönden anlamlı derecede yüksek olduğu (p< 0.05) belirlenmiştir. Beta-glukan grubundaki ortalama trofozoit sayısı, BG-S grubuna göre anlamlı derecede yüksek (p< 0.05), spiramisin grubundaki ortalama trofozoit sayısı ise BG-S grubundan anlamlı derecede yüksek (p< 0.05) bulunmuştur. BG-S grubundaki ortalama trofozoit sayısı kontrol grubu ve diğer gruplara göre anlamlı derecede düşük (p< 0.05) olarak saptanmıştır. Beta-glukan ve spiramisin grupları arasında ise trofozoit sayısı bakımından anlamlı bir fark belirlenmemiştir. Ancak bu iki grup kontrol grubu ile karşılaştırıldığında trofozoit sayısı anlamlı derecede düşüktür (p< 0.05).
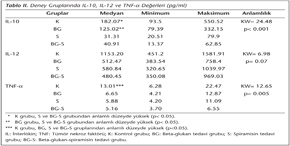
Çalışmamızda dört farklı deney grubundaki akut T.gondii enfeksiyonlu farelerde belirlenen IL-10, IL-12 ve TNF-α düzeyleri Tablo II'de gösterilmiştir. Spiramisin ve BG-S grubunda belirlenen IL-10 düzeyi, kontrol ve beta-glukan grubu değerleri ile ayrı ayrı karşılaştırıldığında her iki gruba göre de anlamlı bir düşüş saptanmıştır (p< 0.05). Tüm gruplarda IL-12 düzeyleri arasında farklılık tespit edilmemiştir. Beta-glukan, spiramisin ve BG-S grubundaki TNF-α düzeyinin ise, kontrol grubu ile karşılaştırıldığında anlamlı derecede düşük (p< 0.05) olduğu izlenmiştir.
TARTIŞMA
Gebelik sürecinde geçirilen T.gondii enfeksiyonunun plasentadan geçişinin ve/veya bunu izleyen fetal enfeksiyonun önlenmesinde oral spiramisin tedavisi önerilmektedir. Spiramisin kullanımı toksoplazmozlu gebelerde amniyotik sıvıda ve serumda polimeraz zincir reaksiyonu (PCR) sonucu negatif olsa bile doğuma kadar sürdürülmektedir. Fetal enfeksiyon olasılığı yüksek olan ya da fetal enfeksiyonlu gebelerde spiramisin ile başlanan tedavi 18 hafta sürdürülür; daha sonra primetamin + sülfadiazin ve folinik asit kombinasyonuyla tedaviye devam edilir1,2,9.
Beta-glukanın, nötrofillerin ve mononükleer hücrelerin antimikrobiyal aktivitesi ile makrofajların doğal fonksiyonel aktivitesinde artışa neden olduğu, güçlü bir hematopoietik etkiye sahip olduğu bilinmektedir5. Beta-glukanın antienfektif aktivitesi, deneysel hayvan modelleri üzerinde viral, paraziter, fungal ve bakteriyel enfeksiyonlarda da gösterilmiştir6,9. Bununla birlikte deneysel bakteriyel enfeksiyon modelleriyle daha fazla çalışılmış, örneğin; Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Mycobacterium leprae enfeksiyonlu modellerde, beta-glukan uygulanmasının mortaliteyi ve enfekte hayvanlardaki bakteri sayısını azalttığı gösterilmiştir9,10. Bu sonuçlar çalışmamızın bulgularıyla benzerlik göstermektedir. Bousquet ve arkadaşlarının11 beta-1-3 ve beta-1-6 glukanın koruyucu etkisini T.gondii'nin farklı suşlarıyla araştırdıkları çalışmada; RH suşu ile enfekte edilen ve 1 mg/kg intramusküler (IM) veya intravenöz (IV) beta-1-3 glukan uygulanan farelerde sağkalımın (%100) kontrol grubuna göre (%33) yüksek düzeyde arttığı belirlenmiştir. Ayrıca T.gondii prugniaud suşu kistleriyle enfekte edilen farelerde, 1 mg/kg (IM) beta-1-3 glukan ile tedavi sonrası beyin kistlerinin sayısında azalma olduğu gözlemlenmiştir11. Bulgularımıza benzer şekilde bir diğer çalışmada, T.gondii RH suşu ile enfeksiyondan önce IV uygulanan beta-1-3 ve beta-1-6 glukanın farelerin hayatta kalma süresini uzattığı ve bunun da makrofaj aktivasyonunun artmasından kaynaklandığı bildirilmiştir12. Yun ve arkadaşları8 da, Eimeria vermiformis ookistleri ile enfekte edilen ve bağışıklığı baskılanmış farelere oral gavaj ile 3 mg veya subkütanöz 500 µg beta-glukan uygulanan grupta, dışkıdaki ookist sayısının kontrol gruba göre çok azaldığını; beta-glukan verilmeyen farelerde ağır klinik belirtiler ve %50 mortalite gözlenirken, beta-glukan alan grupta mortalite görülmediğini ve klinik bulguların minimal düzeyde olduğunu rapor etmişlerdir. Ayrıca total IgG, IgG1, IgG2a, IgM ve IgA düzeylerinin, beta-glukan verilen grupta, kontrol gruba göre çok yüksek olduğu saptanmıştır8. Yine bir hücre içi paraziti olan Leishmania major'un virülan suşu ile enfekte edilen farelerde intraperitoneal uygulanan beta-glukanın, iki ayrı çalışmada da dalak ve karaciğerdeki amastigotları önemli ölçüde azalttığı gösterilmiştir13,14. Yukarıdaki çalışmalara benzer şekilde çalışmamızda da beta-glukan uygulanan grupta, kontrol grubuna göre trofozoit sayısı anlamlı bir düşüş göstermiştir (p< 0.05).
İmmünomodülatör aktivitesine ek olarak, beta-glukanın antibiyotiklerin antimikrobiyal etkinliğini artırdığı ve antibiyotiklere maruz kaldıktan sonra bakterilerin fagositoza ve hücre içi ölüme çok duyarlı hale geldiği bildirilmiştir15,16. Ayrıca bu etkinin, granülosit koloni stimüle edici faktör ve antibiyotiklerin birarada olmasıyla sağlandığı anlaşılmış; in vivo ve in vitro çalışmalarda polimorfonükleer lökositlerin varlığında koloni stimüle edici faktörlerin antibiyotiklerle sinerjistik etkileşim gösterdiği belirlenmiştir17. Çeşitli araştırmalarda oral olarak uygulanan beta-glukanın gastrointestinal sistemden absorbe edildiği, NK ve B hücre reseptörlerine bağlanarak aktive olmalarını sağladığı, ayrıca beta-glukanın bağırsaktaki Peyer plaklarından absorbe edilerek koloni stimüle edici faktör ve diğer sitokinlerin salınımını da artırdığı saptanmıştır18,19. Oral yolla kullanılan beta-glukanın, dalaktaki NK hücrelerinin ve peritoneal makrofajların lizozim aktivitesini artırdığı da bildirilmiştir20. Zenebergh ve arkadaşları3 makrofaj hücre kültürlerinde, spiramisin konsantrasyonunu, serum konsantrasyonundan 10-20 kat yüksek belirlemişlerdir. Tüm bu literatür verileri, çalışmamızda BG-S grubu farelerinin periton sıvısındaki T.gondii trofozoit sayısındaki anlamlı azalmayı (p< 0.05) açıklamaktadır.
Bazı araştırıcılar, beta-glukanın proinflamatuvar sitokin üretimini stimüle etmediğini, ancak nötrofil ve makrofajların mikrobisidal etkilerini artırdığını bildirmişlerdir21. Beta-glukan ile sefazolin kombinasyonunun S.aureus yara enfeksiyonunda sinerjik etkili olduğunu; E.coli ile enfekte sıçanlarda beta-glukan + sefalotin, beta-glukan + gentamisin ve S.aureus ile enfekte sıçanlarda beta-glukan + siprofloksasin ile sinerjizm olduğunu bildiren çalışmalar dikkat çekicidir17,22. Çalışmamızın bulguları da, spiramisin ile beta-glukan arasında bir sinerji olabileceği fikrini vermiştir. Ulaşabildiğimiz kaynaklar içinde spiramisin ile beta-glukanın hayvan modelinde birarada denendiği başka bir araştırmaya rastlanmadığından, bulgularımız yeni araştırma sonuçlarıyla desteklendiğinde, gebelerdeki toksoplazmoz tedavi süresinin kısalması sağlanabilecektir.
İnsan ve hayvanda akut T.gondii enfeksiyonu, hücresel ve hümoral immün yanıt mekanizmalarıyla kontrol altına alınmaktadır. NK ve Th1 tip CD4+ T hücreleri direnci sağlamada önemli olup, bunların salgıladığı IL-1, IL-2, IL-12, TNF-α ve IFN-g gibi proinflamatuvar sitokinler koruyucudur. IL-10 ise Th1 yanıtına karşıt etkilidir; doğrudan CD4+ T hücre çoğalmasını ve sitokin üretimini baskılar, ayrıca makrofajlar üzerine inhibitör etki gösterir23,24,25. Aynı zamanda IL-10, T.gondii enfeksiyonu tarafından üretimi indüklenen bir sitokindir24. Bu bulgular, T.gondii tarafından uyarılan IL-10'un konak bağışık yanıtını sınırladığını ve T.gondii çoğalmasını desteklediğini gösterir4. Ayrıca IL-10, IFN-g ile aktive olmuş makrofajlar tarafından üretilen nitrojen oksidi ve parazit öldürücü etkiyi inhibe etmektedir. T.gondii ile indüklenen IL-10 üretimi, parazitin IFN-g'ya bağımlı bağışık yanıttan kaçışında önemli bir stratejidir24. Çalışmamızda da kontrol grubu ile karşılaştırıldığında, spiramisin ve BG-S gruplarında IL-10 düzeyinde anlamlı bir düşüş gözlenmiştir. Bu iki grupta IL-10 düzeyinin düşük bulunması, IL-10'u indükleyen T.gondii trofozoit sayısının kontrol grubuna göre azalmış olmasıyla uyumludur. Beta-glukanın proinflamatuvar sitokin üretimini stimüle etmeden, özellikle nötrofil ve makrofajların mikrobisidal etkilerini artırdığı bilinmektedir26. Çalışmamızda bu bilgilerle uyumlu olarak, beta-glukan grubu farelerde IL-10 düzeyinde kontrol grubu ile karşılaştırıldığında anlamlı bir fark gözlenmemiştir. Bu durumda, beta-glukanın, toksoplazmozda IL-10un üzerinde etkisi olmadığı düşünülebilir.
T.gondii enfeksiyonuna karşı koruyucu yanıt sırasında bol miktarda üretilen IL-12 düzeyinde, çalışma gruplarımız arasında anlamlı bir fark belirlenmemiştir. Farelerde akut letal enfeksiyon oluşturan T.gondii RH suşu ile yapılan çalışmalarda yüksek düzeyde IL-12 ve IFN-g belirlenmesine karşın, bu sitokinlerin koruyucu etki göstermediği saptanmıştır27,28. Buradaki olası mekanizma; RH suşunun, IFN-g'nın mikrobisid etkisine karşıt rol oynayan IL-10'un indüklenmesi sonucunda IFN-g varlığına rağmen canlı kalabilmesiyle açıklanmaktadır29. Aynı açıklama çalışmamızın IL-12 bulguları için de geçerli olabilir.
Picka ve arkadaşları30 akut toksoplazmozlu farelerde beta-glukan ve/veya sülfadiazin uygulanmasından sonra, serum örneklerinde IL-10 düzeyini araştırdıkları çalışmalarında, en yüksek IL-10 düzeyini, T.gondii ile enfekte edilmeyen, sadece beta-glukan ile immünstimüle edilmiş grupta, en düşük IL-10 düzeyini ise sadece T.gondii ile enfekte ettikleri grupta belirlemişlerdir. Ayrıca T.gondii ile enfekte edildikten sonra; beta-glukan, sülfadiazin ve sülfadiazin + beta-glukan verilen fare gruplarında da IL-10 düzeyini, sadece T.gondii ile enfekte ettikleri kontrol gruptan yüksek bulmuşlardır30. Bu sonuçlar çalışmamızın IL-10 bulgularından farklıdır. Araştırıcılar IL-10 düzeyindeki azalma sonuçlarını, beta-glukanın CD8+ T hücrelerin reseptörlerine bağlanmasını engellemesiyle açıklamışlar, bunu da makrofaj, nötrofil, NK, dendritik hücreler ve fibroblast gibi hücrelerin yüzeylerinde bulunan reseptörlerin beta-glukanı tanıdığı bilgisine dayandırmışlardır.
Çalışmamızda TNF-α düzeyi, BG-S grubunda kontrol grubuna göre anlamlı derecede (p< 0.05) düşük bulunmuştur. Beta-glukanın, insan monositleri ve fare makrofajlarından IL-1, TNF-α ve prostaglandin E2 üretimi üzerinde uyarıcı olduğu gösterilmiştir8. Çalışmamızda beta-glukan uygulanan gruplarda kontrol grubuna göre TNF-α düzeyinin anlamlı bir yükselme göstermemesi, T.gondii enfeksiyonuyla indüklenen IL-10 tarafından TNF-αnın baskılanmasıyla açıklanabilir.
Literatür taramalarında ulaşabildiğimiz yayınlar arasında, çalışmamıza benzer bir makaleye rastlanmadığından, bu çalışma akut toksoplazmozlu hayvan modelinde beta-glukan-spiramisin kombinasyonunun tedavideki etkinliğinin araştırıldığı ilk çalışma olarak nitelendirilebilir. Çalışmamızın verileri, bu iki maddenin akut toksoplazmoz tedavisinde sinerjistik etkileşim gösterdiği fikrini vermiştir. Bulgularımız yapılacak başka araştırmalarla desteklendiğinde, T.gondii enfeksiyonu yönünden riskli olan gebelerde bu kombinasyon ile tedavi, hem tedavi süresini kısaltması hem de tedavi başarısını artırması nedeniyle önerilebilecektir.
KAYNAKLAR
- Montoya JG, Liesenfeld O. Toxoplasmosis. Lancet 2004; 363(9425): 1965-76. [Özet]
- Montoya JG, Remington JS. Management of Toxoplasma gondii infection during pregnancy. Clin Infect Dis 2008; 47(4): 554-66. [Özet] [Tam Metin] [PDF]
- Zenebergh A, Trouet A. Cellular pharmacokinetics of spiramycin in cultured macrophages. Ann Immunol (Paris) 1982; 133D(3): 235-44. [Özet]
- Tait ED, Hunter CA. Advances understanding immunity to Toxoplasma gondii. Mem Ins Oswaldo Cruz 2009; 104(2): 201-10. [Özet]
- Soltys J, Quinn MT. Modulation of endotoxin -and enterotoxin-induced cytokine release by in vivo treatment with b-(1-6)-branched b-(1-3)-glucan. Infect Immun 1999; 67(1): 244-52. [Özet] [Tam Metin] [PDF]
- Novak M, Vetvicka V. Glucans as biological response modifiers. Endocr Metab Immune Disord Drug Targets 2009; 9(1): 67-75. [Özet]
- Grujic J, Djurkovic-Djakovic O, Nikolic A, Klun I, Bobic B. Effectiveness of spiramycin in murine models of acute and chronic toxoplasmosis. Int J Antimicrob Agents 2005; 25(3): 226-30. [Özet]
- Yun CH, Estrada A, Van Kessel A, Gajadhar AA, Redmond MJ, Laarveld B. b-(1Æ3,1Æ4) oat glucan enhances resistance to Eimeria vermiformis infection in immunosupressed mice. Int J Parasitol 1997; 27(3): 329-37. [Özet]
- Dubey JP. History of Toxoplasma gondii-The first 100 years. J Eukaryot Microbiol 2008; 55(6): 467-75. [Özet]
- Tzianabos AO. Polysaccharide immunomodulators as therapeutic agents: structural aspects and biologic function. Clin Microbiol Rev 2000; 13(4): 523-33. [Özet] [Tam Metin] [PDF]
- Bousquet M, Escoula L, Pipy B, Bessieres MH, Chavant L, Seguela JP. Enhancement of resistance of mice Toxoplasma gondii by 2 polysaccharides beta 1-3, beta 1-6 (PSAT and Scleroglucan). Ann Parasitol Hum Comp 1988; 63(6): 398-409. [Özet]
- Nyugen BT, Stadsbaeder S. Effects of beta-1,3 glucan upon infection by T.gondii RH studies in vivo and in vitro (proceeding). Arch Int Physiol Biochim 1978; 86: 207-9.
- Goldman R, Jaffe CL. Administration of b-glucan following Leishmania major infection supresses disease progression in mice. Parasite Immunol 1991; 34(2): 137-45. [Özet]
- Al Tuwaijri AS, Mahmoud AA, Al Mofleh IA, Al Khuwaitir SA. Effect of glucan on Leishmania major infection in BALB/c mice. J Med Microbiol 1987; 23(4): 363-5. [Özet] [PDF]
- Kropec A, Lemmen SW, Grundmann HJ, Engels I, Daschner FD. Synergy of simultaneous administration of ofloxacin and granulocyte colony-stimulating factor in killing of Escherichia coli by human neutrophils. Infection 1995; 23(5): 298-300. [Özet]
-
Yasuda H, Ajiki Y, Shimozato T, et al. Therapeutic efficacy of
granulocyte colony-stimulating factor alone and combination with antibiotics
against Pseudomonas aeruginosa infection in mice. Infect Immun 1990;
58(8): 2502-9.
[Özet] [PDF] - Kaiser AB, Kernodle DS. Synergism between poly-(1-6)-beta-D-glucopyranosyl-(1-3)-beta-D-glucopyranose glucan and cefazolin in prophylaxis of staphylococcal wound infection in a guinea pig model. Antimicrob Agents Chemother 1998; 42(9): 2449-51. [Özet] [Tam Metin] [PDF]
- Sakurai T, Hashimoto K, Suzuki I, et al. Enhancement of murine alveolar macrophage functions by orally administered b-glucan. Int J Immunopharmacol 1992; 14(5): 821-30. [Özet]
- Hida TH, Kawaminami H, Ishibashi K, et al. Effect of GM-CSF on cytokine induction by soluble SCG in vitro in beta-glucan treated mice. Microbiol Immunol 2009; 53(7): 391-402. [Özet]
- Suzuki I, Hashimoto K, Ohno N, Tanaka H, Yadomae T. Immunomodulation by orally administered b-glucan in mice. Int J Immunopharmacol 1989; 11(7): 761-9. [Özet]
- Liang J, Melican D, Cafro L, et al. Enhanced clearence of a multiply antibiotic resistant Staphylococcus aureus in rats treated with PGG-glucan is associated with increased leukocyte counts and increased neutrophil oxidative burst activity. Int J Immunopharmacol 1998; 20: 595-614. [Özet]
- Tzianabos AO, Cisneros RL. Prophylaxis with the immunomodulator PGG glucan enhances antibiotic efficacy in rats infected with antibiotic-resistant bacteria. Ann N Y Acad Sci 1996; 797: 285-7. [Özet]
-
O'Garra A, Vieira P. T(H)1 cells control themselves by producing interleukin-10.
Nat Rev Immunol 2007; 7(6): 425-8.
[Özet] - Gazinelli RT, Oswald IP, James SL, Sher A. IL-10 inhibits parasite killing and nitrogen oxide production by IFN-g-activated macrophages. J Immunol 1992; 148(6): 1792-6. [Özet]
- Buke JM, Roberts CW, Hunter CA, Murray M, Alexander J. Temporal differences in the expression of mRNA for IL-10 and IFN-g in the brains and spleens of C57BL/10 mice infected with Toxoplasma gondii. Parasite Immunol 1994; 16(6): 305-14. [Özet]
- Patchen ML, Liang J, Vaudrain T, et al. Mobilization of peripheral blood progenitor cells by Betafectin PGG-Glucan alone and in combination with granulocyte colony-stimulating factor. Stem Cells 1998; 16(3): 208-17. [Özet]
- Hunter CA, Litton MJ, Remington JS, Abrams JS. Immunocytochemical detection of cytokines in the lymph nodes and brains of mice resistant or susceptible to toxoplasmic encephalitis. J Infect Dis 1994; 170(4): 939-45. [Özet]
- Schluter D, Kaefer N, Hof H, Wiestler OD, Deckert-Schluter M. Expression pattern and cellular origin of cytokines in the normal and Toxoplasma gondii-infected murine brain. Am J Pathol 1997; 150(3): 1021-35. [Özet] [PDF]
- Wille U, Villegas EN, Striepen B, Roos DS, Hunter CA. Interleukin-10 does not contribute to the pathogenesis of a virulent strain of Toxoplasma gondii. Parasite Immunol 2001; 23(6): 291-6. [Özet] [Tam Metin] [PDF]
- Picka MCM, Calvi SA, Lima CRG, Santos IAT, Marcondes-Machado J. Measurement of IL-10 serum levels in BALB/c mice treated with beta-1,3 polyglucose or sulfadiazine and acutely infected by Toxoplasma gondii. J Venom Anim Toxins incl Trop Dis 2005; 11(4): 540-56.
İletişim (Correspondence):
Doç. Dr. Özden Büyükbaba Boral,
İstanbul Üniversitesi İstanbul Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
Parazitoloji Bilim Dalı, Çapa, İstanbul, Türkiye.
Tel (Phone): +90 212 414 2000-31399,
E-posta (E-mail): obboral@yahoo.com