Mide Biyopsi Örneklerinden Helicobacter pylori'nin Tanımlanması ve Antimikrobiyal Direncinin Araştırılması
Detection of Helicobacter pylori and Antimicrobial Resistance in Gastric Biopsy Specimens
Umut ÇAĞDAŞ1, Feza OTAĞ1, Seda TEZCAN1, Orhan SEZGİN2, Gönül ASLAN1, Gürol EMEKDAŞ1
1 Mersin Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Mersin.
1 Mersin University Faculty of Medicine, Department of Medical Microbiology, Mersin, Turkey.
2 Mersin Üniversitesi Tıp Fakültesi, Gastroenteroloji Bilim Dalı, Mersin.
2 Mersin University Faculty of Medicine, Department of Gastroenterology, Mersin, Turkey.
ÖZET
Helicobacter pylori, gastrit, gastrik ve duodenal ülser, gastrik adenokarsinoma ve mukoza ile ilişkili lenfoid doku lenfomasında majör patojen olarak bildirilmektedir. H.pylori enfeksiyonlarının tanısında invazif olan (mide biyopsi örneği kültürü, histopatolojik inceleme, hızlı üreaz testi, moleküler yöntemler) ve olmayan (üre nefes testi, serolojik yöntemler, dışkı kültürü, dışkıda antijen/nükleik asit aranması) yöntemler kullanılmaktadır. Enfeksiyonun eradikasyonunda klaritromisin, amoksisilin ve metronidazol ile proton pompa inhibitörü veya ranitidin bizmut sitratın kombine kullanıldığı üçlü tedavi protokolü uygulanmaktadır. Ancak günümüzde antibiyotik direnci artmakta ve eradikasyon tedavisinin başarısı azalmaktadır. Bu çalışmada, mide antrum biyopsi örneklerinde H.pylori varlığının çeşitli yöntemlerle araştırılması ve antibiyotik duyarlılıklarının belirlenmesi amaçlanmıştır. Çalışmaya, dispeptik şikayetlerle Mersin Üniversitesi Tıp Fakültesi İç Hastalıkları Anabilim Dalı Gastroenteroloji Polikliniğine başvuran 149 hastadan (yaş aralığı: 17-83 yıl; 73'ü erkek) alınan mide antrum biyopsi örnekleri dahil edilmiştir. Biyopsi örneklerinde H.pylori varlığı kültür, polimeraz zincir reaksiyonu (PCR) ve üreaz testiyle; hastaların dışkı örneklerinde ise H.pylori'ye özgül antijen (HpSA) varlığı ELISA yöntemiyle araştırılmıştır. İzolatların tetrasiklin, amoksisilin, metronidazol ve levofloksasine karşı antimikrobiyal dirençleri E-test yöntemiyle belirlenmiştir. Klaritromisin direnci ise hem E-test hem de PCR-RFLP (restriction fragment length polymorphism) yöntemiyle saptanmıştır. Kültür yöntemiyle hastaların %29.6 (43/145)'sında, üreaz testiyle %55.2 (80/145)'sinde, HpSA testiyle %57 (65/114)'sinde ve PCR ile %71.3 (102/143)'ünde H.pylori pozitifliği tespit edilmiştir. H.pylori tanısında altın standart olarak; tek başına kültür yönteminin pozitif olması ya da kültürün negatif olduğu durumlarda, diğer üç testten (üreaz testi, PCR ve HpSA) en az ikisinin pozitif olması kabul edilmiştir. Buna göre kültür, PCR, HpSA ve üreaz testi yöntemlerinin duyarlılık ve özgüllükleri sırasıyla %52.4 ve %100, %96.3 ve %62.3, %80.3 ve %81.4, %86.6 ve %85.7 olarak saptanmıştır. E-test ile yapılan antibiyotik duyarlılık testinde klaritromisine %18.2, tetrasikline %9.1, metronidazole %45.5, levofloksasine %18.2 oranında direnç saptanırken amoksisiline karşı direnç bulunmamıştır. PCR pozitif 102 örneğin 94'ünde RFLP yöntemiyle klaritromisin direnci araştırılmış ve 17 (%18.1)'sinde klaritromisine direnç saptanmıştır. Bu suşların 11 (%64.7)'inde A2144G (2144. nükleotidde), 6 (%35.3)'sında ise A2143G (2143. nükleotidde) olmak üzere nokta mutasyonları belirlenmiştir. Çalışmamızda, H.pylori tanısında en duyarlı yöntemin PCR olduğu görülmüş; ancak özgüllüğünün düşük olması nedeniyle en az bir farklı yöntemle daha desteklenmesi gerektiği düşünülmüştür. Kültür yönteminin özgüllüğünün yüksek, duyarlılığının ise diğer yöntemlere göre oldukça düşük olduğu izlenmiş; üreaz ve HpSA testlerinin duyarlılık ve özgüllükleri birbirine benzer bulunmuştur. Sonuç olarak, endoskopinin yapılamadığı olgularda invazif olmayan, kolay uygulanabilir ve hızlı sonuç veren bir yöntem olan HpSA testinin tanı ve tedavinin takibinde kullanılabileceği kanısına varılmış; tedavi başarısızlığı durumunda ise kültür yapılarak antibiyotik duyarlılığının araştırılmasının gerektiği vurgulanmıştır.
Anahtar sözcükler: Helicobacter pylori; kültür; üreaz testi; ELISA; PCR-RFLP; antimikrobiyal direnç.
ABSTRACT
Helicobacter pylori is reported as the etiological agent of gastritis, gastric and duodenal ulcer, gastric adenoid carcinoma and mucosa-associated lymphoid tissue lymphoma. In the diagnosis of H.pylori infections invasive (culture, histopathological examination, rapid urease test and molecular tests) and non-invasive (urea breath test, serological tests, stool culture and stool antigen/nucleic acid tests) methods may be used. Clarithromycin, amoxicillin and combination of metronidazole and proton-pump inhibitor or ranitidine bismuth citrate triple treatment protocol is applied in order to treat and eradicate the infection. However, increasing rates of antibiotic resistance among H.pylori strains reduces the success of eradication therapy. The aim of this study was to investigate the presence of H.pylori in the gastric antral biopsy specimens and to determine the antimicrobial resistance of the isolates. A total of 149 gastric antral biopsy specimens obtained from patients (age range: 17-83 years; 73 were male) who admitted to Mersin University Faculty of Medicine Department of Internal Medicine Gastroenterology clinic with dyspeptic complaints were included in the study. H.pylori presence was investigated by culture, polymerase chain reaction (PCR) and urease test from gastric biopsy specimens, and H.pylori-specific antigen (HpSA) was investigated by ELISA in the stool samples of patients. Resistance to tetracycline, amoxicillin, metronidazole and levofloxacin was determined with E-test method. Clarithromycin resistance was determined both by E-test and PCR-RFLP (restriction fragment length polymorphism) methods. H.pylori was detected in 29.6% (43/145) of patients with culture, 55.2% (80/145) of patients with urease test, 57% (65/114) of patients with HpSA test and 71.3% (102/143) of patients with PCR. The sensitivity and specificity of culture, PCR, HpSA and urease tests were determined as 52.4% and 100%, 96.3% and 62.3%, 80.3% and 81.4%, 86.6% and 85.7%, respectively. According to the E-test results, resistance to clarithromycin was 18.2%, to tetracycline 9.1%, to metronidazole 45.5%, to levofloxacin 18.2% and no resistance was determined to amoxicillin. Clarithromycin resistance was searched in 94 of PCR positive 102 samples, and 17 (18.1%) of them yielded clarithromycin resistance. Of them 11 (64.7%) harbored A2144G (at 2144. nucleotide), and 6 (%35.3) harbored A2143G (at 2143. nucleotide) point mutations. In our study, PCR was determined as the most sensitive method, however due to its low specificity, the results should be confirmed with at least one of the other methods. The specificity of culture method was high, but sensitivity was found to be quite low compared with other methods. The sensitivity and specificity of urease and HpSA tests were found to be similar. In conclusion, in cases which endoscopy could not be done, non-invasive, rapid and practical HpSA method can be used in diagnosis and monitorization of the treatment. In the case of treatment failure, culture should be performed for antibiotic susceptibility testing of the isolate.
Key words: Helicobacter pylori; culture; urease test; ELISA; PCR-RFLP; antimicrobial resistance.
Geliş Tarihi (Received): 03.01.2012 • Kabul Ediliş Tarihi (Accepted): 30.03.2012
GİRİŞ
Dünya nüfusunun %50'den fazlasının Helicobacter pylori ile enfekte olduğu öngörülmektedir. Gelişmekte olan ülkelerde bu oran %70-90 iken, gelişmiş ülkelerde daha düşüktür (%25-50). Gelişmekte olan ülkelerde olduğu gibi ülkemizde de, enfeksiyon yaşamın ilk yıllarında kazanılmakta ve nüfusun %80'i 20 yaşına kadar enfekte olmaktadır1,2. H.pylori gastrit, gastrik ve duodenal ülser, gastrik adenokarsinoma ve mukoza ile ilişkili lenfoid doku tümörlerinde majör patojen olarak bildirilmektedir3,4.
H.pylori enfeksiyonlarının tanısında, endoskopi gerektirmeyen non-invazif testler (üre nefes testi, serolojik yöntemler, dışkı kültürü, dışkıda antijen/nükleik asit aranması) ve endoskopi gerektiren birçok invazif yöntem (mide biyopsi örneği kültürü, histopatolojik inceleme, hızlı üreaz testi, moleküler yöntemler) kullanılmaktadır5,6. Enfeksiyonun eradikasyonunda klaritromisin ve amoksisilin ya da metronidazol ile proton pompa inhibitörü veya ranitidin bizmut sitratın kombine kullanıldığı tedavi protokolü uygulanmaktadır7,8. Klaritromisin, H.pylori eradikasyonu için önerilen birçok tedavi protokolü içinde yer almakla birlikte, günümüzde klaritromisine dirençli suşlar artmakta ve eradikasyon tedavisinin başarısı azalmaktadır8,9.
Bu çalışmada, dispeptik şikayetleri olan hastalardan alınan mide-antrum biyopsi örneklerinde kültür, polimeraz zincir reaksiyonu (PCR) ve üreaz testi, dışkı örneklerinde ise ELISA yöntemiyle H.pylori antijen varlığının araştırılması ve izolatların antimikrobiyal dirençlerinin E-test ile belirlenmesi amaçlanmıştır. Ayrıca, klaritromisin direncine PCR-RFLP (restriction fragment length polymorphism) yöntemiyle bakılarak, varsa mutasyon bölgelerinin saptanması hedeflenmiştir.
GEREÇ ve YÖNTEM
Hastalar ve Örnekler
Mersin Üniversitesi Tıp Fakültesi İç Hastalıkları Anabilim Dalı Gastroenteroloji Polikliniğine Ocak 2009-Haziran 2010 tarihleri arasında dispeptik şikayetlerle başvuran ve üst gastrointestinal sistem endoskopisi uygulanan 149 hasta çalışma kapsamına alındı. Daha önce H.pylori tedavisi görmüş hastalar, son bir hafta içinde proton pompa inhibitörleri, antiasit, bizmut içeren bileşikler ve/veya antibiyotik alan hastalar çalışma dışı bırakıldı.
Her hastanın mide antrumunun farklı bölgelerinden ikişer adet biyopsi örneği alınarak, içerisinde Brucella sıvı besiyeri bulunan steril tüplere konuldu.
Kültür
Biyopsi örnekleri hiç bekletilmeden Brucella sıvı besiyeri içerisinde steril cam bagetlerle parçalanarak %7 defibrine at kanı, %1 vitox suplementi (Oxoid, İngiltere), H.pylori antibiyotik suplementi (Dent, Oxoid, İngiltere), 10 mg/L vankomisin, 5 mg/L trimetoprim, 5 mg/L sefsulodin ve 5 mg/L amfoterisin B içeren Columbia agar (Oxoid, İngiltere) besiyerlerine ekildi. Kültürler, mikroaerofil ortam sağlayan (%5 O2, %10 CO2, %85 N2) CampyGen kiti (CN 25-Oxoid, İngiltere) ile birlikte anaerop kavanoz içinde, 37°C'de dokuz gün inkübe edildi. Besiyerlerinde üreyen yaklaşık 0.5 mm çapında, hemolizsiz, gri, şeffaf, su damlasına benzeyen koloniler H.pylori yönünden değerlendirildi. Gram ile negatif boyanan, kıvrık, spiral morfolojiye sahip ve oksidaz, katalaz ve üreaz testleri pozitif bulunan bakteriler H.pylori olarak tanımlandı. Üre besiyerine ekilen bir kısım biyopsi örneğinin besiyeri rengini 37°C'de 30 dakika-24 saat içinde sarıdan pembeye dönüştürmesi üreaz pozitifliği olarak kabul edildi.
HpSA Testi
Endoskopi yapılan hastalardan alınan dışkı örneklerinde H.pylori antijeninin varlığı, HpSA testi (Diagnostic Bioprobes Srl, İtalya) kullanılarak mikro-ELISA yöntemiyle çalışıldı.
Antibiyotik Duyarlılık Testleri
İzolatların amoksisilin, klaritromisin, tetrasiklin, metronidazol ve levofloksasin duyarlılığı E-test (AB Biodisk, İsveç) ile araştırıldı. Saf olarak elde edilen H.pylori kültürlerinden alınan kolonilerle Brucella sıvı besiyeri içinde McFarland 3 bulanıklığına göre hazırlanan bakteri süspansiyonundan %7 at kanlı Mueller-Hinton agar yüzeyine ekim yapıldı. Plaklar mikroaerofilik ortamda (CampyGen içeren kavanozlar) 37°C'de 3-5 gün inkübe edildi. İnkübasyon sonunda elips şeklindeki inhibisyon zonunun E-test şeridi ile kesiştiği noktaya karşılık gelen antibiyotik konsantrasyonu MİK değeri olarak kabul edildi. Bu çalışmada metronidazol için ≥ 8 µg/ml, klaritromisin için ≥ 1 µg/ml, amoksisilin için ≥ 1 µg/ml, levofloksasin için ≥ 2 µg/ml, tetrasiklin için ≥ 4 µg/ml değerleri dirençlilik sınırı olarak kabul edildi10. Kontrol suşu olarak H.pylori NCTC 11637 kullanıldı.
PCR-RFLP ile H.pylori ve Klaritromisin Direncinin Belirlenmesi
Biyopsi örneklerinden DNA izolasyonu, modifiye klasik fenol-kloroform ve kloroform yöntemi kullanılarak gerçekleştirildi. Öncelikle biyopsi örneği 450 µL parçalayıcı tampon [13.3 mmol/L Tris-HCl (pH 8.0), 6.7 µmol/µl etilen-diamin-tetra-asetik asit, %0.67 sodyum dodesil sülfat ve 133 mg/mL proteinaz-K] ile karıştırıldı ve 56°C'de bir gece inkübe edildi. İnkübasyonun sonunda önce iki kez fenol-kloroform (1:1) ekstraksiyonu, daha sonra bir kez kloroform ekstraksiyonu gerçekleştirildi. DNA daha önceden soğutulmuş %96'lık etil alkolle çöktürüldü. DNA pelleti havada kurutulduktan sonra 25 µL nükleaz içermeyen steril suda çözdürüldü, sonrasında analiz edilinceye kadar -20°C'de saklandı ve PCR amplifikasyonunda kalıp DNA olarak kullanıldı.
H.pylori genomunun 23S rRNA gen bölgesinin 2105. nükleotid ve 2122. nükleotid arasında kalan 135 baz çift (bç)'lik bölgeyi hedef alan CRF-4 (5'-AGT GGA GGT GAA AATTCC-3') ve CRR-1 (5'-TAA GAG CCA AAG CCC TTAC-3') primerleri11 kullanılarak PCR ile amplifiye edildi. Klaritromisin direncinin belirlenmesi için amplifiye edilen bölgedeki 2143. kodondaki A-G mutasyonunun saptanması için MboII (A2143G) ve 2144. kodondaki A-G mutasyonunun saptanması için BsaI (A2144G) kesim enzimleriyle inkübe edilerek RFLP analizi uygulandı.
Her bir örneğin PCR amplifikasyonu 50 µL'lik reaksiyon hacimlerinde (5 µl 10x PCR tampon, 2 µmol/µl MgCl2, 0.2 µmol/µl dNTP karışımı, 0.25 pmol/µl her bir primer, 1.25 U Taq DNA polimeraz, 5 µl örnek DNA'sı) gerçekleştirildi. Amplifikasyon koşulları; 94°C'de 5 dakika başlangıç denatürasyonu, arkasından 35 siklus 94°C'de 1 dakika denatürasyon, 57°C'de 1 dakika bağlanma ve 72°C'de 1 dakika uzama basamakları ve arkasından 70°C'de 5 dakika son uzama basamaklarını içermekte idi. PCR ürünleri, %1'lik agaroz jel elektroforezinden sonra 0.5 µg/ml etidyum bromür ile boyandıktan sonra ultraviyole transilüminatörde görüntülendi.
BULGULAR
Çalışmaya alınan 149 hastanın 73'ü erkek 76'sı kadın olup, yaşları 17-83 yıl arasında (yaş ortalaması 47.8 ± 14.9 yıl) değişmektedir. Hastaların endoskopik tanıları; hiperemik gastropati (n= 37, %25), duodenal ülser (n= 31, %21), antral erozif gastrit (n= 24, %16), alt özefagus sfinkter gevşekliği (n= 21, %14), gastrik ülser (n= 15, %10), atrofik gastrit, (n= 12, %8), normal endoskopi (n= 6, %4), pilor stenozu (n= 2, %1) ve portal hipertansif gastropati (n= 1, %0.7) olarak belirlenmiştir. Hastalarda H.pylori enfeksiyonu tanısında altın standart olarak; tek başına kültür yönteminin pozitif olması ya da kültürün negatif olduğu durumlarda, kullanılan diğer üç testten (üreaz testi, PCR ve HpSA) en az ikisinin pozitif olması kabul edilmiştir.
Hastaların dördünde örnek uygun koşullarda gelmediği için kültür ve üreaz testi uygulanamamış; kalan 145 hastanın 43 (%29.6)'ünün kültüründe üreme saptanmış; 80 (%55.2)'inde ise üreaz testiyle pozitiflik tespit edilmiştir. Altı hastanın örneği yeterli olmadığı için PCR yöntemi uygulanamamış; kalan 143 hastanın 102 (%71.3)'sinde PCR ile H.pylori pozitif olarak saptanmıştır. Hastaların 114'ünün dışkı örneğinde H.pylori antijeni varlığı araştırılmış ve 65 (%57)'inde HpSA ile pozitiflik belirlenmiştir.
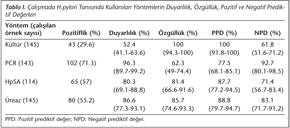
Çalışmamızda, toplam 149 hastadan 84'ünde, altın standart ölçütüne göre H.pylori pozitif olarak bulunmuştur. Hastaların kültür, PCR, HpSA ve üreaz testi yöntemlerinin duyarlılık ve özgüllükleri sırasıyla %52.4 ve %100, %96.3 ve %62.3, %80.3 ve %81.4, %86.6 ve %85.7 olarak saptanmıştır (Tablo I).
Kültürden izole edilen 43 H.pylori suşunun sadece 11'inde E-test yöntemiyle antibiyotik direnci araştırılabilmiştir. Suşların 5 (%45.5)'inde metronidazole, 2 (%18.2)'sinde klaritromisine, 2 (%18.2)'sinde levofloksasine ve 1 (%9.1)'inde tetrasikline direnç saptanmış; hiçbir izolatta amoksisilin direnci izlenmemiştir.
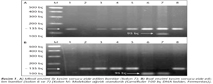
PCR ile H.pylori pozitif bulunan 102 hasta izolatının 94'ünde RFLP yöntemiyle klaritromisin direnci araştırılmış ve 17 (%18.1)'sinde klaritromisine direnç saptanmıştır. Bu 17 suşun 11 (%64.7)'inde A2144G, 6 (%35.3)'sında ise A2143G olmak üzere nokta mutasyonları belirlenmiştir (Resim 1).
TARTIŞMA
Tüm dünyada, özellikle de gelişmekte olan ülkelerde yaygın olarak bulunan H.pylori, insanlarda en sık görülen kronik bakteriyel enfeksiyon etkenlerinden biridir. Ülkemizde yapılan çalışmalar, H.pylori prevalansının %63-89 arasında değiştiğini göstermektedir12,17. Çalışmamızda da dispeptik şikayetleri olan hastalarda H.pylori pozitifliği %56.4 (84/149) oranında saptanmıştır.
H.pylori'nin tanısında kültür yöntemi birçok araştırıcı tarafından altın standart olarak kabul edilmekle birlikte, tanının doğruluğunun artırılması için, kültür ile birlikte üreaz testi ve/veya histoloji ve/veya dışkı antijen testleri ve/veya moleküler yöntemler gibi birden fazla yöntemin kullanılması önerilmektedir18,19. Bunlardan kültür, üreaz testi ve PCR yöntemleri zaman gerektiren, hasta için yüksek maliyete sebep olan ve endoskopik girişim gerektiren invazif yöntemlerdir. İnvazif olmayan HpSA testi ise, aktif enfeksiyon varlığını gösteren, hızlı ve ucuz bir yöntemdir. Yapılan bir meta-analizde, monoklonal HpSA testinin duyarlılığı %96.9, özgüllüğü %97.9 olarak bildirilmiştir20. Buna karşın ülkemizde yapılan çeşitli çalışmalarda HpSA testinin duyarlılık, özgüllük, pozitif (PPD) ve negatif prediktif (NPD) değerleri sırasıyla %69-92, %66-100, %81-100 ve %45-86 arasında değişen oranlarda saptanmıştır21,22,23,24. Bizim çalışmamızda, kullanılan monoklonal HpSA testiyle dışkı örneklerinin %57 (65/114)'sinde pozitiflik saptanmış ve bu yöntemin duyarlılık, özgüllük, PPD ve NPD değerleri sırasıyla %80.3, %81.4, %87.7 ve %71.4 olarak saptanmıştır. Bulgularımız diğer çalışmaların sonuçlarıyla uyumludur.
H.pylori tanısında kültür tek başına altın standart yöntem olarak kabul edilmesine rağmen, bakterinin oksijene olan duyarlılığı, örneğin alındığı yer, taşınma koşulları ve çalışanın tecrübesi gibi nedenlerden dolayı duyarlılığı oldukça düşüktür. Yapılan çalışmalarda, biyopsi örneklerinde kültür pozitifliğinin yaklaşık %30 oranında olduğu belirtilmekte; kültürün duyarlılığı %45-89, özgüllüğü %97-100 olarak verilmektedir19,25,26,27,28. Ülkemizde ise, Ankara'da 102 çocuk hasta üzerinde yapılan araştırmada, histoloji altın standart olarak kabul edildiğinde kültürün duyarlılığı %54.9, hızlı üreaz testinin duyarlılığı %89.2 olarak bildirilmiştir29. Kaklıkkaya ve arkadaşlarının30 200 antral mide biyopsi örneklerinde yaptıkları bir çalışmada, kültür ve hızlı üreaz testlerinin duyarlılık ve özgüllükleri sırasıyla %87.1 ve %99, %77.2 ve %92 olarak saptanmıştır. Afyon bölgesinde yapılan çalışmada da, histopatoloji altın standart olarak alındığında, kültür ve PCR yöntemlerinin duyarlılık ve özgüllüğü sırasıyla %61 ve %91, %88 ve %51 oranında rapor edilmiştir23. Kore'de ise 601 hastanın dahil edildiği bir çalışmada, kültür ve hızlı üreaz testi için duyarlılık ve özgüllük değerleri sırasıyla %56.2 ve %100, %80.4 ve %96.7 olarak bulunmuştur28. Çalışmamızda kültür pozitifliği %29.7 (43/145) olarak tespit edilmiş ve izolatların ancak 11 (%25.6)'inde antibiyotik duyarlılığı araştırılabilmiştir. Çalışmamızın verileri altın standart kriterlerine göre değerlendirildiğinde, kültür ve üreaz testinin duyarlılık ve özgüllükleri sırasıyla %52.4 ve %100, %86.6 ve %85.7 olarak saptanmış olup, bu çalışmalarla uyumlu olduğu görülmüştür.
Belçika'da 104 hastanın dahil edildiği bir araştırmada, kültür pozitifliği veya kültürün negatif olduğu durumlarda hızlı üreaz testi ve histolojik incelemenin birlikte pozitifliğini altın standart kabul edilerek, hızlı üreaz testinin duyarlılık ve özgüllüğü %90 ve %97, PCR yönteminin duyarlılık ve özgüllüğü ise %100 ve %97 olarak bildirilmiştir31. Kültür yönteminin altın standart olarak kabul edildiği bir başka çalışmada 36 hastada PCR yönteminin duyarlılık ve özgüllüğü sırasıyla %92 ve %72.7 olarak saptanmıştır32. Çalışmamızda ise altın standart ölçütüne göre üreaz testi ve PCR'nin duyarlılık ve özgüllükleri sırasıyla %86.6, %85.7 ve %96.3, %62.3 olarak belirlenmiştir. PCR, histoloji ve hızlı üreaz testlerinin karşılaştırıldığı bir çalışmada PCR'nin diğer konvansiyonel yöntemlere göre H.pylori saptanmasında daha yararlı olacağı bildirilmiştir33. Konya bölgesinde yapılan bir çalışmada, kültür yöntemi altın standart olarak alındığında, üreaz testi, histolojik inceleme ve HpSA testinin duyarlılık ve özgüllükleri sırasıyla; %97.5 ve %20.7, %72.5 ve %100, %75 ve %82.6 olarak bulunmuştur34.
H.pylori suşlarının antibiyotik duyarlılıklarının tespiti agar dilüsyon, disk difüzyon ve E-test gibi klasik yöntemlerle direnç gelişimine yol açan mutasyonların tespit edildiği PCR-RFLP gibi moleküler yöntemlerle yapılabilmektedir19. Tedavi başarısızlıkları; hastanın yaşı, sigara kullanımı, tedavi öncesi midedeki bakteri yükü, bakterinin genotipi, hastanın ilaç uyumu gibi nedenlere bağlanmaktadır. Ancak tedavi başarısızlıklarının büyük bir kısmı, ilk seçenek antibiyotiklere karşı direnç nedeniyle ortaya çıkmaktadır. H.pylori direnç tespiti için CLSI, agar dilüsyon yöntemini standardize etmiş ve kullanımını önermiştir; ancak E-test yöntemi, hem kullanım kolaylığı açısından hem de agar dilüsyonla benzer sonuçlar elde edildiğinden direnç tespitinde sıklıkla kullanılmaktadır10,19,35,36.
Metronidazole direnç oranları, bölgelere ve ülkelere göre değişmek üzere %15.9 ile %77.9 arasında bildirilmektedir25,37,38,39. Ülkemizde de metronidazolün yaygın kullanımı, direnç oranının yüksek olmasına neden olmaktadır. Yapılan çalışmalarda, ülkemizde metronidazol direnci %36.4 ile %62.5 oranları arasında değişmektedir29,40,41. Çalışmamızda E-test yöntemiyle metronidazol direnci %45.5 olarak belirlenmiştir. Amoksisilin direnci ile ilgili olarak ise çelişkili raporlar25,27,41 mevcut olup; bazı araştırıcılar H.pylori'de hiç amoksisilin direnci saptamazken25, bazıları çok düşük (%0.9)37, bazıları ise yüksek (%36.1)39 oranda direnç rapor etmişlerdir. Bizim çalışmamızda amoksisilin direnci tespit edilmemiştir.
H.pylori suşlarında tetrasiklin direnci ile ilgili olarak da yurt dışı yayınlarda değişik oranlar (%0-6.9) bildirilmektedir42,43,44. Ülkemizde yapılan bir çalışmada41 da, E-test ile %9.4 oranında tetrasiklin direnci saptanırken, bir başka çalışmada29 direnç izlenmemiştir. Çalışmamızda tetrasikline direnç oranı %9.1 olarak bulunmuştur. Ayrıca çalışmamızda saptanan %18.2 oranındaki levofloksasilin direnci de, Kantarçeken ve arkadaşlarının40 bildirdiği orandan (%5.9) yüksek, Branca ve arkadaşlarının45 bildirdiği orandan (%22.4) düşüktür.
Klaritromisin H.pylori eradikasyonunda en çok tercih edilen antibiyotiktir; ancak günümüzde klaritromisin direncinin giderek artması eradikasyon tedavisinin başarısını sınırlamaktadır9,17,19,37,45. Bu nedenle çalışmamızda klaritromisin direnci hem E-test hem de PCR-RFLP tekniğiyle araştırılmıştır. Klaritromisin direnci; Fransa'da27 2003 yılında yapılan bir çalışmada %30, Hindistan'da38 2003 yılında yapılan bir çalışmada %44.7, İngiltere'de46 2005 yılında yapılan bir çalışmada %11 ve Tayvan'da39 2006 yılında yapılan bir çalışmada %13.5 oranında saptanmıştır. Ülkemizde yapılan çalışmalarda ise H.pylori suşlarında klaritromisine direnç oranı %18.741, %18.229 ve %54.547 olarak bildirilmektedir. Çalışmamızda da E-test ile %18.2 (2/11) oranında klaritromisin direnci saptanmıştır. Klaritromisin direnci doğrudan mide biyopsi örneklerinden PCR-RFLP yöntemiyle araştırılabilmektedir. Bunun yanı sıra dirence neden olan mutasyonlar da saptanabilmektedir. Klaritromisine karşı direnç, 23S rRNA'nın peptidil transferazı kodlayan bölgesindeki nokta mutasyonuna bağlı olup, bu bölgede iki pozisyonda (2143 ve 2144. nükleotidler) nokta mutasyonları olmaktadır19. Ahmad ve arkadaşları48, 187 H.pylori izolatının dördünde PCR-RFLP ile klaritromisin direnci saptamışlar; bunların ikisinde A2142G, diğer ikisinde de A2143G nokta mutasyonları tespit etmişler ve PCR-RFLP yönteminin klaritromisin direncini saptamada hızlı ve kullanışlı olduğunu vurgulamışlardır. Liu ve arkadaşları49 da, klaritromisin kullanım öyküsü olan 153 ve olmayan 617 hastayla yaptıkları çalışmada, A2143G nokta mutasyonu prevalansını sırasıyla %32 ve %14 olarak bildirmişlerdir.
H.pylori tedavisinde amoksisilin, metronidazol ve klaritromisin gibi antibiyotiklerin yaygın olarak kullanıldığı Kolombiya'da 106 hasta üzerinde yapılan bir çalışmada, PCR-RFLP ile araştırılan direnç oranları sırasıyla; %1.9, %82 ve %3.8 olarak belirlenmiş; klaritromisin direnci olan dört suşun üçünde A2143G, birinde ise A2142G nokta mutasyonu saptanmıştır50. Ülkemizde 2008 yılında Sezgin ve arkadaşlarının51 yaptıkları çalışmada, H.pylori suşlarında %40.5 (15/37) oranında klaritromisin direnci tespit edilmiş ve izolatların %73.3 (11/15)'ünde A2144G, %26.7 (4/15)'sinde ise A2143G mutasyonları belirlenmiştir. Çalışmamızda ise, PCR ile saptanan H.pylori suşlarının %18.1 (17/94)'inde klaritromisine direnç saptanmış; bu 17 suşun 11 (%64.7)'inde A2144G, 6 (%35.3)'sında A2143G olmak üzere nokta mutasyonu izlenmiştir.
Sonuç olarak çalışmamızda, H.pylori'nin tanısında en duyarlı yöntemin PCR olduğu görülmüştür; ancak özgüllüğü düşük bulunduğundan sonuçların en az bir farklı yöntemle desteklenmesi gerekmektedir. Kültür yönteminin özgüllüğünün yüksek olmasına rağmen duyarlılığı diğer yöntemlere göre oldukça düşük saptanmıştır. Bu durum, H.pylori'nin nazlı, güç üreyen bir bakteri olması ve klinik örneğin alınması, laboratuvara taşınması ve işlenmesi aşamalarındaki koşulların izolasyon şansını doğrudan etkilemesi gibi faktörlerden kaynaklanabilir. Üreaz ve HpSA testlerinin duyarlılık ve özgüllükleri ise birbirine benzer olarak saptanmıştır. Endoskopinin yapılamadığı olgularda, invazif olmayan, kolay uygulanabilir ve hızlı sonuç veren bir yöntem olan HpSA testinin, tanı ve tedavinin takibinde kullanılabileceği düşünülmüştür. H.pylori'nin izolasyonundaki zorluklar nedeniyle, antibiyotik duyarlılık testleri az sayıda suş üzerinde yapıldığından, çalışmalarda elde edilen sonuçlar, toplumdaki gerçek antimikrobiyal duyarlılık oranlarını yansıtamamaktadır. Gelişmekte olan ülkelerde ve ülkemizde metronidazole karşı yüksek oranda direnç görülmesi nedeniyle tedavide birinci seçenek antibiyotik olarak kullanılması uygun değildir. Klaritromisin, düşük MİK değeri ve uygun farmakokinetik özellikleri nedeniyle H.pylori eradikasyonunda en çok tercih edilen antibiyotik olmakla birlikte, son yıllarda klaritromisin direncinin de arttığı izlenmektedir. Amoksisilin direnci ise, henüz bir sorun oluşturacak boyutlarda olmadığından tedavide ilk seçenek olarak tercih edilebilir ve klaritromisinle birlikte kombine edilebilir. Buna karşın, yıllar içinde direnç gelişiminde anlamlı artışlar olduğu ve gelecekte de olacağı öngörüsüyle, özellikle birinci basamak tedavide dikkatli olunmalıdır.
KAYNAKLAR
- Kadanalı A, Özkurt Z. Helicobacter pylori infeksiyonu: Epidemiyoloji, patogenez ve ilişkili hastalıkları. Klimik Derg 2004; 17(3): 146-50. [PDF]
- Kusters JG, van Vliet AHM, Kuipers EJ. Pathogenesis of Helicobacter pylori infection. Clin Microbiol Rev 2006; 19(3): 449-90. [Özet] [Tam Metin] [PDF]
-
Versalovic J. Helicobacter pylori. Pathology and diagnostic
strategies. Am J Clin Pathol 2003; 119(3): 403-12.
[Özet] [PDF] - Ciacci C, Mazzacca G. The history of Helicobacter pylori: a reflection on the relationship between the medical community and industry. Dig Liver Dis 2006; 38(10): 778-80. [Özet]
- Hirschl AM, Makristathis A. Methods to detect Helicobacter pylori from culture to molecular biology. Helicobacter 2007; 12(Suppl 2): 6-11. [Özet]
-
Uyanık MH, Aktaş O. Helicobacter pylori'nin mikrobiyolojik
tanısı. EAJM 2007; 39(3): 205-9.
[Özet] [Tam Metin] [PDF] - Suzuki H, Nishizawa T, Hibi T. Helicobacter pylori eradication therapy. Future Microbiol 2010; 5(4): 639-48. [Özet]
- Rimbara E, Fischbach LA, Graham DY. Optimal therapy for Helicobacter pylori infections. Nat Rev Gastroenterol Hepatol 2011; 8(2): 79-88. [Özet]
- De Francesco V, Giorgio F, Hassan C, et al. Worldwide H.pylori antibiotic resistance: a systematic review. J Gastrointestin Liver Dis 2010; 19(4): 409-14. [Özet] [PDF]
- Farshad S, Alborzi A, Japoni A, et al. Antimicrobial susceptibility of Helicobacter pylori strains isolated from patients in Shiraz, Southern Iran. World J Gastroenterol 2010; 16(45): 5746-51. [Özet] [Tam Metin] [PDF]
-
Matsumura M, Hikiba Y, Ogura K, et al. Rapid detection of mutations in
the 23S rRNA gene of Helicobacter pylori that confers resistance to
clarithromycin treatment to the bacterium. J Clin Microbiol 2001; 39(2): 691-5.
[Özet] [Tam Metin] [PDF] - Sandikci MU, Doran F, Koksal F, et al. Helicobacter pylori prevalence in a routine upper gastrointestinal endoscopy population. Br J Clin Pract 1993; 47(4): 187-9. [Özet]
- Us D, Hasçelik G. Seroprevalence of Helicobacter pylori infection in an asymptomatic Turkish population. J Infect 1998; 37(2): 148-50. [Özet]
- Altındiş M. Afyon bölgesinde Helicobacter pylori infeksiyon sıklığı. Genel Tıp Derg 2001; 11(3): 109-13. [Özet] [PDF]
- Özden A, Bozdayi G, Özkan M, Köse KS. Changes in the seroepidemiological pattern of Helicobacter pylori infection over the last 10 years in Turkey. Turk J Gastroenterol 2004; 15(3): 156-8. [Özet]
- Saribasak H, Salih BA, Yamaoka Y, Sander E. Analysis of Helicobacter pylori genotypes and correlation with clinical outcome in Turkey. J Clin Microbiol 2004; 42(4): 1648-51. [Özet] [Tam Metin] [PDF]
- Yücel T, Aygin D, Şen S, Yücel O. The prevalence of Helicobacter pylori and related factors among university students in Turkey. Jpn J Infect Dis 2008; 61(3): 179-83. [Özet] [PDF]
- van IJzendoorn MC, Laheij RJ, de Boer WA, Jansen JB. The importance of corpus biopsies for the determination of Helicobacter pylori infecion. Neth J Med 2005; 63(4): 141-5. [Özet] [PDF]
- Mégraud F, Lehours P. Helicobacter pylori detection and antimicrobial susceptibility testing. Clin Microbiol Rev 2007; 20(2): 280-322. [Özet] [Tam Metin] [PDF]
- Gisbert JP, Pajares JM. Stool antigen test for the diagnosis of Helicobacter pylori infection: a systematic review. Helicobacter 2004; 9(4): 347-68. [Özet]
- Durmaz-Çetin B, Gündüz A, Erdem L, Seber E, Sökmen M. Helicobacter pylori infeksiyonları ve dışkı antijen testinin tanıdaki değeri. Klimik Derg 2004; 17(3): 177-80. [PDF]
- Arikan S, Kocakusak A, Barut G, et al. Helicobacter pylori stool antigen test: results of a prospective study. Surg Today 2004; 34(4): 318-22. [Özet]
- Aktepe OC, Ciftçi IH, Safak B, Uslan I, Dilek FH. Five methods for detection of Helicobacter pylori in the Turkish population. World J Gastroenterol 2011; 17(47): 5172-6. [Özet] [Tam Metin] [PDF]
- Ceken N, Yurtsever SG, Baran N, et al. Comparison of Helicobacter pylori antibody detection in stool with other diagnostic tests for infection. Asian Pac J Cancer Prev 2011; 12(4):1077-81. [Özet]
- Storskrubb T, Aro P, Ronkainen J, et al. Antimicrobial susceptibility of Helicobacter pylori strains in a random adult Swedish population. Helicobacter 2006; 11(4): 224-30. [Özet]
- Gisbert JP, Abraira V. Accuracy of Helicobacter pylori diagnostic tests in patients with bleeding peptic ulcer: a systematic review and meta-analysis. Am J Gastroenterol 2006; 101(4): 848-63. [Özet]
- Tankovic J, Chaumette-Planckaert MT, Deforges L, et al. Routine use of real-time PCR for detection of Helicobacter pylori and of clarithromycin resistance mutations. Gastroenterol Clin Biol 2007; 31(10): 792-5. [Özet]
- Shin CM, Kim N, Lee HS, et al. Validation of diagnostic tests for Helicobacter pylori with regard to grade of atrophic gastritis and/or intestinal metaplasia. Helicobacter 2009; 14(6): 512-9. [Özet]
- Özçay F, Koçak N, Temizel IN, et al. Helicobacter pylori infection in Turkish children: comparison of diagnostic tests, evaluation of eradication rate, and changes in symptoms after eradication. Helicobacter 2004; 9(3): 242-8. [Özet]
- Kaklıkkaya N, Çubukçu K, Yazıcı Y, et al. Gastrointestinal yakınması olan hastalarda gram boyama, üreaz ve kültür testleri ile Helicobacter pylori varlığının belirlenmesi. İnfeksiyon Derg 2003; 17(3): 329-32. [Özet] [PDF]
-
Lage AP, Godfroid E, Fauconnier A, et al. Diagnosis of Helicobacter
pylori infection by PCR: comparison with invasive techniques and detection
of cagA gene in gastric biopsy specimens. J Clin Microbiol 1995; 33(10):
2752-6.
[Özet] [PDF] - Uyanık MH, Aktaş O, Özbek A, Yılmaz Ö, Ayyıldız A. Helicobacter pylori tanısında çeşitli yöntemlerin karşılaştırılması. İnfeksiyon Derg 2007; 21(3): 123-8. [Özet] [PDF]
- Weiss J, Tsang TK, Meng X, et al. Detection of Helicobacter pylori gastritis by PCR: correlation with inflammation scores and immunohistochemical and CLOtest findings. Am J Clin Pathol 2008; 129(1): 89-96. [Özet] [PDF]
- Kalem F, Ozdemir M, Baysal B. Investigation of the presence of Helicobacter pylori by different methods in patients with dyspeptic complaints. Mikrobiyol Bul 2010; 44(1): 29-34. [Özet] [PDF]
- Glupczynski Y, Broutet N, Cantagrel A, et al. Comparison of the E test and agar dilution method for antimicrobial suceptibility testing of Helicobacter pylori. Eur J Clin Microbiol Infect Dis 2002; 21(7): 549-52. [Özet]
- Best LM, Haldane DJ, Keelan M, et al. Multilaboratory comparison of proficiencies in susceptibility testing of Helicobacter pylori and correlation between agar dilution and E test methods. Antimicrob Agents Chemother 2003; 47(10): 3138-44. [Özet] [Tam Metin] [PDF]
- Boyanova L, Mentis A, Gubina M, et al. The status of antimicrobial resistance of Helicobacter pylori in eastern Europe. Clin Microbial Infect 2002; 8(7): 388-96. [Özet] [Tam Metin] [PDF]
- Thyagarajan SP, Ray P, Das BK, et al. Resistant Helicobacter pylori. Geographical difference in antimicrobial resistance pattern of Helicobacter pylori clinical isolates from Indian patients: Multicentric study. J Gastroenterol Hepatol 2003; 18(12): 1373-8. [Özet]
- Hu CT, Wu CC, Lin CY, et al. Resistance rate to antibiotics of Helicobacter pylori isolates in eastern Taiwan. J Gastroenterol Hepatol 2007; 22(5): 720-3. [Özet]
- Kantarçeken B, Yıldırım B, Karıncaoğlu M, Aladağ M, Hilmioğlu F. Helicobacter pylori and antibiotic resistance. Turk J Gastroenterol 2000; 11(2): 141-5. [Özet] [PDF]
- Göral V, Yıldız Zeyrek F, Gül K. Helicobacter pylori infeksiyonunda antibiyotik direnci. T Klin Gastroenterohepatol 2000; 11(2): 87-92.
- Kim JJ, Reddy R, Lee M, et al. Analysis of metronidazole, clarithromycin, and tetracycline resistance of Helicobacter pylori isolates from Korea. J Antimicrob Chemother 2001; 47(4): 459-61. [Özet] [Tam Metin] [PDF]
- Rozynek E, Dzierzanowska-Fangrat K, Celinska-Cedro D, et al. Primary resistance of Helicobacter pylori to antimicrobial agents in Polish children. Acta Microbiol Pol 2002; 51(3): 255-63. [Özet]
- Lang L, Garcia F. Comparison of E- test and disk diffusion assay to evaluate resistance of Helicobacter pylori isolates to amoxicillin, clarithromycin, metronidazole and tetracycline in Costa Rica. Int J Antimicrob Agents 2004; 24(6): 572-7. [Özet]
- Branca G, Spanu T, Cammarota G, et al. High levels of dual resistance to clarithromycin and metronidazole and in vitro activity of levofloxacin against Helicobacter pylori isolates after failure of therapy. Int J Antimicrob Agents 2004; 24(5): 433-8. [Özet]
- Elviss N, Owen R, Breathnach A, Palmer C, Shetty N. Helicobacter pylori antibiotic resistance patterns and risk factors in adult dyspeptic patients from ethnically diverse populations in central and south London during 2000. J Med Microbiol 2005; 54 (Pt 6): 567-74. [Özet] [Tam Metin] [PDF]
- Bağlan PH, Özden A. Helicobacter pylori'nin antibiyotiklere direnci. Güncel Gastroenteroloji 2003; 7(3): 220-3. [PDF]
- Ahmad N, Zakaria WR, Abdullah SA, Ahmad RM. Characterization of clarithromycin resistance in Malaysian isolates of Helicobacter pylori. World J Gastroenterol 2009; 15(25): 3161-5. [Özet] [Tam Metin] [PDF]
- Liu Z, Shen J, Zhang L, et al. Prevalence of A2143G mutation of H.pylori- 23S rRNA in Chinese subjects with and without clarithromycin use history. BMC Microbiol 2008; 8: 81. [Özet] [Tam Metin] [PDF]
- Alvarez A, Moncayo JI, Santacruz JJ, et al. Antimicrobial susceptibility and mutations involved in clarithromycin resistance in Helicobacter pylori isolates from patients in the Western Central Region of Colombia. Antimicrob Chemother 2009; 53(9): 4022-4. [Özet] [Tam Metin] [PDF]
- Sezgin O, Aslan G, Altıntaş E, et al. Detection of point mutations on 23S rRNA of Helicobacter pylori and resistance to clarithromycin with PCR-RFLP in gastric biopsy specimens in Mersin, Turkey. Turk J Gastroenterol 2008; 19(3): 163-7. [Özet]
İletişim (Correspondence):
Doç. Dr. Feza Otağ,
Mersin Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
Yenişehir Kampüsü, Mersin, Türkiye.
Tel (Phone): +90 324 341 2815,
E-posta (E-mail): fezaotag@yahoo.com