Bağışıklığı Baskılanmış Hastalarda Sıklıkla Saptanan Bir
Fırsatçı Patojen:
Burkholderia cepacia Kompleksi
An
Opportunistic Pathogen Frequently Isolated from Immunocompromised Patients:
Burkholderia cepacia Complex
Orhan BAYLAN
Gülhane Askeri Tıp Akademisi, Haydarpaşa Eğitim Hastanesi, Tıbbi Mikrobiyoloji Servisi, İstanbul.
Gülhane Military Academy of Medicine, Haydarpasa Training Hospital, Department of Medical Microbiology, Istanbul, Turkey.
ÖZET
Burkholderia cepacia kompleks, birbirleriyle yakın ilişkili 17 türden oluşan bir gruptur. Bu bakterinin uzun süre sadece bitki patojeni olduğuna inanılmış, ancak daha sonraları özellikle hastanede yatan, bağışıklık sistemi baskılanmış hastalarda yüksek düzeyde morbidite ve mortaliteye neden olan önemli bir fırsatçı patojen olduğu anlaşılmıştır. B.cepacia kompleks, başlıca bakteriyemi/sepsis, septik artrit, osteomiyelit, menenjit, peritonit, üriner ve solunum yolu enfeksiyonlarına neden olmaktadır. Kistik fibrozisli veya kronik granülomatöz hastalığı olan bireyler, B.cepacia kompleks enfeksiyonlarına yatkındırlar. B.cepacia kompleks, hastanelerde kullanılan dezenfektan maddeler ve intravenöz sıvılar gibi sıvı ortamlarda uzun süre canlı kalabilmekte ve kolaylıkla çoğalabilmektedir. Hastalar B.cepacia kompleks bakterilerini ya çevreden ya da hastadan hastaya bulaş yoluyla kazanırlar. B.cepacia kompleks bakterilerini tanımlamak, rutin mikrobiyoloji laboratuvarı için her zaman sabır gerektiren bir uğraştır. Bu laboratuvarlarda B.cepacia kompleks izolatlarının tanımlanması, genellikle selektif besiyerleri ve konvansiyonel biyokimyasal analizler ve/veya ticari sistemlerden oluşan bir kombinasyonun kullanılmasıyla sağlanır. Pseudomonas cepacia agar (PCA), oksidasyon-fermantasyon temelli polimiksin basitrasin laktoz agar (OFPBL) ve son zamanlarda geliştirilen B.cepacia selektif agar (BCSA), B.cepacia kompleks bakterilerinin izolasyonlarında yaygın olarak kullanılan besiyerleridir. B.cepacia kompleks üyeleri, API 20NE, Phoenix, MicroScan veya VITEK gibi uygun ticari testlerle tanımlanabilir. Moleküler teknikler, fenotipik tanımlamanın doğrulanması ve tür düzeyinin ötesinde ayırım yapılabilmesi için kullanılabilir. B.cepacia kompleks, aminoglikozidler, birinci ve ikinci kuşak sefalosporinler, antipsödomonal penisilinler ve polimiksinler gibi antimikrobiyal ajanlara intrensek olarak dirençlidir. B.cepacia kompleks bakterilerinde indüklenebilir kromozomal beta-laktamazların varlığına ve penisilin bağlayan proteinlerin değişimine bağlı olarak sıklıkla beta-laktamlara direnç gelişmektedir. B.cepacia kompleks bakterilerinde antibiyotik dışa atım (efluks) pompaları, kloramfenikol, trimetoprim ve florokinolonlara direnç gelişiminde aracılık eder. Antibiyotik baskısı altında tüm duyarlı antibiyotiklere hızlı bir şekilde direnç gelişebilmektedir. Bu derlemede, B.cepacia kompleks bakterilerinin sınıflandırılmaları, mikrobiyolojik özellikleri, virülans ve patogenez mekanizmaları, enfeksiyonlarının epidemiyolojik özellikleri, klinik tablosu, laboratuvar tanısı, antimikrobiyal direnç ve tedavisi, korunma ve kontrol önlemleri özetlenmiştir.
Anahtar sözcükler: Burkholderia cepacia kompleks; fırsatçı enfeksiyon; bağışıklığı baskılanmış hasta; kistik fibrozis.
ABSTRACT
Burkholderia cepacia complex is a group of 17 closely related species. For a long time B.cepacia complex is believed to be only a plant pathogen but later it has emerged as an important opportunistic pathogen causing morbidity and mortality in hospitalized patients. B.cepacia complex particularly causes bacteraemia/sepsis, septic arthritis, osteomyelitis, meningitis, peritonitis, urinary and respiratory tract infections. Patients with cystic fibrosis or chronic granulomatous disease are predisposed to B.cepacia complex infections. B.cepacia complex can survive for a long period of time and can easily multiply in aqueous environments such as disinfectant agents and intravenous fluids used in hospitals. Patients may acquire B.cepacia complex either from the environment or through patient-to-patient transmission. It has always been a tedious task for routine microbiology laboratory to identify B.cepacia complex. In these laboratories, the identification of B.cepacia complex isolates is generally performed using a combination of selective media, conventional biochemical analysis and/or commercial systems. Three media commonly used for isolation of B.cepacia complex are as follows: the Pseudomonas cepacia agar, the oxidation-fermentation based polymyxin bacitracin lactose agar, and more recently the B.cepacia selective agar. Members of the B.cepacia complex can be identified by available commercial tests, such as API 20NE, Phoenix, MicroScan or VITEK. Molecular techniques are useful for confirmation of phenotypic identification and discrimination beyond the species-level. B.cepacia complex is intrinsically resistant to antimicrobial agents such as aminoglycosides, first- and second-generation cephalosporins, antipseudomonal penicillins and polymyxins. B.cepacia complex bacteria often develop resistance to beta-lactams due to presence of inducible chromosomal beta-lactamases and altered penicillin-binding proteins. Antibiotic efflux pumps in B.cepacia complex bacteria mediate resistance to chloramphenicol, trimethoprim and fluoroquinolones. Under antimicrobial pressure, resistance can quickly develop to all susceptible antimicrobials. In this review, the classification and microbiological features of B.cepacia complex, mechanisms of virulence and pathogenesis, epidemiological properties, clinical spectrum, laboratory diagnosis, antimicrobial resistance and treatment, prevention and control measures were summarized.
Key words: Burkholderia cepacia complex; opportunistic infections; immunocompromised patient; cystic fibrosis.
Geliş Tarihi (Received): 19.07.2011 • Kabul Ediliş Tarihi (Accepted): 01.09.2011
GİRİŞ
İlk kez William Burkholder tarafından 1950 yılında çürümüş çiçek soğanı köklerinden izole edilen ve 1980'li yıllara kadar sadece bitki patojeni olduğuna inanılan Burkholderia cepacia kompleks bakterileri, insanlarda ilk kez 1972 yılında kistik fibrozisli bir hastada fırsatçı patojen, 1982 yılında 17 yaşındaki bir olguda ise pnömoni ve septisemi etkeni olarak soyutlanmıştır1,2,3,4,5. B.cepacia kompleks bakterilerinin aynı zamanda antifungal ve antinematodal etkilerinin yanı sıra bitki üremesini destekleyici özellikleri de bulunmaktadır. Bu özellikleri B.cepacia kompleks bakterilerini, biyolojik pestisit ve fertilizör olarak ilgi çekici hale getirmiştir. Dolayısıyla B.cepacia kompleks bakterileri, farklı etkileşim kapasitelerine sahip çok yönlü bakteriler olarak bilinmektedir1,6.
Önceleri yapılan klinik çalışmalarda önemi tam olarak belirlenemeyen B.cepacia kompleks bakterileri, başta kistik fibrozis veya kronik granülomatöz hastalığı bulunanlarda olmak üzere bağışıklık sistemi baskılanmış olgularda neden oldukları ciddi hastane enfeksiyonlarıyla günümüzde dikkat çekmektedir2,3,4,5,6,7,8,9,10,11. Ancak yine de birçok rutin klinik mikrobiyoloji laboratuvarında, bakteri tanımlanması aşamasında B.cepacia kompleks üyeleri göz ardı edildiğinden, klinik olgulardaki gerçek sıklıkları halen tam olarak bilinmemektedir5.
SINIFLANDIRMA
Burkholderia cinsi içinde bugüne kadar tanımlanmış 50'nin üzerinde tür bulunmaktadır4,6. B.cepacia, psödomonaslarla yakın ilişkili oldukları kabul edilerek önceleri Pseudomonas multivorans, Pseudomonas kingae ve yakın zamana kadar Pseudomonas cepacia olarak sınıflandırılmıştır. Ancak biyokimyasal özellikleri, antibiyotik duyarlılıkları ve hücresel yağ asitlerinde saptanan farklılıklar ve yapılan moleküler taksonomik çalışmalar, rRNA homoloji grup I'de bulunan bu bakterilerin psödomonaslardan ayrılarak rRNA homoloji grup II (Pseudomallei grup) altında Burkholderia adıyla yeni bir cins içine (B.cepacia kompleks, B.mallei, B.pseudomallei, B.pickettii ve B.gladioli gibi) aktarılmasını gerekli kılmıştır1,2,3,4,5,6,8,12,13,14.
B.cepacia, Burkholderia cinsi içinde tipik tür olarak tanımlanmaktadır1. DNA-DNA hibridizasyon deneyleri, multilokus dizi tiplendirmesi (MLST), 16S rRNA ve recA geni dizi analizi, tüm-hücre proteini ve yağ asidi analizleri gibi biyokimyasal ve moleküler taksonomik çalışmalar, aslında bu türün genomovar olarak tanımlanan farklı genetik türlerden meydana geldiğini ortaya koymuş ve isimlendirilen 10 farklı genomovar (I: B.cepacia; II: B.multivorans; III: B.cenocepacia IIIA, IIIB, IIIC, IIID; IV: B.stabilis; V: B.vietnamiensis; VI: B.dolosa; VII: B.ambifaria; VIII: B.anthina; IX: B.pyrrocinia; X: B.ubonensis) ve isimlendirilmeyen yedi farklı MLST alt grubu (Grup K, BCC1, BCC2, BCC3, BCC4, BCC5, BCC6) ile birlikte 17 türün tümüne birden bugün için B.cepacia kompleks ismi verilmiştir1,6,8,12,15.
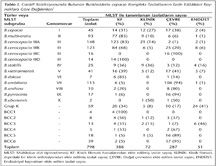
Kistik fibrozis hastalarında B.cepacia kompleks üyelerinin oluşturduğu enfeksiyonların yaklaşık %85-97'sinden B.multivorans ve B.cenocepacia türleri sorumlu tutulmakta olup, bu türler çoğunlukla solunum yolu örneklerinden izole edilmektedir1,11,15. Cardiff koleksiyonunda bulunan B.cepacia kompleks izolatlarının izole edildikleri kaynaklara göre dağılımları Tablo I'de sunulmuştur.
MİKROBİYOLOJİK ÖZELLİKLER
B.cepacia kompleks, aerobik, glukozu fermente etmeyen, katalaz pozitif, bir veya daha fazla polar flajeli sayesinde hareketli, üreaz aktivitesi değişken, DNAz aktivitesi, arjinin dehidrolaz, indol ve H2S testleri negatif, spor oluşturmayan, düz veya hafif kıvrık, 1-5 µm uzunluğunda ve 0.5-1.0 µm eninde, gram-negatif basillerdir3,6,7,9,16. Oksidaz reaksiyonu zayıf pozitif sonuç verir6. B.cepacia kompleks üyelerinin diğer mikrobiyolojik özellikleri Tablo II'de sunulmuştur3,6,7,9,16.
VİRÜLANS ve PATOGENEZ MEKANİZMALARI
B.cepacia kompleks, oldukça invazif bir bakteri grubudur. B.cepacia kompleks üyelerinin virülans faktörleri hakkında henüz yeterli bilgi olmamasına rağmen, bu faktörlerin kistik fibrozis patogenezinde kritik rol oynadıkları sanılmaktadır2,4. Başlıca virülans faktörleri olarak lipopolisakkarid, flajel, pili ve adhezin gibi yüzey yapıları, ekstraselüler lipaz, metalloproteaz, serin proteaz, hemolizin ve demir bağlayan sideroforlar sayılabilir2,4,17. B.cepacia kompleks üyelerinin lipopolisakkaridleri, konak hücresine zarar verebilecek düzeyde güçlü bir bağışık yanıta sebep olmaktadır. Flajel, pili ve 22 kDa adezinler, bakterinin hareket özelliğinde ve konak hücresine yapışmasında önemli role sahiptir. Ekstraselüler lipaz, metalloproteaz ve serin proteazlar, bakterilerin epitel hücreleriyle doğrudan etkileşiminde, ekstraselüler matriksin proteolizinde ve invazyonda etkin rol oynamaktadır4.
B.cepacia kompleks üyelerinin diğer önemli bir virülans özelliği, olumsuz çevre koşullarından ve konağın bağışıklık sisteminden korunmak için biyofilm oluşturmalarıdır. Biyofilm oluşturan B.cepacia kompleks üyelerinin planktonik hücrelere kıyasla antibiyotiklere daha dirençli oldukları gösterilmiştir. Bu özellik ayrıca patojenin kistik fibrozis akciğerinde kalıcı olmasına katkıda bulunmaktadır4. B.cepacia kompleks üyeleri, kistik fibrozis hastalarında enfeksiyonu başlatabilmek için solunum yoluna girdikten sonra konağın mukozal veya epitelyal yüzeylerine yapışmakta, buradan epitelyal bariyeri geçerek akciğer parankimine ve kapillerlere yayılmakta ve sonuçta bakteriyemiye neden olmaktadır. Epitelyal bariyeri geçerek kan dolaşımına girme yeteneği, kistik fibrozisli hastalarda pulmoner enfeksiyon oluşturan etkenler arasında sadece B.cepacia kompleks üyelerine özgüdür. Dolayısıyla kistik fibrozis olgularında pulmoner enfeksiyonu takiben sistemik yayılımın olması, nadir karşılaşılan bir durum olduğundan B.cepacia kompleks üyeleriyle enfekte olan hastalarda gelişen bakteriyemi/septisemi dikkat çekicidir4,17. Kistik fibrozis akciğerinde kalınlaşmış mukus tabakası, defektif mukus klerensine, antimikrobiyal peptidlerin azalmış etkisine ve artmış inflamatuvar yanıta bağlı olarak mikrobiyal kolonizasyon için ideal bir ortam oluşturmaktadır4. Kistik fibrozis hastalarında pnömoniye eşlik eden patolojik bulgular; hiyalin membran oluşumu, pulmoner ödem, nekrotizan granülomatöz inflamasyon, mikroapseler, nötrofil ve makrofajları içeren fibrinli eksüdayla dolu alveoller, lenfoplazmositik infiltrasyonla genişlemiş alveoler septalar ve lenf nodlarında nekrotizan granülomlar olarak özetlenebilir17. P.aeruginosa ile B.cepacia kompleks üyeleri arasında patogenez açısından sinerjik bir ilişkinin olabileceği ileri sürülmekte, diğer patojenlere bağlı olarak gelişen doku hasarının B.cepacia kompleks enfeksiyonunun gelişimini indüklediği belirtilmektedir2.
EPİDEMİYOLOJİK ÖZELLİKLER
Çeşitli Burkholderia türlerinin insan klinik örneklerinden izole edildiği belirtilse de, insan veya hayvan patojeni olarak genellikle B.cepacia kompleks üyeleri, B.mallei ve B.pseudomallei türleri akla gelmektedir. B.gladioli (önceki adı B.cocovenenans), B.fungorum ve B.thailandensis, insan enfeksiyonlarıyla ilişkili ender görülen diğer türlerdir6.
B.cepacia kompleks üyeleri, su kaynakları, toprak ve bitkiler başta olmak üzere doğal çevrede yaygın olarak bulunur5,6,7,8,10. Sağlık kurumlarında kişiden kişiye, enfeksiyöz çıkartılarla veya damlacıklarla doğrudan bulaşabildiği gibi, hastaların kontamine ettiği cihaz, alet ve eşyalar aracılığıyla dolaylı temasla da bulaşabilmektedir2,3,7,8,18. B.cepacia kompleks üyeleri, hastanelerin su kaynaklarında, ıslak yüzeylerinde, lavabo ve musluklarda, fizyolojik tuzlu su gibi çeşitli intravenöz ve irrigasyon solüsyonlarında, albuterol gibi nebülize edilen farmasötik ilaçlarda, musluk suyu veya distile suların kullanıldığı solunumsal tedavi donanımlarında, kateterlerde, diyaliz sıvıları ve makinelerinde, kan gazı ölçüm cihazlarında, termometrelerde, ventilatör sıcaklık sensörlerinde, intraaortik balon pompalarında, enteral beslenme amacıyla kullanılan kaplarda ve diğer kontamine hastane ekipmanlarında, povidon iyodür, klorheksidin ve benzalkonyum klorür dahil dezenfektan ve antiseptiklerde saptanabilmektedir. B.cepacia kompleks kaynaklı salgınların çoğunda temel bulaş yolu olarak, bu yüzden kontamine hastane malzemeleri suçlanmaktadır1,3,4,5,6,7,8,9,18,19. Özellikle yoğun bakım ünitelerinde olmak üzere söz konusu riskli hastalarda B.cepacia kompleks üyeleri, ciddi hastane enfeksiyonları oluşturabilmektedir. Bu nedenle, klinik örneklerinde B.cepacia kompleks üyesi üreyen hastaların izolasyonu son derece önemlidir2,10. Fenotipik ve genotipik çalışmalar, kronik kolonizasyon gösteren olguların çoğunda aynı B.cepacia kompleks suşunun uzun süreler var olduğunu kanıtlamıştır2. Kan kültür sistemlerinin veya dezenfektanların kontaminasyonu sonucu hastalarda saptanan psödobakteriyemi, kısa bir süre içinde birden fazla hastanın kanında B.cepacia'nın izolasyonunu takiben tanımlanmıştır6. Aynı zamanda B.cepacia kompleks üyeleri, hastane dışı sosyal temaslar yoluyla da sıklıkla ve çok hızla bulaşabilen bir patojendir5,20.
B.cepacia kompleks üyeleri için 1985 yılında selektif besiyeri geliştirildikten sonra bu bakterilerin kistik fibrozisli hastalardaki önemi daha net ortaya konmuş; bu hasta grubunda prevalansı %7'lerden %40'lara çıkmıştır5,10. Klinik çalışmalar, B.cepacia kompleks kaynaklı enfeksiyonların kistik fibroziste morbidite ve mortalite için bağımsız bir risk faktörü olduğunu göstermiştir6. Çeşitli çalışmalarda saptanan prevalans farklılıklarının (%0-40) nedenleri, selektif besiyerlerin kullanılmamasına bağlı bakterilerin izolasyonunda ve tanımlanmasında karşılaşılan güçlükler, olguların yaş dağılımlarındaki veya pulmoner hastalıklarının şiddetindeki farklılıklar olabilir. Kistik fibrozis seyri sırasında B.cepacia kompleks enfeksiyonu gelişiminde öne sürülen risk faktörleri, 10 yaşın üzerinde olmak, ilerlemiş pulmoner hastalık, uzun süreli aminoglikozid kullanımı, önceden hastaneye yatmış olmak ve B.cepacia kompleks kolonizasyonu/enfeksiyonu olan kistik fibrozisli kardeş varlığı öyküsüdür2.
Alvarez-Lerma ve arkadaşları9, 18 yataklı multidisipliner bir yoğun bakım ünitesinde 18 günlük bir süreçte üç bakteriyemi, bir pnömoni ve bir idrar yolu enfeksiyonu olgusundan oluşan B.cepacia salgını bildirmişlerdir. Kaynak arama çalışmaları kapsamında yapılan kültür işlemlerinde, hastalara uygulanan nemlendirici kremlerden B.cepacia izole edilmiştir. Çevresel ve klinik izolatların aynı klonal yapıya sahip oldukları tespit edilmiş, hastanenin tüm birimlerinden söz konusu kremlerin toplatılması sonrasında yeni olgu görülmemiştir9. Kaitwatcharachai ve arkadaşları21, aynı anda dokuz hemodiyaliz hastasında subklavyen kateter enfeksiyonuna sekonder gelişen B.cepacia bakteriyemisi nedeniyle, tüm hastalardan kateterlerin çekilmek zorunda kalındığını bildirmişlerdir. Enfeksiyon kaynağının, kateter bakımında kullanılan forsepsler olduğu tespit edilmiştir21. Koruk ve arkadaşları8, Haziran-Ağustos 2009 tarihleri arasında üroloji kliniğinde ürolojik girişim yapılan bağışıklık sistemi yeterli 227 hastanın 8 (%3.5)'inde sistoskopi aletinden kaynaklanan ve antibiyotik duyarlılık paternleri aynı olan B.cepacia'nın etken olduğu hastane kaynaklı idrar yolu enfeksiyonu salgını bildirmişlerdir8.
KLİNİK BULGULAR
B.cepacia kompleks üyeleri, birçok antimikrobiyal ve antiseptik ajana yüksek düzeyde intrensek dirençli olmasına rağmen, sağlıklı bireylerde genellikle düşük morbidite ve mortalite oranına sahiptir ve nadiren enfeksiyona sebep olmaktadır3,7,8,9,21,22,23,24. Sağlıklı bireyler, etkeni kontamine sıvılar içinde veya enjeksiyonla doğrudan alsalar bile, bu kişilerde sadece geçici ateş yükselmeleri ve kolonizasyon görülmektedir3. Ancak altta yatan hastalığı bulunan, bağışıklık sistemi baskılanmış, özellikle hücre içi mikroorganizmaların öldürülmesinde gerekli olan süperoksit ve reaktif oksidanların yapımında lökositlerinde defekt bulunan primer immünyetmezlikli, kronik granülomatöz hastalığı olan, onkolojik, transplantasyonlu, kistik fibrozisli veya sürekli kateter/tıbbi aygıt uygulanan riskli hastalarda üriner sistem enfeksiyonu, septik artrit, peritonit, bakteriyemi/sepsis, osteomiyelit, menenjit, akciğer apsesi ve pnömoni gibi hayatı tehdit eden fırsatçı enfeksiyonlara neden olabilmektedir3,4,5,6,7,8,9,10,25.
Kistik fibrozis, Kuzey Amerika ve Avrupa'daki Kafkas toplumlarında yaklaşık olarak 2750 canlı doğumdan birini etkileyen, pankreas fonksiyonlarında bozukluk, solunum yollarında kronik bakteriyel kolonizasyon ve enfeksiyonla karakterize, genetik, ölümcül bir hastalıktır6,13. Rekürrent ve kronik solunum yolu enfeksiyonları, kistik fibrozisli hastaların hayat süresini olumsuz yönde etkileyen ana nedenlerdendir15. Kistik fibrozis hastalarında izlenen B.cepacia kompleks üyelerine bağlı enfeksiyon oranı, %0-20 arasında değişmektedir. Amerika Birleşik Devletleri (ABD)'nde kistik fibrozis hastalarının yaklaşık %3'ünün B.cepacia kompleks üyeleriyle enfekte olduğu bildirilmiştir6. Kistik fibrozis hastalarında tüm B.cepacia kompleks üyeleri izole edilebilmesine rağmen, bu türlerin hastalardaki dağılımı orantısızdır6,15. ABD'de kistik fibrozis hastalarında görülen enfeksiyonların yaklaşık %85'inden B.multivorans ve B.cenocepacia'nın, Kanada ve bazı Avrupa ülkelerinde ise %80'inden B.cenocepacia'nın sorumlu olduğu bildirilmiştir6. Şener ve arkadaşları13, beş yıllık süreçte 55 kistik fibrozis olgusuna ait 976 balgam örneğini incelemişler; olgulardan sadece 2 (%3.64)'sine ait beş balgam örneğinden B.cepacia izole etmişlerdir.
B.cepacia kompleksin farklı türlerden (genomovar) oluşması nedeniyle, bu bakterilerin virülans ve patogenezlerinde önemli farklılıklar bulunmaktadır20,21. Bu nedenle kistik fibrozis hastalarında B.cepacia kompleks üyeleri, asemptomatik taşıyıcılık veya basit kolonizasyondan, akciğer fonksiyonlarının yavaş bozulmasıyla ilişkili kronik solunum yolu enfeksiyonlarına ve olguların %20'sinde izlenen, akut, hızlı progresyon gösteren, sıklıkla fatal, nekrotizan, fulminan pnömoni, hızla gelişen ateş ve bakteriyemi/sepsise kadar giden "Cepacia Sendromu"na neden olmaktadır2,3,4,5,6,7,8,10,11,17,18,23,25,26. Pnömoni gelişen çoğu hastanın akciğer grafisinde lobüler infiltrasyon görülürken, tabloya nadiren kavitasyon ve plevral efüzyon da eşlik eder. Olgularda mortalitenin %28.6 oranında olduğu bildirilmektedir17. Demir ve arkadaşları17, kistik fibrozis veya kronik granülamatöz hastalığı olmayan, ancak diyabeti bulunan ve hemodiyaliz tedavisi gören 50 yaşındaki bir kadın hastada, radyolojik olarak apse ve kavitasyon görünümü nedeniyle aspergillozu düşündüren, siprofloksasin tedavisine yanıt veren bir B.cepacia pnömonisi saptamışlardır. Ayrıca B.cepacia kompleks üyeleri, maligniteli hastalarda kateterle ilişkili bakteriyemi ve yoğun bakım ünitesinde yatan hastalarda ventilatörle ilişkili hastane kökenli pnömonilere de neden olmaktadır8,18,23,26. Hastanede kazanılan gram-negatif bakteriyemi nedenleri arasında dördüncü sırada yer aldığı bildirilen B.cepacia kompleks, özellikle bağışıklık sistemi zayıflamış kanser olgularında daha sık görülmektedir. Bu tip hastalarda, mortaliteyi %33-38 oranında artıran etken olarak bildirilmiştir20.
LABORATUVAR TANISI
B.cepacia kompleks, hastalar arasında kolay bulaşabilmesi ve birçok antibiyotiğe dirençli oluşu ile özellikle belirli hasta grupları için hızlı ve güvenilir tanı uygulamalarına ihtiyaç gösteren önemli bir bakteriyel patojen olarak karşımıza çıkmaktadır11.
İzolasyon
B.cepacia kompleks üyeleri, %5 koyun kanlı agar, çikolatamsı agar, MacConkey agar veya eozin metilen mavisi (EMB) agar gibi rutin kullanılan besiyerlerinde kolaylıkla üreyebilen mikroorganizmalardır. Kanlı agardaki kolonileri genellikle benekli, kabarık, opak ve yumuşak kıvamdadır. Bazı türler kahverengi, kırmızı ya da eflatun pigment oluşturabilir. B.cepacia, 4°C'de üreyemez. EMB besiyerinde 2-3 gün içinde üreyebilen bakterilerin, 4-5 gün bekletilen plaklardaki kolonileri koyu pembe, kırmızı renkte görülebilir. B.cepacia kompleks türleri, MacConkey agarda uzun bir inkübasyon periyodundan sonra (4-7 gün) laktoz oksidasyonu nedeniyle koyu pembe veya kırmızı pigmentli, benekli ve yapışkan koloniler oluşturur2,6,13. Üç şekerli demirli besiyerlerinde açık sarı pigment yapabilir. B.cepacia kompleks türleri, çamur gibi kokar. Karışık mikroflorası olmayan doku örneklerinden ya da steril vücut sıvılarından izolasyon için bu besiyerleri kullanılabilir6.
Karışık mikrofloralı klinik örneklerde izolasyonları güç olduğundan, B.cepacia kompleks üyelerinin izolasyonunda ticari olarak temini mümkün çeşitli selektif besiyerlerinin kullanılması önerilmektedir2,3,6,13. EMB veya MacConkey agarda yoğun olarak üreyen psödomonas suşları ve enterik bakteriler, örnekte bulunabilecek olan daha yavaş üreyen B.cepacia kompleks üyelerini maskeleyip yanlış negatif sonuçlara yol açabilmektedir13. Selektif besiyerleri içinde Pseudomonas cepacia (PC) agar (BD Diagnostics, Franklin Lakes, N.J.), selektif ajanlar olarak kristal viyole, safra tuzları ve iki antimikrobiyal ajan (tikarsilin, polimiksin B) içermektedir. PC agarda indikatör olarak fenol kırmızısı bulunmaktadır1,3,6. Gilligan ve arkadaşları27, B.cepacia'yı PC agarda 35 kistik fibrozis hastasının solunum salgılarından izole etmişken, MacConkey agarda etkeni sadece 21 hastada saptamışlardır.
B.cepacia'nın izolasyonu için PC agardan daha az selektif olan oksidasyon-fermantasyon temelli, 300.000 U/L polimiksin B, 200 U/L basitrasin ve 10 g laktoz içeren OFPBL agar (BD Diagnostics) geliştirilmiştir. OFPBL agarda bulunan brom timol mavisi indikatörü, besiyerinde renk değişimi ile B.cepacia izolatlarının saptanmasına yardımcı olmaktadır. Welch ve arkadaşları28, kistik fibrozisli hastalara ait klinik örneklerin OFPBL agara ekilmesi sonucu 58 hastadan B.cepacia izole etmişler; buna karşın bakteriyi MacConkey agarda sadece 19 hastada üretmişlerdir. OFPBL besiyerinde B.gladioli kolonileri, çok miktarda sarı pigment yaptığından B.cepacia kolonileriyle karışabilmektedir. B.cepacia ile B.gladioli, lizin dekarboksilaz etkinliği, maltoz ve laktoz fermantasyon deneyleriyle ayırt edilebilir3. Diğer selektif besiyerleri arasında B.cepacia medium (BCM) (Mast Diagnostics, İngiltere) ve B.cepacia selektif agar (BCSA) (%1 laktoz ve %1 sükroz içeren kazein, 600 U/ml polimiksin B, 10 µg/ml gentamisin ve 2.5 µg/ml vankomisinli maya ekstraktı) (Hardy Diagnostics, CA, ABD) bulunmaktadır1,3,6.
B.cepacia kompleks türleri, üç günlük inkübasyon sonunda selektif besiyerlerinde gözle görülebilir koloni oluşturmaktadır. BCSA, PC agar veya OFPBL agar gibi selektif besiyerlerinde S tipi, düzgün kenarlı veya bazen mukoid koloniler yapar. Çok merkezli bir çalışmada bu besiyerleri karşılaştırılmış; PC veya OFPBL agara kıyasla BCSA agarın daha özgül ve duyarlı olduğu tespit edilmiştir6. Coenye ve arkadaşları12, B.cepacia kompleks üyelerinin izolasyonunda klinik izolatlar için BCM ve BCSA gibi selektif besiyerlerinin, çevresel izolatlar için ise Tripan mavisi tetrasiklin (TB-T) ve P.cepacia polisiklik hidrokarbon medium (PCAT) gibi daha az selektif besiyerlerinin kullanılmasını tavsiye etmişlerdir.
B.cepacia kompleks üyeleri, beş günlük bir inkübasyon periyodu sonunda sıvı bazlı kan kültür sistemlerinde kolaylıkla üreyebildiklerinden, lizis santrifügasyon gibi özel kan kültür sistemlerinin kullanılmasına veya inkübasyon periyodunun uzun tutulmasına gerek yoktur.
Tanımlama
Fenotipik olarak birçok B.cepacia kompleks üyesinin birbirlerine çok benzerlik göstermesi nedeniyle rutin klinik mikrobiyoloji laboratuvarlarında bu bakterilerin doğru tanımlanması çok zordur. Sadece B.multivorans, B.vietnamiensis ve B.stabilis türleri, nispeten basit biyokimyasal testlerle ayırt edilebilir1,6. Selektif besiyerlerinde Stenotrophomonas maltophilia, Alcaligenes spp. ve bazı P.aeruginosa suşları da üreyebildiğinden izolatların, güvenilir, standart bir tanımlama sistemiyle doğrulanması gerekmektedir2. Ancak birçok biyokimyasal ticari kit, B.cepacia kompleks üyelerinin kesin tanısında yetersiz kalmakta, bu yüzden bu kitlerle elde edilen sonuçların güvenilirliği konusunda tartışmalar devam etmektedir1,6,11. Ticari kitlerin tanımlama sonuçları, BCSA'da pozitif üreme, lizin ve ornitin dekarboksilasyonu, sükroz ve adonitol oksidasyonu, oksidaz pozitifliği, 42°C'de üreme ve hemoliz gibi özgül ek fenotipik test sonuçlarıyla kombine edilmesi durumunda ancak güvenilir olabilmektedir1. Kiska ve arkadaşları29, B.cepacia, diğer Burkholderia türleri ve sık rastlanmayan çevresel türlerin tanımlanmasında, otomatize sistemlerin yanlış sonuç verebildiklerini belirtmişler; bu sistemlerle elde edilen sonuçların, mutlaka referans laboratuvarlarda doğrulanması gerektiğini bildirmişlerdir.
Yurdakul ve arkadaşları11, akciğer enfeksiyonu ön tanısıyla takip edilen 85 kistik fibrozisli hastanın balgam örneklerinde fenotipik ve moleküler yöntemleri kullanarak B.cepacia kompleks varlığını araştırmışlar; Crystal (Becton-Dickinson) ve Phoenix (Becton-Dickinson) otomatize sistemlerini kullanarak balgam örneklerinin 2 (%2.3)'sinde B.cepacia kompleks bakterisini tanımlamışlardır. Ancak fenotipik testlerle B.cepacia kompleks izole edilen iki klinik örneğin sadece birinde, recA polimeraz zincir reaksiyonu (PCR) ile amplifikasyon gösterilmiş; diğer örnekler ise negatif olarak izlenmiştir. Restriksiyon enzim analiziyle söz konusu B.cepacia kompleks suşu, B.multivorans olarak tanımlanmıştır.
Brisse ve arkadaşları30, 2002 yılında 134 B.cepacia kompleks izolatının tanısında BD Phoenix (Becton Dickinson) ve VITEK2 (bioMérieux) otomatize sistemlerini karşılaştırmışlar; bu iki sistem ile tüm B.cepacia kompleks izolatlarında saptanan doğru tanımlama oranlarının benzer olduğunu (sırasıyla %50 ve %53), ancak genomovar III (sırasıyla %71 ve %38; p< 0.01) ve B.multivorans (sırasıyla %58 ve %89; p< 0.001) açısından sistemler arasında belirgin fark olduğunu bildirmişlerdir30. Ayrıca, BD Phoenix ve VITEK2 sistemlerinin, klinik izolatların doğru tanısında (sırasıyla %56 ve %55; n= 85), çevresel izolatlardan (sırasıyla %21 ve %39, n= 28) daha başarılı olduklarını saptamışlar; bu sistemlerin yanlış tanı oranlarını klinik genomovar III için sırasıyla %9 ve %17, B.multivorans için %22 ve %7, diğer üyeler için ise %36 ve %13 olarak tespit etmişlerdir (p< 0.01)30. Dolayısıyla, uygulanan fenotipik yöntemlerdeki farklılıklar ve türler arasındaki fenotipik varyasyonlar nedeniyle birçok araştırıcı, bu testlerde uyumsuz sonuçların elde edilebileceğini belirtmekte ve fenotipik yöntemlerle alınan sonuçların referans laboratuvarlarda yapılacak moleküler yöntemlerle doğrulanması gerektiğini vurgulamaktadır1,6,11,29,30. Son yıllarda genişletilmiş panelli ticari otomatize sistemlerdeki gelişmelere paralel olarak, nonfermantatif bakterilerilerin doğru tanımlama oranlarında belirgin artış olduğu gözlenmektedir. Yapılan bir çalışmada, 14 cinse ait 22 türden oluşan nonfermantatif gram-negatif 201 suş VITEK2 Compact otomatize sistemiyle değerlendirilmiş ve sistemin, test edilen 21 B.cepacia kompleks üyesini doğru ve hızlı olarak tanımladığı; ayrıca sistemden alınan antibiyotik duyarlılık test sonuçlarının da agar dilüsyon yöntemiyle karşılaştırıldığında güvenilir olduğu ileri sürülmüştür24.
Moleküler tanı yöntemleri, klasik yöntemlere oranla daha seçici, daha güvenilir ve istenildiği anda tekrarlanabilen, kısa zaman içerisinde sonuç verebilen yöntemlerdir1,5,6,29,30,31. Ancak bu yöntemlerin zahmetli, yüksek maliyetli, geniş veri tabanı ve cihazlar gerektiren yöntemler olması nedeniyle rutin klinik mikrobiyoloji tanı laboratuvarlarındaki kullanımları sınırlıdır6. Bakterilerin 16S ve 23S rRNA genlerindeki DNA dizi farklılıkları, çeşitli B.cepacia kompleks üyelerini ve B.gladioli'yi tanımlayan türe özgül PCR testi için önemlidir6. rRNA bölgesinin çoğaltılmasına dayanan G1-G2 oligonükleotid primerlerin kullanıldığı PCR testleri, genomovarların birbirlerinden ayrılarak tanımlanmalarında oldukça başarılıdır31. Tüm B.cepacia kompleks bakterilerinin ayırımı, tam 16S rRNA gen dizisinin filogenetik analiziyle yapılabilmektedir. Ek olarak, 16S rRNA gen temeline dayalı floresans in situ hibridizasyon probları, balgam yaymalarında B.cepacia kompleks bakterilerinin direkt mikroskobik tanısı için umut vericidir1.
B.cepacia kompleks üyelerinin tanımlanmasında kullanılabilecek diğer bir moleküler yöntem, 16S rRNA ve recA genlerinin analizine dayalı "restriction fragment length polymorphism (RFLP)"dir. Ancak bu lokus üzerinde yer alan 16S rRNA gen dizisinde yeterli varyasyon olmaması, çoklu restriksiyon enzimleri kullanılsa bile RFLP yöntemine sınırlamalar getirmektedir. Buna karşın recA RFLP yöntemi, B.cepacia kompleks üyelerinin ayırımında güvenilir bir yöntemdir6. BCR1 ve BCR2 primerleri kullanılarak yapılan 1040 baz çifti (bç) büyüklüğündeki recA ürününün amplifikasyonu, izolatın B.cepacia kompleksin bir üyesi olduğunu göstermektedir. recA gen dizisinin filogenetik analizi, bakterinin ayırımını ve B.cepacia kompleks içindeki yerini belirlemekte, B.cenocepacia türünü, B.cenocepacia IIIA, IIIB, IIIC ve IIID olarak tanımlanan alt gruplara ayırabilmektedir1. B.cepacia kompleks bakterilerinin peptidoglikanla ilişkili dış membran lipoproteinini kodlayan opcL geni gibi diğer genlerin de, kullanımlarının sınırlı olması ve diziler hakkında bilgi eksikliği bulunmasına rağmen tanımlamada kullanılabileceği tartışılmaktadır1. "Amplified fragment length polymorphism typing" ribotiplendirme ve tam-hücre protein profili gibi genomik yöntemler, B.cepacia kompleks üyelerinin ayırımında kullanılabilen diğer testlerdir6.
Binnet5 yaptığı çalışmada, 89 hastaya ait örneklerden klasik yöntemlerle Pseudomonas spp. olarak tanımlanan 93 suş arasında B.cepacia kompleks varlığını moleküler yöntemlerle araştırmış ve bunların 24 (%25.8)'ünün B.cepacia kompleks için özgül olan 770 bç büyüklüğünde 16S rRNA genine sahip olduğunu göstermiştir5. Çalışmada ayrıca, API20 NE (BioMerieux, Fransa) ile B.cepacia kompleks olarak tanımlanan dört izolat da, bu yöntemle doğru sonuç vermiş ve moleküler yanı yöntemlerinin az miktarda örnek gerektirmesi, hızlı ve duyarlı olması bakımından geleneksel yöntemlere alternatif olabileceği belirtilmiştir5.
Hücresel yağ asitleri metil ester analizi yöntemi, Burkholderia türlerinin tanımlanmasında kullanışlı olabilir; ancak tüm B.cepacia kompleks üyelerinin tanısında ve B.gladioli'nin ayırımında geçerli bir yöntem değildir. ABD'de Kistik Fibrozis Derneği (http://www.cff.org) tarafından kurulan B.cepacia referans laboratuvarında, birçok fenotipik ve genotipik yöntemler kullanılarak şüpheli B.cepacia kompleks üyelerinin tanısı doğrulanmaktadır6.
Antibiyotik Duyarlılık Testleri
B.cepacia kompleks üyeleri için CLSI (Clinical and Laboratory Standards Institute) tarafından belirlenmiş disk difüzyon (DD) testi yorumlama kriterleri mevcuttur6. CLSI, trimetoprim-sülfametoksazol (TMP-SMZ), minosiklin, meropenem ve seftazidim için DD duyarlılık yöntemini standardize etmiş; kloramfenikol, levofloksasin ve tikarsilin-klavulanik asidin antibiyotik duyarlılık testinde ise minimum inhibitör konsantrasyonu (MİK) sıvı mikrodilüsyon veya E-test yöntemlerinin kullanılmasını önermiştir22. CLSI kriterlerine göre TMP-SMZ, duyarlılık testinde grup A'da yer almakta olup, ilk olarak test edilmesi ve bildirilmesi gereken antibiyotiktir22. Birincil test edilen ancak duyarlılık sonuç bildirimi kısıtlı yapılan grup B antibiyotikleri arasında ise seftazidim, meropenem, minosiklin, kloramfenikol, levofloksasin ve tikarsilin-klavulanik asit bulunmaktadır (Tablo III).
Başlangıçta duyarlı saptanan B.cepacia'nın tedavi esnasında sıklıkla direnç kazanması nedeniyle, iyileşmesi gecikmiş olgularda veya farklı zamanlarda izole edilen hasta suşlarında her seferinde antibiyotik duyarlılık testleri tekrarlanmalıdır2,6,7,19. İn vitro sinerji testlerinin değeri tartışmalıdır ve sinerji testleriyle hastaların tedaviye yanıtı arasındaki uygunluğu araştıran çalışmalar halen devam etmektedir6. Ancak kistik fibrozisli hastalardan izole edilen çok ilaca dirençli suşlar için duyarlılık testinde sinerji çalışmalarına gerek duyulabilir7,19. Referans laboratuvarlarda suşların hem ikili hem de üçlü kombinasyonlara duyarlılıkları değerlendirilmektedir6.
ANTİMİKROBİYAL DİRENÇ ve TEDAVİ
B.cepacia kompleks üyeleri, antimikrobiyallere en dirençli mikroorganizmalar arasında yer aldığından eradikasyonları oldukça zordur2,4,5,6,8. Bu bakteriler, aminoglikozidler ve polimiksinler gibi bazı antibiyotiklere doğal dirençli (intrensek direnç) oldukları gibi, diğer bazı antibiyotiklere de spontan mutasyon veya plazmid ve integronlar aracılığıyla direnç kazanabilir3,4,6,7,8,9,10,17. B.cepacia kompleks üyeleri, değişen penisilin bağlayıcı proteinleri ve/veya sıklıkla indüklenebilir kromozomal, daha az sıklıkta plazmid aracılı TEM grubundan beta-laktamazları sayesinde ampisilin, amoksisilin, birinci ve ikinci kuşak sefalosporinler gibi beta-laktam antibiyotiklere direnç geliştirebilir6,7. Aktaş ve arkadaşları32, 51 nonfermantatif gram-negatif bakteri suşunu genişlemiş spektrumlu beta-laktamaz (GSBL) ve kromozomal beta-laktamaz oluşturmaları yönünden incelemişler; çalışma kapsamındaki dört B.cepacia'dan birinin GSBL, üçünün ise kromozomal beta-laktamaz oluşturduğunu belirlemişlerdir. B.cepacia kompleks üyeleri, ayrıca hücre zarında geçirgenliğin azalması veya aktif dışa atım (efluks) pompaları sayesinde kloramfenikol, trimetoprim ve florokinolonlara da dirençli hale gelebilir6,7. Karbapenemleri değiştiren metallo-beta-laktamazlar, başta imipenem olmak üzere karbapenem direncine neden olmaktadır7.
Tedavi, CLSI tarafından standardize edilen yöntemlerle duyarlılığı araştırılan antibiyotikler arasından seçilerek uygulanmalıdır2,4,6,7,10. Güncel tedavi uygulamalarında, kombine rejimlerin uygulanması ve kombine tedavi rejimine, etkili iki veya üç antibiyotikle parenteral olarak başlanması önerilmektedir4,7. Antibiyotik duyarlılık testinde, duyarlı bulunduğu takdirde TMP-SMZ (5 mg/kg trimetoprim, 6 saatte bir) ve beta-laktam (seftazidim/piperasilin) veya kinolon tedavisi, uygun bir kombinasyon tedavisi olabilir7. B.cepacia kompleks enfeksiyonlarında meropenem ve temosilinin en etkin beta-laktam ajanlar olduğu, bu ilaçların yanına siprofloksasin eklendiğinde, bakterisidal etkinliğin arttığı; beta-laktam, siprofloksasin ve tobramisin kombinasyonunun ise en kuvvetli sinerjik etkiyi gösterdiği; ayrıca seftazidimin olguların %84.7'sinde etkili olduğu bildirilmektedir. Aslında kombine tedavi rejimlerinin klinik yanıta göre seçilmesi en uygun yaklaşımdır17.
Ülkemizde yapılan çalışmalarda, klinik örneklerden izole edilen B.cepacia izolatlarının birçok antibiyotiğe (TMP-SMZ, beta-laktamlar, aminoglikozidler, kinolonlar) yüksek oranlarda dirençli olduğu bildirilmektedir3,8,13,33. B.cepacia kompleks izolatlarının %55'inin çoklu ilaç direncine sahip oldukları da saptanmıştır4. Dizbay ve arkadaşları34, hastane kökenli B.cepacia izolatlarının aminoglikozidlere %55, sefalosporinlere %60, TMP-SMZ'ye %56, karbapenemlere %50, piperasilin-tazobaktam ve sefoperazon-sulbaktam gibi kombine antibiyotiklere %40 oranında direnç gösterdiklerini ifade etmişlerdir. Özellikle genomovar III'e bağlı türlerin, diğer genomovarlardan farklı olarak, kullanımda olan tüm antibiyotiklere direnç geliştirebildikleri (panrezistan) görülmüştür5,10. İngiltere'de yapılan bir çalışmada, 21 erişkin kistik fibrozisli hastadan izole edilen B.cepacia genomovar III suşunun %86'sının panrezistan, %14'ünün ise çoğul dirençli oldukları tespit edilmiştir35. Tekrarlayan antibiyotik tedavisi gören kistik fibrozis hastalarından elde edilen suşlar, diğer klinik suşlardan daha dirençli, hatta panrezistan olabilir6,7,10. Kistik fibrozisli hasta izolatlarına, meropenem, seftazidim ve piperasilinin daha etkili olduğu tespit edilmiştir. Bu hasta grubunda çok ilaca dirençli B.cepacia kompleks suşlarıyla gelişen akciğer enfeksiyonlarında meropenem [uzun süreli (üç saat) infüzyon ile verilmesi önerilir], yüksek doz tobramisin (200 µg/mL, aerosol olarak verilerek sağlanır) ve bir kinolon gibi üçüncü bir antibiyotiğin, %81-93 oranında bakterisidal etki gösterdiği tespit edilmiştir7. Akciğerlere ulaşan konsantrasyon yetersiz kaldığından pnömoni tedavisinde tek başına kinolonlar önerilmemektedir2. Kistik fibrozis hastalarından izole edilen suşların in vitro duyarlı oldukları antibiyotiklerle yapılan tedavilerde, tedavi başarısızlıkları görülebilmektedir7. Bu durum, uygun antimikrobiyal tedavi seçimini karmaşık hale getirmektedir4. Bunun olası nedenleri; değişen farmakokinetik özellikler, bronşektazik akciğere ilacın yetersiz dağılımı, anormal visköz bronş sekresyonlarının varlığı yüzünden bronş mukozasına yetersiz penetrasyon, yüksek koloni sayısı (> 107 kob/mL), azalmış pH ve artmış divalan katyonların akciğerde fagositozu bozması gibi lokal faktörlerdir. Diğer taraftan, kistik fibrozis hastalarında balgamda belli bir yoğunlukta bulunan laktoferrinin, doksisiklin ve rifampisin gibi antibiyotiklerin MİK ve minimum bakterisidal konsantrasyon (MBK) değerlerini azaltması, in vitro dirençli suşların etken olduğu enfeksiyonlarda bu ilaçlarla yapılan tedaviden başarı sağlanabileceği anlamına gelmektedir7.
Yapılan son çalışmalar, kronik enfeksiyonu olan kistik fibrozisli hastalarda aerosolize antibiyotik kullanımının önemli bir strateji olduğunu ortaya çıkarmıştır. Nebülize amilorid ve tobramisin kullanımının, yeni başlamış (son iki ay içinde) B.cepacia kompleks enfeksiyonunun erken dönemde eradikasyonunda etkili olabileceği, ancak kronik B.cepacia kompleks enfeksiyonunu eradike etmekte yetersiz kaldığı gösterilmiştir4. Kronik granülamatözlü hastaların invazif enfeksiyonlarında B.cepacia kompleks üyeleri de tedavi spektrumuna alınmalıdır. Seftazidim ve TMP-SMZ kombinasyonu, başlangıç için iyi bir seçenektir7. B.cepacia bakteriyemisinin seyri, geniş spektrumlu antibiyotiklerle tedaviye rağmen ilerleyici olabildiğinden hastalığın erken tanımlanması çok önemlidir17. Santral sinir sistemi enfeksiyonlarında (menenjit, şant enfeksiyonu, beyin apsesi), duyarlı bulunursa meropenem, seftazidim, kloramfenikol ve TMP-SMZ uygun seçeneklerdir. Tedavi süresi, klinik ve laboratuvar sonuçları dikkate alınarak belirlenmelidir7.
KORUNMA ve KONTROL ÖNLEMLERİ
Hastane ortamında kullanılan sular, solüsyonlar, alet ve ekipmanların kontaminasyonu sonrasında nozokomiyal B.cepacia kompleks salgınlarının ortaya çıkabileceği akılda tutulmalıdır. B.cepacia kompleks enfeksiyonlarının kontrolü için, akılcı ve uygun antibiyotik politikaları geliştirilmeli, kolonize veya enfekte hastalarda temizliğe azami dikkat edilmeli, hastalar ve sağlık personeli eğitilmeli, yoğun bakım üniteleri başta olmak üzere salgın varlığında sürveyans çalışmalarına önem verilmeli, sıkı enfeksiyon kontrol önlemleri uygulanmalı ve özellikle kistik fibrozisli hastalarda çok ilaca direnç riskinin yüksek olması nedeniyle temas önlemlerine özenle uyulmalıdır7,8.
KAYNAKLAR
- Mahenthiralingam E, Baldwin A, Dowson CG. Burkholderia cepacia complex bacteria: opportunistic pathogens with important natural biology. J Appl Microbiol 2008; 104(6): 1539-51. [Özet] [Tam Metin] [PDF]
- Şener B. Kistik fibrozisde mikrobiyal patogenez. Hacettepe Tıp Dergisi 2002; 33(1): 49-57. [PDF]
- Horasanlı S, Tolun V, Küçüker MA. İdrardan izole edilen Burkholderia cepacia suşları. İnfeksiyon Dergisi 1997; 11(4): 385-7.
- Leitao JH, Sousa SA, Ferreira AS, Ramos CG, Silva IN, Moreira LM. Pathogenicity, virulence factors, and strategies to fight against Burkholderia cepacia complex pathogens and related species. Appl Microbiol Biotechnol 2010; 87(1): 31-40. [Özet]
- Binnet DH. Klinik örneklerden Burkholderia cepacia kompleksinin PCR tabanlı identifikasyonu. Doktora Tezi, 2006. Gazi Üniversitesi Fen Bilimleri Enstitüsü, Ankara.
- LiPuma JJ, Currie BJ, Lum GD, Vandamme PAR. Burkholderia, Stenotrophomonas, Ralstonia, Cupriavidus, Pandoreae, Brevundimonas, Comamonas, Delftia and Acidovorax, pp: 749-69. In: Murray PR, Baron EJ, Jorgensen JH, Landry ML, Pfaller MA (eds), Manual of Clinical Microbiology. 2007, 9th ed. ASM Press, Washington, DC.
- Öztürk R. Çoklu ilaç dirençli Pseudomonas aeruginosa, Burkholderia cepacia, Stenotrophomonas maltophilia ile oluşan infeksiyon hastalıklarında antimikrobik tedavi. ANKEM 2008; 22(Ek 2): 36-43. [Özet] [PDF]
- Koruk ST, Bayraktar M, Koruk İ, Yılmaz L. Üriner sistoskop kontaminasyonu sonrası gelişen hastane kaynaklı Burkholderia cepacia salgını. ANKEM 2010; 24(4): 193-7. [Özet] [PDF]
- Alvarez-Lerma F, Maull E, Terradas R, et al. Moisturizing body milk as a reservoir of Burkholderia cepacia: outbreak of nosocomial infection in a multidisciplinary intensive care unit. Crit Care 2008; 12(1): R10. [Özet] [Tam Metin] [PDF]
- Quinn JP. Clinical problems posed by multiresistant non-fermenting gram-negative pathogens. Clin Infect Dis 1998; 27(Suppl 1): 117-24. [Özet] [PDF]
- Coenye T, Vandamme P, Govan JR, LiPuma JJ. Taxonomy and identification of the Burkholderia cepacia complex. J Clin Microbiol 2001; 39(10): 3427-36. [Tam Metin] [PDF]
- Şener B, Günalp A, Özçelik U, Göçmen A. Kistik fibrozis olgularının 5 yıllık mikrobiyolojik değerlendirimi. Mikrobiyol Bul 1996; 30(4): 343-51. [PDF]
- Palleroni NJ, Holmes B. Pseudomonas cepacia sp. nov., nom. rev. Int J Syst Bacteriol 1981; 31(4): 479-81.
- Drevinek P, Mahenthiralingam E. Burkholderia cenocepacia in cystic fibrosis: epidemiology and molecular mechanisms of virulence. Clin Microbiol Infect 2010; 16(7): 821-30. [Özet] [Tam Metin] [PDF]
- Kurtaran B, Saltoğlu N, İnal AS, Taşova Y, Özeren A. Nöroloji yoğun bakım ünitesinde hastane infeksiyonları. ANKEM 2005; 19(3): 119-24. [Özet] [PDF]
- Yurdakul P, Ergünay K, Yalçın E, et al. Kistik fibrozis hastalarında Burkholderia cepacia complex izolasyonu ve tanımlanması. Mikrobiyol Bul 2006; 40(4): 301-6. [Özet] [PDF]
- Demir S, Fidan F, Değirmenci B, Özer Y, Gökçe Ç. Bir hemodiyaliz hastasında invazif aspergillozu taklit eden Burkholderia cepacia pnömoni olgusu. Turk Toraks Derg 2005; 6(2): 175-7. [Özet] [Tam Metin] [PDF]
- Siddiqui AH, Mulligan ME, Mahenthiralingam E, et al. An episodic outbreak of genetically related Burkholderia cepacia among non-cystic fibrosis patients at a university hospital. Infect Control Hosp Epidemiol 2001; 22(7): 419-22. [Özet]
- Conly JM, Klass L, Larson L, Kennedy J, Low DE, Harding GK. Pseudomonas cepacia colonization and infection in intensive care units. CMAJ 1986; 134(4): 363-6. [Özet] [PDF]
- LiPuma JJ. Burkholderia cepacia epidemiology and pathogenesis: implications for infection control. Curr Opin Pulm Med 1998; 4(6): 337-41. [Özet]
- Kaitwatcharachai C, Silpapojakul K, Jitsurong S, Kalnauwakul S. An outbreak of Burkholderia cepacia bacteremia in hemodialysis patients: an epidemiologic and molecular study. Am J Kidney Dis 2000; 36(1): 199-204. [Özet]
- Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. Twentieth Informational Supplement. M100-S20, 2010. CLSI, Wayne, Pennsylvania.
- Ramsey AH, Skonieczny P, Coolidge DT, Kurzynski TA, Proctor ME, Davis JP. Burkholderia cepacia lower respiratory tract infection associated with exposure to a respiratory therapist. Infect Control Hosp Epidemiol 2001; 22(7): 423-6. [Özet]
- Hsieh WS, Sung LL, Tsai KC, Ho HT. Evaluation of the VITEK 2 cards for identification and antimicrobial susceptibility testing of non-glucose-fermenting gram-negative bacilli. APMIS 2009; 117(4): 241-7. [Özet]
- LiPuma JJ. Burkholderia cepacia. Management issues and new insights. Clin Chest Med 1998; 19(3): 473-86. [Özet]
- Martino R, Gomez L, Pericas R, et al. Bacteraemia caused by non-glucose-fermenting gram-negative bacilli and Aeromonas species in patients with haematological malignancies and solid tumours. Eur J Clin Microbiol Infect Dis 2000; 19(4): 320-3. [Özet]
- Gilligan PH, Gage PA, Bradshaw LM, Schidlow DV, DeCicco BT. Isolation medium for the recovery of Pseudomonas cepacia from respiratory secretions of patients with cystic fibrosis. J Clin Microbiol 1985; 22(1): 5-8. [Özet] [PDF]
- Welch DF, Muszynski MJ, Pai CH, et al. Selective and differential medium for recovery of Pseudomonas cepacia from the respiratory tracts of patients with cystic fibrosis. J Clin Microbiol 1987; 25(9): 1730-4. [Özet] [PDF]
- Kiska DL, Kerr A, Jones MC, et al. Accuracy of four commercial systems for identification of Burkholderia cepacia and other gram-negative non-fermenting bacilli recovered from patients with cystic fibrosis. J Clin Microbiol 1996; 34(4): 886-91. [Özet] [PDF]
- Brisse S, Stefani S, Verhoef J, Van Belkum A, Vandamme P, Goessens W. Comparative evaluation of the BD Phoenix and VITEK 2 automated instruments for identification of isolates of the Burkholderia cepacia complex. J Clin Microbiol 2002; 40(5): 1743-8. [Özet] [Tam Metin] [PDF]
- Whitby PW, Carter KB, Hatter KL, LiPuma JJ, Stull TL. Identification of members of the Burkholderia cepacia complex by species-specific PCR. J Clin Microbiol 2000; 38(8): 2962-5. [Özet] [Tam Metin] [PDF]
- Aktaş AE, Al FD, Şahin ÜA, Yiğit N, Ayyıldız A. Nonfermentatif Gram-negatif bakterilerde genişlemiş spektrumlu ve kromozomal beta-laktamaz varlığının araştırılması. İnfeksiyon Dergisi 2001; 15(3): 315-8.
- Azap ÖK, Timurkaynak F, Arslan H, Karaman SÖ. Hastane infeksiyon etkeni olarak izole edilen non-fermentatif gram-negatif bakterilerde siprofloksasin, ofloksasin ve levofloksasinin in-vitro etkinliğinin karşılaştırılması. Ankara Üniversitesi Tıp Fakültesi Mecmuası 2004; 57(4): 189-94. [Özet]
- Dizbay M, Tunccan OG, Sezer BE, Aktas F, Arman D. Nosocomial Burkholderia cepacia infections in a Turkish university hospital: a five-year surveillance. J Infect Dev Ctries 2009; 3(4): 273-7. [Özet]
- Moore JE, Crowe M, Shaw A, McCaughan J, Redmond AO, Elborn JS. Antibiotic resistance in Burkholderia cepacia at two regional cystic fibrosis centres in Northern Ireland: is there a need for synergy testing? J Antimicrob Chemother 2001; 48(2): 319-21. [Tam Metin] [PDF]
İletişim (Correspondence):
Doç. Dr. Orhan Baylan,
GATA Haydarpaşa Eğitim Hastanesi,
Tıbbi Mikrobiyoloji Servisi,
Üsküdar, İstanbul, Türkiye.
Tel (Phone): +90 216 542 2020/4784,
E-posta (E-mail): dr_obaylan@yahoo.com