Penisiline Duyarlı ve Dirençli Streptococcus
pneumoniae İzolatlarında
Penisilin Bağlayan Protein Genotiplerinin Değerlendirilmesi*
Evaluation
of Penicillin-Binding Protein Genotypes in Penicillin Susceptible and
Resistant Streptococcus pneumoniae Isolates
Gönül ASLAN1, Seda TEZCAN1, Nuran DELİALİOĞLU1, Fatma Esin AYDIN1, Necdet KUYUCU2, Gürol EMEKDAŞ1
1 Mersin Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Mersin.
1 Mersin University Faculty of Medicine, Department of Medical Microbiology, Mersin, Turkey.
2 Mersin Üniversitesi Tıp Fakültesi, Çocuk Sağlığı ve Hastalıkları Anabilim Dalı, Mersin.
2 Mersin University Faculty of Medicine, Department of Pediatrics, Mersin, Turkey.
* Bu çalışma Mersin Üniversitesi Bilimsel Araştırma Projeleri Birimi tarafından (Proje no: BAP-TF TTB (GA) 2006-1) desteklenmiştir.
ÖZET
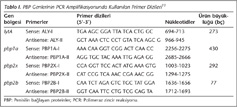
Penisilin bağlayan proteinler (PBP), beta-laktam grubu antibiyotiklerin doğal hedefidir ve PBP'leri kodlayan pbp1a, pbp2x ve pbp2b genlerindeki mutasyonlar, Streptococcus pneumoniae'da beta-laktamlara karşı gelişen dirençten sorumlu tutulmaktadır. Bu çalışmada, penisiline duyarlı ve dirençli S.pneumoniae izolatlarında, penisilin direnci ile ilişkili pbp1a, pbp2x ve pbp2b gen bölgelerinde yaygın olan mutasyon paternlerinin sıklığının belirlenmesi ve PBP genotip mutasyonlarının antibiyotik direnciyle ilişkisinin değerlendirilmesi amaçlanmıştır. Çalışmaya, çeşitli klinik örneklerden (32 nazofarengeal sürüntü, 16 balgam, üç kan, üç yara, iki beyin omurilik sıvısı ve birer adet olmak üzere idrar, apse, bronkoalveoler lavaj, konjunktival sürüntü, trakeal aspirat ve kulak efüzyonu) izole elde edilen 62 S.pneumoniae suşu dahil edilmiştir. İzolatların penisilin duyarlılığı disk difüzyon ve E-test yöntemiyle belirlenmiş; suşların 23'ü penisiline duyarlı, 31'i orta düzeyde duyarlı ve sekizi dirençli olarak tanımlanmıştır. İzolatlardan DNA ekstraksiyonu, hızlı DNA izolasyon yöntemiyle yapılmış ve "wild" tip dizilerine özgül polimeraz zincir reaksiyonu (PCR) temelli bir yöntem kullanılarak penisilin direnciyle ilişkili pbp1a, pbp2b ve pbp2x gen bölgelerinde PBP gen mutasyonlarının dağılımı belirlenmiştir. Ayrıca, bu izolatlardaki PBP gen değişimleri, penisiline karşı duyarlılık ve dirençlilikle ilişkileri yönünden de değerlendirilmiştir. Penisiline duyarlı S.pneumoniae izolatlarının %95.7 (22/23)'sinde üç PBP geninde (pbp1a, pbp2x ve pbp 2b) herhangi bir mutasyon belirlenemezken, 1 (%4.3) izolatta her üç PBP geninde mutasyon tespit edilmiştir. Penisiline orta düzeyde duyarlı 31 S.pneumoniae izolatında ise PBP gen mutasyonlarının çeşitli kombinasyonları belirlenmiştir. Bu suşlardan 1 (%3.2)'inde araştırılan PBP genlerinde herhangi bir mutasyon saptanmamış; 22 (%71)'sinde her üç PBP geninde de mutasyon varlığı belirlenmiş, 8 (%25.8) izolatta ise iki PBP geninde (beşinde pbp1a ve pbp2b; ikisinde pbp2x ve pbp2b; birinde pbp1a ve pbp2x) mutasyon tespit edilmiştir. Çalışmamızda, penisiline dirençli (MİK ≥ 2 µg/ml) sekiz S.pneumoniae izolatının 7 (%87.5)'sinde her üç PBP geninde mutasyon tespit edilmiş olup, bir izolatta ise üç PBP geninde herhangi bir mutasyon gözlenmemiştir. Bu çalışma, bölgemizdeki S.pneumoniae izolatlarında penisilin direnci ile ilişkili olarak PBP geninin çeşitli bölgelerinde meydana gelen farklı mutasyon paternlerinin sıklığı konusunda önemli veriler sağlamaktadır. Verilerimiz, pbp1a, pbp2x ve pbp2b gen bölgelerindeki değişimlerin, esas olarak penisiline dirençli S.pneumoniae ile ilişkili olduğu görüşünü desteklemektedir. Çalışmada kullanılan "wild" tip dizilerine özgül PCR yönteminin, penisilin direncini MİK ile ilişkili olarak karakterize edebileceği kanısına varılmıştır.
Anahtar sözcükler: Streptococcus pneumoniae; penisilin bağlayan protein; PBP; mutasyon; penisilin direnci; polimeraz zincir reaksiyonu (PCR).
ABSTRACT
Penicillin-binding proteins (PBPs) are the natural targets of beta-lactam antibiotics and mutations in pbp1a, pbp2b, and pbp2x genes, which encode PBPs, are responsible for resistance to beta-lactams in Streptococcus pneumoniae. In the present study, we intended to determine how often the common mutation patterns occurred within the pbp1a, pbp2b, and pbp2x PBP gene regions and evaluate the PBP genotype mutations which were associated with penicillin resistance in several penicillin-susceptible and -resistant S.pneumoniae isolates in Mersin, Turkey. A total of 62 S.pneumoniae strains isolated from different clinical specimens (32 nasopharyngeal swab, 16 sputum, 3 blood, 3 wound, 2 cerebrospinal fluids and one of each urine, abscess, bronchoalveolar lavage, conjunctival swab, tracheal aspirate, middle ear effusion) were included in the study. Penicillin susceptibilities of the isolates were searched by disc diffusion and E-test methods, and 23 of them were identified as susceptible, 31 were intermediate susceptible, and eight were resistant to penicillin. A rapid DNA extraction procedure was performed for the isolation of nucleic acids from the strains. Distribution of PBP gene mutations in pbp1a, pbp2b, and pbp2x gene regions related to penicillin resistance was determined by using a wild-type specific polymerase chain reaction (PCR) based technique. PBP gene alterations of those isolates were also evaluated in relation to penicillin susceptibility and resistance patterns. Twenty two (95.7%) of 23 penicillin-susceptible S.pneumoniae isolates exhibited no mutation in the three PBP genes (pbp1a, pbp2x, and pbp 2b), while 1 (4.3%) of these harbored mutations in all of the three PBP genes. The penicillin-intermediate susceptible S.pneumoniae isolates exhibited various combinations of mutations. One (3.2%) of 31 penicillin-intermediate susceptible isolates exhibited no mutation in the three PBP genes, while 22 (71%) of them yielded mutations in all of the three PBP genes. The remaining 8 (25.8%) isolates harbored mutations for dual PBP genes (in five strains pbp1a and pbp2b; in two strains pbp2x and pbp2b; in one strain pbp1a and pbp2x). Seven (87.5%) out of eight penicillin-resistant S.pneumoniae isolates (MIC ≥ 2 µg/ml) revealed mutations in all of the three PBP genes and the other penicillin-resistant isolates exhibited no mutation in the PBP genes. The present study supplied important data on the frequency of different patterns of mutations occurring at various regions of PBP genes related to penicillin resistance in S.pneumoniae isolates in our restricted region. The results supported the notion that penicillin resistance in S.pneumoniae was mainly attributed to alterations in pbp1a, pbp2x, and pbp2b gene regions and wild-type sequence specific PCR could be applied to characterize genotypic background of penicillin resistance in S.pneumoniae strains.
Key words: Streptococcus pneumoniae; penicillin-binding protein (PBP); mutation; penicillin resistance; polymerase chain reaction (PCR).
Geliş Tarihi (Received): 11.08.2011 • Kabul Ediliş Tarihi (Accepted): 14.11.2011
GİRİŞ
Streptococcus pneumoniae, insanlarda menenjit, akut otitis media, rinosinüzit ve toplum kökenli pnömoni ile ilişkili, oldukça önemli bir bakteriyel patojendir1,2. Penisilin birçok pnömokokal enfeksiyonun tedavisinde geleneksel olarak kullanılan ilk seçenek antibiyotik olup, ülkemizde de pnömokokal enfeksiyonların ampirik tedavisinde halen uygun bir ajandır3,4,5. Ancak penisiline dirençli S.pneumoniae (PRSP) izolatlarındaki artışın hızla ortaya çıkması, geleneksel ampirik antibiyotik tedavisinde ciddi klinik problemlere sebep olmakta ve bu da çeşitli penisiline dirençli klonların dünya çapında yayılmasıyla sonuçlanmaktadır6,7,8. PRSP izolatlarının prevalans oranı, coğrafi bölgelere bağlı olarak değişmektedir4. Yerleşik mikrobiyal flora üyelerini barındırması nedeniyle nazofarenks, solunum yolu enfeksiyonları ve invaziv hastalıklara sebep olan S.pneumoniae gibi potansiyel patojenler için önemli bir rezervuardır6. Ciddi enfeksiyon durumunda, uygun antibiyotik tedavisine karar vermede, S.pneumoniae'nın penisiline karşı duyarlılık durumunun hızla belirlenmesi oldukça önemlidir9.
Penisilin bağlayan proteinler (PBP) beta-laktam grubu antibiyotiklerin doğal hedefidir ve PBP genlerindeki mutasyonlar, S.pneumoniae'da beta-laktamlara dirençten sorumlu tutulmaktadır10,11,12. PBP'ler membranla ilişkili serin peptidazlar olup, peptidoglikan biyosentezinin son iki basamağındaki glikan zincirlerinin polimerizasyonu ve transpeptidasyonunu katalizlemektedir3,13. S.pneumoniae'da yüksek moleküler ağırlıklı PBP'ler (1a, 1b, 2a, 2b ve 2x) ve düşük molekül ağırlıklı PBP-3 olmak üzere toplam altı adet PBP belirlenmiştir3. Yüksek moleküler ağırlıklı PBP'lerdeki dereceli olarak gelişen mutasyonlar, bu proteinlerin bağlanma aktivitesini azaltır ve beta-laktam grubu ajanlara duyarsız hale getirir6. S.pneumoniae'da var olan bu altı PBP'den pbp1a, pbp2x ve pbp2b olmak üzere en az üç tanesindeki değişikliklerin, penisilin direncinin gelişmesinde oldukça önemli olduğu bildirilmektedir14,15.
Daha önceki yaptığımız bir çalışmada, Mersin'de sağlıklı çocuklarda S.pneumoniae taşıyıcılık oranı %13.9 olarak bulunmuş; izolatların penisiline karşı duyarlılık oranı %87.1 olarak saptanmış; izolatların %12'sinin orta düzeyde, %1'inin ise yüksek düzeyde dirençli olduğu görülmüştür16. Ayrıca, izolatların serotip dağılımı çeşitlilik göstermektedir ve dolaşımdaki bazı yaygın serotiplerin invaziv özellikte olduğu belirlenmiştir17. Bu çalışmanın amacı, Mersin ilinde penisiline duyarlı ve dirençli S.pneumoniae izolatlarında, penisilin direnci ile ilişkili pbp1a, pbp2b ve pbp2x gen bölgelerinde yaygın mutasyon paternlerinin sıklığının polimeraz zincir reaksiyonu (PCR) temelli bir yöntemle belirlenmesi ve PBP genotiplerinin değerlendirilmesidir.
GEREÇ ve YÖNTEM
S. pneumoniae İzolatları
Çalışmaya, Mersin Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Laboratuvarında 2005-2009 yılları arasında çeşitli klinik örneklerden izole edilen 62 S.pneumoniae suşu dahil edildi. Suşların 32'si nazofarengeal sürüntü, 16'sı balgam, üçü kan, üçü yara, ikisi beyin omurilik sıvısı (BOS) ve birer adet olmak üzere idrar, apse, bronkoalveoler lavaj, konjunktival sürüntü, trakeal aspirat ve kulak efüzyonu örneklerinden izole edilmişti.
Klinik örnekler %5'lik koyun kanlı agara (Oxoid, UK) ekildikten sonra, optokin ve oksasilin diski yerleştirildi. Kültürler %5 CO2'li ortamda 35°C'de bir gece inkübe edildi ve izolatlar koyun kanlı agarda alfa hemoliz ve koloni morfolojisi, Gram boyama, 5 µg'lık optokin disk duyarlılığı ve safra erime testleriyle tanımlandı18. Tek bir koloniden çoğaltılan bütün izolatlar gliserinli buyyona (%0.5 glukoz ve %10 gliserol içeren nutrient buyyon) alınarak 70°C'de saklandı. Standart ATCC 49619 kalite kontrol suşu da aynı şekilde incelendi.
Penisilin Duyarlılığı
Penisilin duyarlılığı, S.pneumoniae için "Clinical and Laboratory Standards Institute (CLSI)"duyarlılık kriterlerine göre disk difüzyon yöntemiyle belirlendi. Pnömokok izolatlarının oksasilin (1 µg) zon çapı ≥ 20 mm olduğunda penisiline duyarlı olarak kabul edildi. Oksasilin zon çapı ≤ 19 mm olduğunda, suş dirençli kabul edildi ve minimum inhibitör konsantrasyonu (MİK) değeri, penisilin E-test (AB Biodisk, Sweden) yöntemiyle belirlendi.
CLSI 2008 yılında S. pneumoniae için penisilin duyarlılığı sınır değerlerini değiştirmiştir. 2008 yılı öncesinde penisilin MİK değeri ≥ 2 µg/ml olduğunda PRSP, 0.125-1.0 µg/ml arasında olduğunda penisiline orta düzeyde duyarlı S. pneumoniae (PSSP) ve ≤ 0.06 µg/ml olduğunda penisiline duyarlı S.pneumoniae (PSSP) olarak değerlendirilmekteydi19. 2008 yılından sonra yayınlanan CLSI dokümanlarında, BOS'tan elde edilen izolatlar için, parenteral kullanılan penisilin MİK direnç sınır değeri ≥ 0.12 µg/ml olarak değişmiş ve BOS dışındaki izolatlar için penisilin MİK değerleri, ≥ 8 µg/ml olduğunda PRSP, 4 µg/ml olduğunda POSP ve ≤ 2 µg/ml olduğunda PSSP olarak değerlendirilmeye başlamıştır. Oral kullanılan penisilin için MİK değerleri ise ≥ 2 µg/ml olduğunda PRSP, 0.12-1 µg/ml olduğunda POSP ve 0.06 ≤ 2 µg/ml olduğunda PSSP olarak değerlendirilmektedir20.
Bakteriyel DNA İzolasyonu ve PBP Gen Bölgelerinin Amplifikasyonu
İzolatlardan DNA eldesi, hızlı DNA izolasyon yöntemiyle yapıldı. Bunun için, besiyerinde üreyen kolonilerden bir öze dolusu alınarak, 1.5 ml'lik plastik tüplerde 1 ml steril distile su içerisinde süspanse edildi. Tüpler, 80°C'de 20 dakika tutularak bakterilerin parçalanması sağlandı. Daha sonra ependorf tüpü 12.000 xg'de 10 dakika santrifüj edilerek süpernatant atıldı. Pellet üzerine 200 µl kloroform ve 200 µl steril distile su ilave edildikten sonra, karışım 12.000 xg'de 10 dakika tekrar santrifüj edildi. Süpernatant PCR reaksiyonunda kalıp olarak kullanıldı.
S.pneumoniae'nın pbp1a, pbp2x ve pbp2b gen bölgeleri özgül primerler kullanılarak PCR ile amplifiye edildi11 (Tablo I). Kullanılan oligonükleotid primer dizileri, sadece duyarlı ("wild" tip) izolatların pbp1a, pbp2x ve pbp2b gen bölgelerinin amplifikasyonu için geliştirilmiş olup, duyarlı olmayan S.pneumoniae izolatlarında bu gen bölgeleri değişmiş olarak bulunmaktadır. Ayrıca, S.pneumoniae'ya özgül otolizin genini kodlayan lytA gen bölgesinin 273 baz çift (bç)'lik bir parçası da, S.pneumoniae izolatlarının doğrulanması için PCR ile belirlendi.
Her bir gen bölgesi için standart PCR reaksiyonu 50 µL'lik toplam hacimlerde gerçekleştirildi ve karışım 3 µL S.pneumoniae hücre lizatından elde edilen kalıp DNA, 0.5 µM/L her bir primer dizisi (sense ve antisense), 0.2 mM nükleotid karışımı, 1X Taq DNA polimeraz tampon, 1.25 ünite Taq DNA polimeraz ve 1.5 mM MgCl2 olacak şekilde hazırlandı. Örneklerin ısı döngü cihazında (Eppendorf, Mastercycler, Germany) PCR amplifikasyon koşulları ise, 94°C'de 10 dakika başlangıç denatürasyonundan sonra, 30 döngü 94°C'de 45 saniye denatürasyon, 52°C'de 45 saniye bağlanma ve 72°C'de 40 saniye uzama basamakları ve arkasından 72°C'de beş dakika son uzama basamaklarını içermekteydi. PCR ürünleri, %1'lik agaroz jel elektroforezinden sonra 0.5 µg/ml etidyum bromür ile boyandıktan sonra ultraviyole transilüminatörde görüntülendi.
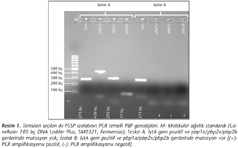
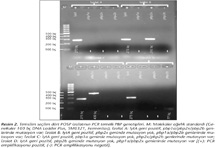
PCR sonuçlarının değerlendirilmesinde, 273 bç'lik lytA gen bölgesinin amplifikasyonu S.pneumoniae izolatlarını doğrulamaktadır. Eğer izolatların PBP genleri değişmemiş ise, bütün PBP gen reaksiyon tüplerinin agaroz jelinde bant görülmektedir; ancak PBP gen bölgelerinde değişim olan izolatlarda bu bantların bir veya daha fazlası tespit edilmemektedir (Resim 1, 2). Agaroz jelde 430, 292 ve 77 bç'lik DNA fragmentlerinin değerlendirilmesi; sırasıyla pbp1a, pbp2b ve pbp2x gen bölgelerine karşılık gelmektedir.
BULGULAR
Çalışmaya alınan 62 S.pneumoniae izolatının 23 (%37.1)'ü penisiline duyarlı (PSSP); 39 (%62.9)'u ise dirençli (PRSP) olarak saptanmıştır. Çalışmamızda, suşların sadece iki tanesi BOS örneğinden izole edilmiş olup, belirlenen MİK direnç sınır değerlerinin en çok 2-3 olarak saptanması ve BOS dışı dirençli olarak belirlenen S.pneumoniae izolatlarının da duyarlı sınır değerinde bulunması nedeniyle, dirençli-duyarlı örnek dağılımının bozulmaması amacıyla, değerlendirme 2008 yılı öncesindeki CLSI kriterlerine göre yapılmıştır. Penisilin E-test sonuçlarına göre; bu izolatların 31 (%50)'i 0.125-1.0 µg/ml arasındaki MİK değeri ile penisiline orta düzeyde duyarlı (POSP), 8 (%12.9)'i ise ≥ 2 µg/ml MİK değeri ile PRSP olarak belirlenmiştir (Tablo II).
Tüm izolatlarda, "wild" tip dizilerine özgül PCR ile pbp1a, pbp2x ve pbp2b gen bölgeleri mutasyonlarının dağılımına göre beş farklı PBP genotip paterni izlenmiştir (Tablo II). İzolatlardan 24 (%38.7)'ünde bu üç PBP geninde herhangi bir mutasyon görülmezken; 30 (%48.3) izolatta üç PBP geninde mutasyon, 8 (%13) izolatta ise iki PBP geninde mutasyon gözlenmiştir (Tablo II). PSSP izolatları incelendiğinde; suşların %95.7 (22/23)'sinde pbp1a, pbp2x ve pbp2b mutasyonları saptanmazken, 1 (%4.3)'inde her üç PBP geninde de mutasyon tespit edilmiştir.
POSP izolatlarında mutasyonların değişik kombinasyonları belirlenmiştir. POSP izolatlarının %3.2 (1/31)'sinde araştırılan PBP genlerinde mutasyon gözlenmemiş; %71 (22/31)'inde her üç PBP geninde, %25.8 (8/31)'inde ise iki PBP geninde (beşinde pbp1a ve pbp2b; ikisinde pbp2x ve pbp2b; birinde pbp1a ve pbp2x) mutasyon saptanmıştır (Tablo II ve Resim 2). POSP izolatlarından sadece üç tanesinin MİK değeri üst sınırda (1.5 µg/ml) belirlenmiş ve bu üç izolatın PBP genlerinin genotip paterninin her üç PBP geninde mutasyona uğramış olduğu gözlenmiştir (Tablo II).
PRSP izolatları değerlendirildiğinde; sekiz izolatın yedisinde her üç PBP geninde de mutasyon varlığı izlenmiş; bir izolatta ise araştırılan hiçbir PBP geninde mutasyon gözlenmemiştir (Tablo II).
Standart S.pneumoniae ATCC 49619 suşunun oksasilin zon çapı < 12 mm, MİK değeri ise 1.0 µg/ml olarak tespit edilmiştir. Bu suşun mutasyon paterni incelendiğinde; pbp1a ve pbp2x genlerinde mutasyon olmadığı, pbp2b geninde ise mutasyon olduğu saptanmıştır.
TARTIŞMA
Pnömokoklarda pbp1a, pbp2x ve pbp2b gen bölgelerindeki mutasyonların penisilin direncinin en önemli belirleyicisi olduğu ileri sürülmektedir12,21,22. Özellikle PRSP ve POSP izolatlarındaki pbp1a, pbp2x ve pbp2b dizileri PSSP izolatlarından oldukça farklı bulunmuştur12. Yaptığımız bu çalışmada, "wild" tip dizilerine özgül PCR yöntemiyle bu PBP gen bölgelerindeki mutasyonlar değerlendirilmiştir. Bu yöntemde, hedefe özgül primerler mutasyonlu suşların PBP genlerini amplifiye edememektedir. Çalışmamızda izolatların doğrulanması için S.pneumoniae'ya özgül otolizin genini kodlayan lytA geni, üç PBP geniyle birlikte eş zamanlı olarak amplifiye edilmiş; bu bölgenin amplifiye edilemediği izolatlar çalışmaya alınmamıştır9. Ayrıca çalışmada, aynı hastaya ait tek bir izolat kullanılmış, ancak suşlar arasındaki genetik yakınlıklar araştırılmamıştır. İncelenen 62 S.pneumoniae izolatının pbp1a, pbp2x ve pbp2b genlerine özgül oligonükleotid primer dizileri, PBP gen bölgesindeki mutasyonların tespit edilmesinde kullanılmış ve bu mutasyonların antibiyotik direnci ile olan ilişkisi araştırılmıştır. PSSP izolatlarının %95.7 (22/23)'sinde, araştırılan PBP genlerinde mutasyon gözlenmemiştir. Ancak bir izolatın (%4.3) incelenen üç PBP gen bölgesinde de değişmiş nükleotid dizisine sahip olduğu ve bu izolatın pulmoner bir örneğe ait olduğu belirlenmiştir. PSSP sonuçları, geleneksel oksasilin testinin tarama alanının, değişime uğramış PBP'leri her zaman tespit edemediğini göstermektedir (Tablo II). Bu sebeple, özellikle invaziv pnömokokal enfeksiyonlarda antibiyotik tedavisine daha fazla dikkat edilmesi gerekmektedir. PSSP ile ilgili benzer sonuçlar daha önceki çalışmalarda da bildirilmiş ve PSSP suşlarında pbp1a, pbp2x ve pbp2b genlerinden bir veya ikisinde saptanan mutasyon varlığı Nagai ve arkadaşları23 tarafından 44 izolat için %13.6, Hiramatsu ve arkadaşları12 tarafından 177 izolat için yaklaşık %45 olarak rapor edilmiştir.
Çalışmamızda, MİK değeri yüksek (≥ 2 µg/ml) PRSP izolatlarının çoğunun (7/8, %87.5) her üç PBP gen bölgesinin de değişikliğe uğramış olduğu saptanmıştır. Bu sebeple, PBP genotiplerinin belirlenmesinin, bölgemizde penisilin direnç seviyesinin tahmin edilmesinde yardımcı olacağı söylenebilir. Ancak yüksek MİK değerine (2-3 µg/ml) sahip PRSP izolatlarından 1 (%12.5)'inde PBP gen bölgesinde mutasyon tespit edilmemiştir (Tablo II). Bu izolatın, DNA dizi analizi veya primer özgüllüğünü artırmak için daha iyi korunmuş bir gen bölgesinin PCR ile detaylı analiz edilmesinin gerekli olduğu düşünülmüştür. POSP izolatları değerlendirildiğinde ise, 31 suşun 1 (%3.2)'inde mutasyon varlığı saptanmamış, diğer suşların beş farklı PBP genotip paterni oluşturduğu görülmüştür (Tablo II). Benzer şekilde, POSP izolatlarındaki bu çeşitlilik başka çalışmalarda21,22,23,24 da bildirilmiş ve beta-laktamlara direnç gelişimiyle sonuçlanan pbp1a, pbp2x ve pbp2b afinitesinde azalma ile ilişkili olduğu vurgulanmıştır1.
Ülkemizde pnömokok aşısı Kasım 2008 tarihinden itibaren uygulanmaya başlamıştır. Aşı uygulanmasından sonra direnç oranlarında değişiklik gözlenmesi beklenmektedir. Ancak çalışmamıza dahil edilen izolatlar, çalışılan tarih aralığındaki tüm dirençli ve duyarlı oranlarını yansıtmadığı için direnç paternlerindeki değişiklikleri izlemek mümkün olmamıştır. Bununla birlikte, çalışmadaki yedi izolat 2009 yılına ait olup, bunlardan bir tanesi penisiline 0.19 µg/ml, bir diğeri de 0.125 µg/ml MİK değeriyle orta duyarlı bulunmuştur.
S.pneumoniae suşlarının içerdiği çeşitli PBP gen dizileri oral streptokoklardaki PBP'lerle yüksek homoloji göstermektedir14. Yaptığımız bu çalışmada, birbirinden farklı PBP genotipine sahip POSP'ler oldukça yüksek oranda bulunmuştur. Bu çeşitliliğe sahip izolatların, insanlarda oral kommensal streptokok türleriyle genetik olarak türler arası rekombinasyonuna ve dirençli klonların nispeten yüksek yoğunluktaki popülasyonlarda kolaylıkla taşınmasına sebep olabileceği belirtilmektedir2,9,25. Bununla birlikte bu homolog dirençli gen aktarımının penisiline dirençli fenotipe her zaman yansımayacağı da ifade edilmektedir2. Ayrıca bu POSP izolatlarının, duyarlı ve dirençli mikroorganizmaların karışık bir popülasyonu anlamına gelen heterojen dirençli suşları içerebileceği de söylenebilir. Genom düzeyinde penisilin direncinden sorumlu mutasyonların gösterilmesi özellikle POSP izolatlarında oldukça önemlidir. Dolayısıyla S.pneumoniae enfeksiyonunun tedavisi, penisiline direnç insidansının artmasına bağlı olarak güçleşmekte, ilk seçenek antibiyotik kullanımının ve aşı çalışmalarının bölgesel olarak düzenlenmesi gerekmektedir. Daha önceki çalışmalarda, özellikle pbp2b'deki mutasyonların, penisiline karşı afinitenin azalmasına neden olduğu belirtilmiş; oldukça heterojen yapıda olan bu bölgenin, penisilin direnci ile ilişkisinin araştırılmasında en iyi hedef gen bölgesi olabileceği vurgulanmıştır9,26,27,28. Bu çalışmada, bütün izolatlar içinde pbp2b gen mutasyonlarının sıklığı (%59.7), araştırılan diğer gen bölgelerinden (pbp1a %58 ve pbp2x %53.2) çok farklı bulunmamıştır.
Günümüzde S.pneumoniae izolatlarında direnç ile ilgili mutasyonların gösterilmesinde, çok lokuslu dizi tiplendirmesi, "pulsed-field" jel elektroforezi (PFGE), BOX-PCR veya DNA dizi analizi gibi moleküler epidemiyolojik teknikler kullanılmaktadır22,24,29. Yapılan çalışmalarda, kullandığımız bu primere özgül PCR tekniği ile pbp1a, pbp2b ve pbp2x genlerinde mutasyonların araştırılmasının, S.pneumoniae'nın beta-laktamlara karşı genetik duyarlılığının belirlenmesinde hızlı, güvenilir ve kullanışlı olduğu belirtilmektedir6,11. Çalışmamızda da, bu yöntem ile izolatların genetik duyarlılığı yönünden doğru veriler elde edilmiştir.
Ülkemizde, penisiline düşük ve yüksek düzeyde dirençli pnömokokların prevalansı sırasıyla %30.2-41.5 ve %7-9.7 arasında değişmektedir30,31,32,33. S.pneumoniae izolatlarının PBP dizilerindeki değişiklikler ilk kez Biçmen ve arkadaşları8 tarafından incelenmiş; 20 izolatta (sekizi yüksek, dokuzu düşük düzeyde penisiline dirençli; üçü penisiline duyarlı) en belirgin mutasyon alanları pbp1a'da T371A, pbp2b'de E481G ile T451A ve pbp2x'de T338A olarak bildirilmiştir. Pınar ve arkadaşları31, penisiline dirençli pnömokok izolatlarının moleküler epidemiyolojisi ile ilgili yaptıkları çalışmada, PCR-RFLP ile pbp2b ve pbp2x genlerindeki heterojeniteyi ve BOX-PCR ile genotipleri analiz etmişler; pbp2b geninde beş, pbp2x geninde ise 12 farklı patern tanımlamışlardır. MİK değerleri ile PBP gen varyasyonları arasındaki ilişki değerlendirildiğinde, pbp2x genlerinin pbp2b genlerinden daha değişken olduğu bulunmuş ve pbp2b genlerindeki varyasyonun düşük düzeydeki penisilin direnci ile ilişkili olduğu belirtilmiştir31. Bizim çalışmamızda da, bütün izolatlar içinde pbp2b gen mutasyonlarının sıklığı (%59.7), araştırılan diğer gen bölgelerinden (pbp1a %58 ve pbp2x %53.2) biraz daha yüksek bulunmuştur.
Sonuç olarak bu çalışma, bölgemizde S.pneumoniae izolatlarında penisiline karşı dirençle ilişkili olan PBP genlerinin üç değişik bölgesinde ortaya çıkan farklı mutasyon paternlerinin sıklığıyla ilgili önemli veriler sağlamaktadır. Verilerimiz, S.pneumoniae izolatlarındaki penisilin direncinin, pbp1a, pbp2x ve pbp2b gen bölgelerinde mutasyonlara sebep olan nükleik asit değişiklikleri ile ilişkili olduğu kavramını desteklemektedir. MİK değerlerinin de aynı şekilde, PRSP izolatlar için pbp1a, pbp2x ve pbp2b gen bölgelerindeki değişikliklerden etkilendiği görünmektedir. Bu doğrultuda, "wild" tip dizilerine özgül PCR tekniğinin bölgemizde S.pneumoniae izolatları arasında, MİK değerleri ile uyumlu olarak penisilin direncini tanımlayabildiği kanısına varılmıştır.
KAYNAKLAR
- Hotomi M, Billal DS, Shimada J, et al. High prevalence of Streptococcus pneumoniae with mutations in pbp1a, pbp2x, and pbp2b genes of penicillin-binding proteins in the nasopharynx in children in Japan. ORL J Otorhinolaryngol Relat Spec 2006; 68(3): 139-45. [Özet]
- Ohsaki Y, Tachibana M, Awaya T, Kuroki M, Itoh Y. Recovery of susceptibility to penicillin G in clinical isolates of Streptococcus pneumoniae despite increased accumulation of PBP gene alterations. Int J Antimicrob Agents 2008; 32(5): 427-31. [Özet]
- Nichol KA, Zhanel GG, Hoban DJ. Penicillin-binding protein 1A, 2B, and 2X alterations in Canadian isolates of penicillin-resistant Streptococcus pneumoniae. Antimicrob Agents Chemother 2002; 46(10): 3261-4. [Özet] [Tam Metin] [PDF]
- Ohsaki Y, Tachibana M, Nakanishi K, et al. Alterations in penicillin binding protein gene of Streptococcus pneumoniae and their correlation with susceptibility patterns. Int J Antimicrob Agents 2003; 22(2): 140-6. [Özet]
- Bayraktar MR, Durmaz B, Kalcioglu MT, Durmaz R, Cizmeci Z, Aktas E. Nasopharyngeal carriage, antimicrobial susceptibility, serotype distribution and clonal relatedness of Streptococcus pneumoniae isolates in healthy children in Malatya, Turkey. Int J Antimicrob Agents 2005; 26(3): 241-6. [Özet]
- Hotomi M, Yamanaka N, Faden H, et al. Nasopharyngeal carriage of drug-resistant Streptococcus pneumoniae in children with acute otitis media evaluated by polymerase chain reaction-based genotyping of penicillin-binding proteins. Acta Otolaryngol 2002; 122(1): 72-7. [Özet]
- Sakata H. Bactericidal activities of parenteral antibiotics and genotype of penicillin-binding protein in Streptococcus pneumoniae and Haemophilus influenzae isolated from children's blood. J Infect Chemother 2006; 12(5): 338-42. [Özet]
- Bicmen M, Gulay Z, Ramaswamy SV, Musher DM, Gur D. Analysis of mutations in the PBP genes of penicillin-non-susceptible pneumococci from Turkey. Clin Microbiol Infect 2006; 12(2): 150-5. [Özet] [Tam Metin] [PDF]
- Ubukata K, Asahi Y, Yamane A, Konno M. Combinational detection of autolysin and penicillin-binding protein 2B genes of Streptococcus pneumoniae by PCR. J Clin Microbiol 1996; 34(3): 592-6. [Özet] [PDF]
- Zapun A, Contreras-Martel C, Vernet T. Penicillin-binding proteins and beta-lactam resistance. FEMS Microbiol Rev 2008; 32(2): 361-85. [Özet] [Tam Metin] [PDF]
- Ubukata K, Muraki T, Igarashi A, Asahi Y, Konno M. Identification of penicillin and other beta-lactam resistance in Streptococcus pneumoniae by polymerase chain reaction. J Infect Chemother 1997; 3(4): 190-7.
- Hiramatsu K, Ohama M, Mijajima Y, et al. Antimicrobial susceptibilities and analysis of genes related to penicillin or macrolide resistance in Streptococcus pneumoniae. Int J Antimicrob Agents 2004; 24(2): 125-9. [Özet]
- Contreras-Martel C, Dahout-Gonzalez C, Martins Ados S, Kotnik M, Dessen A. PBP active site flexibility as the key mechanism for beta-lactam resistance in pneumococci. J Mol Biol 2009; 387(4): 899-909. [Özet]
- Sogstad MK, Høiby EA, Caugant DA. Molecular characterization of non-penicillin-susceptible Streptococcus pneumoniae in Norway. J Clin Microbiol 2006; 44(9): 3225-30. [Özet] [Tam Metin] [PDF]
- Noguchi N, Tano J, Nasu Y, et al. Antimicrobial susceptibilities and distribution of resistance genes for beta-lactams and macrolides in Streptococcus pneumoniae isolated between 2002 and 2004 in Tokyo. Int J Antimicrob Agents 2007; 29(1): 26-33. [Özet]
- Bayer M, Aslan G, Emekdaş G, Kuyucu N, Kanik A. Nasopharyngeal carriage of Streptococcus pneumoniae in healthy children and multidrug resistance. Mikrobiyol Bul 2008; 42(2): 223-30. [Özet] [PDF]
- Aslan G, Emekdas G, Bayer M, Serin MS, Kuyucu N, Kanik A. Serotype distribution of Streptococcus pneumoniae strains in the nasopharynx of healthy Turkish children. Indian J Med Res 2007; 125(4): 582-7. [Özet] [PDF]
- Winn W, Allen S, Janda W, et al (eds). Gram-positive cocci, pp: 674-6. In: Koneman's Color Atlas and Textbook of Diagnostic Microbiology. 2006, 6th ed. Lippincott Williams and Wilkins, Baltimore, MD.
- Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. 18th Informational Supplement, 2008, M100-S18. CLSI, Wayne, PA.
- Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing; 20th Informational Supplement, 2010, M100-S20. CLSI, Wayne, PA.
- Chesnel L, Carapito R, Croizé J, Dideberg O, Vernet T, Zapun A. Identical penicillin-binding domains in penicillin-binding proteins of Streptococcus pneumoniae clinical isolates with different levels of beta-lactam resistance. Antimicrob Agents Chemother 2005; 49(7): 2895-902. [Özet] [Tam Metin] [PDF]
- Zhanel GG, Wang X, Nichol K, et al. Molecular characterisation of Canadian paediatric multidrug-resistant Streptococcus pneumoniae from 1998-2004. Int J Antimicrob Agents 2006; 28(5): 465-71. [Özet]
- Nagai K, Shibasaki Y, Hasegawa K, et al. Evaluation of PCR primers to screen for Streptococcus pneumoniae isolates and beta-lactam resistance, and to detect common macrolide resistance determinants. J Antimicrob Chemother 2001; 48(6): 915-8. [Özet] [Tam Metin] [PDF]
- Sakai F, Chiba N, Ono A, et al. Molecular epidemiologic characteristics of Streptococcus pneumoniae isolates from children with meningitis in Japan from 2007 through 2009. J Infect Chemother 2011; 17(3): 334-40. [Özet]
-
Chiba N, Kobayashi R, Hasegawa K, et al; Acute Respiratory Diseases
Study Group. Antibiotic susceptibility according to genotype of penicillin-binding
protein and macrolide resistance genes, and serotype of Streptococcus
pneumoniae isolates from community-acquired pneumonia in children. J
Antimicrob Chemother 2005; 56(4): 756-60.
[Özet] [Tam Metin] [PDF] - Smith AM, Klugman KP. Alterations in penicillin-binding protein 2B from penicillin-resistant wild-type strains of Streptococcus pneumoniae. Antimicrob Agents Chemother 1995; 39(4): 859-67. [Özet] [PDF]
- Tribuddharat C, Polwichai P, Champreeda P, Srifuengfung S. The sequence of pbp2b from penicillin-resistant Streptococcus pneumoniae in Thailand. J Med Assoc Thai 2010; 93(Suppl 5): S16-26. [Özet]
- du Plessis M, Smith AM, Klugman KP. Rapid detection of penicillin-resistant Streptococcus pneumoniae in cerebrospinal fluid by a seminested-PCR strategy. J Clin Microbiol 1998; 36(2): 453-7. [Özet] [Tam Metin] [PDF]
- Antonio M, Dada-Adegbola H, Biney E, et al. Molecular epidemiology of pneumococci obtained from Gambian children aged 2-29 months with invasive pneumococcal disease during a trial of a 9-valent pneumococcal conjugate vaccine. BMC Infect Dis 2008; 8: 81. [Özet] [Tam Metin] [PDF]
- Yenisehirli G, Sener B. Antibiotic resistance and serotype distribution of Streptococcus pneumoniae strains isolated from patients at Hacettepe University Medical Faculty. Mikrobiyol Bul 2003; 37(1): 1-11. [Özet] [PDF]
- Pinar A, Koseoglu O, Yenisehirli G, Sener B. Molecular epidemiology of penicillin-resistant Streptococcus pneumoniae in a university hospital, Ankara, Turkey. Clin Microbiol Infect 2004; 10(8): 718-23. [Özet] [Tam Metin] [PDF]
- Erdem H, Pahsa A. Antibiotic resistance in pathogenic Streptococcus pneumoniae isolates in Turkey. J Chemother 2005; 17(1): 25-30. [Özet]
- Ilki A, Sagiroglu P, Elgormus N, Soyletir G. Trends in antibiotic susceptibility patterns of Streptococcus pneumoniae and Haemophilus influenzae isolates: four years follow up. Mikrobiyol Bul 2010; 44(2): 169-75. [Özet] [PDF]
İletişim (Correspondence):
Prof. Dr. Gönül Aslan,
Mersin Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
Yenişehir Kampüsü, Mersin, Türkiye.
Tel (Phone): +90 324 341 2815,
E-posta (E-mail): drgaslan@gmail.com