Santral Sinir
Sistemi Enfeksiyonu Etkeni Enterovirusların
RT-PCR ve Hücre Kültür Yöntemleri ile Saptanması*
Identification
of Enteroviruses from Central Nervous System Infections by
RT-PCR and Cell Culture Methods
İlknur
KILIÇ1, İmre ALTUĞLU1, Candan ÇİÇEK1, Hüsnü
PULLUKÇU2, Nuri BAYRAM3, Hadiye ŞİRİN4,
Selda ERENSOY1
1 Ege Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, İzmir.
1 Ege University Faculty of Medicine, Department of Medical Microbiology, Izmir, Turkey.
2 Ege Üniversitesi Tıp Fakültesi, Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı, İzmir.
2 Ege University Faculty of Medicine, Department of Infectious Diseases and Clinical Microbiology, Izmir, Turkey.
3 Ege Üniversitesi Tıp Fakültesi, Çocuk Sağlığı ve Hastalıkları Anabilim Dalı, Çocuk Enfeksiyon Hastalıkları Bilim Dalı, İzmir.
3 Ege University Faculty of Medicine, Department of Pediatrics, Division of Pediatric Infectious Diseases, Izmir, Turkey.
4 Ege Üniversitesi Tıp Fakültesi, Nöroloji Anabilim Dalı, İzmir.
4 Ege University Faculty of Medicine, Department of Neurology, Izmir, Turkey.
* Bu çalışma Ege Üniversitesi Rektörlüğü tarafından desteklenmiştir (Proje no: 2007/TIP/017).
ÖZET
Aseptik menenjit/ensefalitlerin en önemli etkenleri viruslar olup, etiyolojinin belirlendiği aseptik menenjit olgularının %80'inden fazlasından polio dışı enteroviruslar sorumludur. Bu çalışmada, viral santral sinir sistemi (SSS) enfeksiyonu şüpheli hastaların beyin omurilik sıvısı (BOS) örneklerinde, viral kültür ve ters transkripsiyon polimeraz zincir reaksiyonu (RT-PCR) yöntemleri ile enterovirus varlığının araştırılarak epidemiyolojiye katkıda bulunulması ve ticari bir RT-PCR kitinin rutin laboratuvarımız için uygunluğunun araştırılması amaçlanmıştır. Çalışmaya, Ocak 2007-Aralık 2008 tarihleri arasında Ege Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı Laboratuvarları'na klinik ve BOS bulguları açısından viral SSS enfeksiyonu şüphesi olan hastalardan gönderilen ve rutin laboratuvar değerlendirmesinde mikrobiyolojik yöntemler ile bakteriyel, mikobakteriyel, fungal ve viral (HSV, sitomegalovirus) etkenlerin saptanmadığı 66 BOS örneği dahil edilmiştir. Örneklerin 34 (%51.5)'ü kadın, 32 (%48.5)'si erkek hastalara ait olup, hastaların 23 (%34.8)'ü çocuk (5 ay-18 yaş), 43 (%65.2)'ü yetişkin (19-86 yaş) yaş grubunda yer almaktadır. Örneklerden virus izolasyonu için Vero, Hep-2 ve RD hücre serilerini içeren "shell vial" hücre kültürü yöntemi kullanılmış, 48 saatlik inkübasyon sonunda hücreler floresanla işaretli poliklonal antikorlar (Pan-Enterovirus Blend, Light Diagnostics, ABD) ile boyanarak değerlendirilmiştir. Enterovirus RNA'sını saptamak amacıyla ticari bir RT-PCR yöntemi (Enterovirus Consensus Kit, Argene, Fransa) kullanılmıştır. Viral SSS enfeksiyonu şüpheli 66 BOS örneğinin 61 (%92.4)'i, RT-PCR ve hücre kültürü yöntemleri ile enterovirus negatif olarak bulunmuş; 3 (%4.5) BOS örneğinde hücre kültürü ile pozitiflik saptanmıştır. Bu örneklerden biri RT-PCR yöntemi ile de pozitif olarak bulunurken, kalan iki örnek negatif olarak tespit edilmiştir. Hücre kültürü ile negatif olarak saptanan iki örnekte (%3) RT-PCR ile ara değer elde edilmiştir. Hücre kültüründe pozitiflik saptanan üç örnekten ikisi tiplendirme sonucu echovirus olarak tanımlanmış; diğer örneğin miktarı yeterli olmadığından tiplendirme yapılamamıştır. Sonuç olarak, RT-PCR ile ara değer olarak saptanan sonuçlar yorum ve değerlendirmeyi engellemiş ve ayrıca hücre kültürü ile pozitif bulunan iki örneği saptayamadığı için Enterovirus Consensus Kit'in laboratuvarımızda rutin kullanım için pratik olmadığı ve hücre kültürüne üstünlük göstermediği kanısına varılmıştır. Diğer taraftan nükleik asit amplifikasyon testlerinin (NAT) yüksek duyarlılıkları nedeniyle enteroviral SSS enfeksiyonu tanısındaki yararı bilindiğinden, alternatif bir NAT yönteminin özellikle çocuk yaş grubu hastaların BOS örneklerinde hücre kültürü ile paralel değerlendirilmesinin yararlı olacağı düşünülmüştür.
Anahtar sözcükler: Aseptik menenjit; ensefalit; enterovirus, hücre kültürü, polimeraz zincir reaksiyonu; RT-PCR.
ABSTRACT
Viruses are the major causes of aseptic meningitis and encephalitis. Enteroviruses account for more than 80% of the aseptic meningitis cases for which an etiologic agent is identified. The aims of the present study were to identify agents of enteroviral meningitis by viral culture and reverse transcriptase polymerase chain reaction (RT-PCR) methods, to evaluate the appropriateness of a commercial RT-PCR kit for its use in routine laboratory, and to obtain epidemiological data about enteroviral meningitis. Sixty six cerebrospinal fluid (CSF) samples from patients with suspected viral central nervous system (CNS) infection by clinical and CSF biochemical findings, sent to Ege University Faculty of Medicine, Department of Medical Microbiology were included in the study. The CSF samples were all negative for tested bacteria, mycobacteria, fungi, herpes simplex virus and cytomegalovirus. Thirty-four (51.5%) of the samples were from female and 32 (48.5%) were from male patients. Twenty-three (34.8%) patients were children (5 months-18 years) and 43 (65.2%) were adults (19-86 years). Shell vial rapid cell culture method by using Vero, HEp-2 and RD cell lines was performed for virus isolation and the results were evaluated on 48th hours after staining the cells with fluorescein labeled polyclonal antibodies (Pan-Enterovirus Blend, Light Diagnostics, USA). Enteroviral RNA in the samples was detected by a commercial RT-PCR kit (Enterovirus Consensus Kit, Argene, France). Sixty-one (92.4%) of 66 samples from patients with suspected viral CNS infection were found to be negative for enterovirus both with RT-PCR and shell vial cell culture methods. Three samples (4.5%) were positive by shell vial culture method. In one CSF sample that was culture positive, RT-PCR was also positive. However, the remaining two culture positive samples yielded negative result by RT-PCR. Intermediate results with RT-PCR were obtained in two samples (3%) that were identified as negative by cell culture. Two of the three positive samples in cell culture were identified as echovirus, however, the remaining sample could not be identified due to small sample amount. As a result, the commercial assay was found non-practical and labor intensive, giving indeterminant results in some cases and missing two culture positive samples. Since it didn't have an advantage over the cell culture method used, it was found inappropriate for routine diagnosis in our laboratory. On the other hand, it has been known that nucleic acid amplification tests (NAT) have markedly improved the diagnosis of enterovirus infections by increasing the sensitivity compared with cell culture methods. An alternative NAT method should be evaluated in parallel with cell culture method especially in CSF samples of children with suspected viral central nervous system infections.
Key words: Aseptic meningitis; encephalitis; enterovirus; cell culture; polymerase chain reaction; RT-PCR.
Geliş Tarihi (Received): 05.01.2011 • Kabul Ediliş Tarihi (Accepted): 14.03.2011
GİRİŞ
Santral sinir sistemi (SSS) enfeksiyonlarının kliniği akut seyirli ve hızlı ilerleyen tipte olup, yüksek oranda ölüm ve ciddi kalıcı sekeller ile sonuçlanabilir1. Dolayısıyla doğru ve hızlı tanı büyük önem taşımaktadır. Aseptik menenjitlerin en önemli etkenleri ise viruslardır ve etyolojinin belirlendiği aseptik menenjit olgularının %80-95'inden polio dışı enteroviruslar sorumludur1,2. Bunlar arasında en sık rastlanılan tiplerin de coxsackievirus (CxV) B2, B5; echovirus (EcV) tip 4, 6, 9, 11, 16, 30 ve enterovirus (EV) tip 70, 71 olduğu ifade edilmektedir1. Enterovirus enfeksiyonlarının görülme sıklığı, sıcak iklimlerde yaz/sonbahar dönemlerinde artış gösterir; tropikal ve yarı tropikal bölgelerde ise insidans yıl boyunca yüksektir1,2.
İmmün yetmezlik (özellikle konjenital veya edinilmiş hümoral immünite) ve yaş enteroviral menenjit için risk faktörüdür. Yeni doğan ve küçük çocuklar toplumdaki en duyarlı grup olmaları nedeniyle enteroviral menenjitten çoğunlukla etkilenmektedir. Enteroviruslar erişkinlerde de en yaygın aseptik menenjit nedenidir. Artan yaşla birlikte görülme oranı azalmaktadır1,2.
Enteroviral SSS enfeksiyonunun, benzer klinik özelliklere sahip olan farklı viral etkenlerle ve ayrıca diğer tedavi edilebilir veya ölümcül menenjit etkeni olabilen bakteriyel ve herpes simpleks virus (HSV) enfeksiyonlarıyla ayırıcı laboratuvar tanısı yapılmalıdır3,4,5. Enterovirus enfeksiyonlarının tanısında hücre kültürü standart yöntemdir, ancak örnekte yüksek miktarda canlı virus olması gereklidir ve bazı serotipler hücre kültüründe saptanamayabilir6. Enteroviruslar farklı serotipler arasında ortak antijen içermediğinden IgM düzeyleri değişkenlik göstermekte ve bu nedenle antikor testleri SSS enfeksiyonu tanısında yaygın olarak uygulanamamaktadır6. Enterovirusların korunmuş dizileri olan 5'NTR (non-translated region; kodlama yapmayan bölge) bölgesinin hedef alındığı, klinik örneklerden viral RNA'nın araştırılmasına yönelik ters transkripsiyon polimeraz zincir reaksiyonu (RT-PCR) tekniği ile tanının daha hızlı bir şekilde koyulduğu bildirilmektedir3,6. Enteroviral menenjitlerin hızlı tanısı, gereksiz antibiyotik veya antiviral kullanımını ve invazif tanı testlerinin yapılmasını önlemede, hastanede yatış süresini kısaltmada, kalıcı sekel ve ölüm oranlarını azaltmada yararlıdır7.
Bu çalışmada; hücre kültürü ve RT-PCR yöntemleriyle viral SSS enfeksiyonu etkeni olan enterovirusların araştırılması ve görülme sıklığının saptanması amaçlanmış; enterovirusların hızlı tanısında kullanılan RT-PCR yönteminin laboratuvarımızın rutin çalışma programına konulması için performansının değerlendirilmesi planlanmıştır.
GEREÇ ve YÖNTEM
Çalışma Grubu
Çalışmaya, Ocak 2007-Aralık 2008 tarihleri arasında Ege Üniversitesi Tıp Fakültesi (EÜTF), Tıbbi Mikrobiyoloji Anabilim Dalı Laboratuvarlarına klinik ve BOS bulguları açısından viral SSS enfeksiyonu şüphesi olan hastalardan gönderilen ve rutin laboratuvar değerlendirmesinde mikrobiyolojik yöntemler ile bakteriyel, mikobakteriyel, fungal ve viral (HSV, sitomegalovirus) etkenlerin saptanmadığı 66 BOS örneği dahil edildi. Viroloji ve Hücre Kültür Laboratuvarları'nda rutin incelemeler sonrasında kalan örnekler çalışma için -80°C'de saklandı.
Hastalar, acil tıp, enfeksiyon hastalıkları, çocuk sağlığı ve hastalıkları ve nöroloji anabilim dallarında yatarak veya ayaktan tedavi gören hastalardan oluşmaktaydı. Çalışmalar, EÜTF Araştırma Etik Kurulundan alınan onay ile ve hastalardan bilgilendirilmiş onam alınarak, EÜTF Tıbbi Mikrobiyoloji AD, seroloji, hücre kültürü ve moleküler tanı laboratuvarlarında gerçekleştirildi.
Nükleik Asit Amplifikasyon Testi
Enterovirus RNA'sını saptamak amacıyla RT-PCR yöntemi (Enterovirus Consensus Kit, Argene, Varilhes, Fransa) kullanıldı. Enterovirus Consensus Kit, poliovirus 1-3; CxV A1-22, A24; CxV B1-6, EcV 1-9, 11-21, 24-27, 29-33 ve EV 68-71'in dahil olduğu toplam 64 serotipi saptamaktadır. Bu çalışmada kullanılan kit, birçok serotipte ortak olan 5'NTR bölgesinin bir bölümünü hedeflemektedir. Amplifikasyon basamağının ardından amplifiye ürünler, mikrotitrasyon plaklarında enterovirus grubuna özgül biotinli prob ile hibridizasyonun ardından streptavidin peroksidaz konjugatı ile tetrametilbenzidin (TMB) substratı kullanılarak saptandı. 450 nm'de optik dansite değeri okunarak sonuçlar kalitatif olarak değerlendirildi. Pozitif kontroller ve inhibisyon kontrolleri eş zamanlı olarak çalışıldı. Eşik değer (cut-off; CO), iki negatif kontrol (saptama) çukurunun optik dansite (OD)'lerinin ortalaması ile 0.2 toplanarak bulundu. Örneklerin OD değeri ile CO değeri karşılaştırılarak hesaplama yapıldı. Sonuçların değerlendirilmesinde; örnek OD > CO + %10 ise pozitif; örnek OD < CO-%10 ise negatif; örnek OD= CO ± %10 ise sınırda (şüpheli) sonuç olarak kabul edildi. İnhibisyon kontrolü < 0.8 OD veya negatif ve örnek OD'si negatif olan örnekler inhibitör olasılığı nedeniyle değerlendirilmedi.
RT-PCR yönteminin performansının değerlendirilmesi için, kit içeriği dışında, kantitasyonları (103-5 kopya/ml) bilinen QCMD Enterovirus/Parechovirus (QCMD 2007, İskoçya) kalite kontrol örnekleri kullanıldı. Bu örnekler, her çalışmada ekstraksiyon basamakları öncesinde işleme alındı.
Hücre Kültürü
Hücre kültürü, "shell vial" yöntemi ile Vero, HEp-2 ve RD (Rabdomiyosarkoma) hücre dizileri (DSMZ, Almanya) kullanılarak hücre kültürü laboratuvarında sınıf II kabinlerde gerçekleştirildi. Kırksekiz saatlik inkübasyon sonunda hücreler poliklonal antikorlar (Pan-Enterovirus Blend, Light Diagnostics, Chemicon International, Temecula, ABD) ile boyandı ve floresan mikroskopta elma yeşili rengi floresan ışıma görülen hücreler pozitif olarak değerlendirildi.
"Pan-Enterovirus Blend", hücre kültüründe üretilmiş patojenin tanımlanmasında kullanılan ve indirekt immünofloresan antikor test yöntemi ile çalışan bir tarama kitidir. Enterovirusların kapsid antijenine karşı oluşturulmuş floresan izotiyosiyanat (FITC) ile işaretli anti-fare antikorları kullanılarak iki aşamada yapılır. Bu boyama kiti ile EcV 4, 6, 9, 11, 30, 34; CxV B1-B6; poliovirus 1-3 ve EV 70-71 saptanır.
BULGULAR
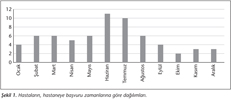
Çalışmaya alınan BOS örneklerinin 34 (%51.5)'ü kadın, 32 (%48.5)'si erkek hastalara ait olup, hastaların yaş aralığı 5 ay-86 yıl arasında değişmektedir (yaş ortalaması: 33.3 yıl, ortanca: 31 yıl). Yirmi üç (%34.8)'ü çocuk (5 ay-18 yaş) ve 43 (%65.2)'ü yetişkin (19-86 yaş) yaş grubunda yer alan hastaların hastaneye başvuru zamanı tüm yıl içine dağılmıştır (Şekil 1).
Hastaların tümü immünkompetan olup, en sık saptanan klinik şikayet ve bulgular; ateş (n= 39, %59), baş ağrısı (n= 25, %38), bilinç değişikliği (n= 25, %38), kusma (n= 21, %32), nöbet (n= 15, %23), bulantı (n= 10, %15), konuşma bozukluğu (n= 9, %14) ve baş dönmesi (n= 7, %11) olmuştur. Bunların dışında, 3 (%4.5) hastada ishal, birer hastada (%1.5) döküntü, görme ve işitme bozukluğu saptanmış; ayrıca 14 (%21.2) hastada belirtilerin başlamasından önce üst solunum yolu enfeksiyonu şikayetlerinin olduğu öğrenilmiştir.
Hastaların fizik muayenesinde, olguların 24 (%36.4)'ünde ense sertliği saptanmıştır. BOS örneklerinin rutin biyokimyasal bulguları; hücre artışı (50-1000/mm3), ılımlı düzeyde protein artışı (< 200 mg/dl) ve normal glukoz (> 45 mg/dl) düzeyleri şeklinde, viral SSS enfeksiyonu ile uyumlu olarak bulunmuştur. BOS örneklerinin değerlendirilmesinde; lökosit sayısı 0-760 (ortalama: 51) hücre/mm3, protein düzeyi 0.43 - 262 (ortalama: 51.32) mg/dl ve glukoz düzeyi 14 - 173 (ortalama: 66.2) mg/dl olarak belirlenmiştir.
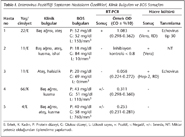
Viral SSS enfeksiyonu şüpheli olgulara ait 66 BOS örneğinin 61'i, RT-PCR ve "shell vial" hücre kültürü sonuçlarına göre enterovirus yönünden negatif bulunmuş; pozitifliğin saptandığı 5 örneğin test sonuçları, hastaların özellikleri ve klinik bulguları Tablo I'de gösterilmiştir.
TARTIŞMA
Enteroviral menenjitin özgül virolojik tanısı, virusun BOS örneğinden izole edilmesine bağlı olmakla birlikte, hücre kültürünün enterovirus serotipleri için duyarlılığı %65-75 arasında değişmektedir1,6. Bu çalışma, laboratuvarda rutin tanı testi olarak kullanılan "shell vial" hücre kültür tekniği ile tasarlanmış ve iki insan (RD, HEp-2) ve bir maymun (Vero) hücre dizisinden oluşan üç ayrı hücre dizisi kullanılmıştır. Bu hücre dizileri, farklı üreme özellikleri olan çok sayıda serotipe sahip enterovirusların üreme şansını artırmak amacıyla seçilmiştir6. "Shell vial" yönteminin geleneksel yönteme göre basit laboratuvar işlemlerine sahip olması, saptama basamağında floresan mikroskopla değerlendirme kolaylığının olması ve 48-72 saat içerisinde sonuç alınması gibi avantajları bulunmaktadır. Bu çalışma ile yöntemin avantajlarına rağmen, az miktarda olan BOS örneğinin toplamda 600 µl kullanılıyor olmasının test tekrarlarını ve farklı yöntemlerle çalışma imkanını kısıtladığı görülmüştür. Dondurulup çözdürülen örneklerde viral yükün düşme olasılığı olduğu için bu çalışmada kullanılan iki ayrı yöntem, örneklerin çoğunluğuna aynı gün içinde uygulanmıştır. Ancak üç ayrı hücre dizisinin kontaminasyon veya hücrelerin sağlıklı olmaması nedeniyle şişelerden (flask) aynı gün "shell vial"lere pasajlanamaması, örnek ekim günü "shell vial"lerdeki hücrelerin tek tabaka şeklinde çoğalamaması nedeniyle bazı örneklere yöntemler farklı günlerde uygulanmıştır. Çalışmaya alınan 66 BOS örneğinin 3 (%4.5)'ü hücre kültürü ile enterovirus pozitif bulunmuş; bu hastaların şikayetleri, fizik muayene ve BOS bulgularının da viral SSS enfeksiyonu ile uyumlu olduğu izlenmiştir (Tablo I).
Son yıllarda hızla gelişen moleküler teknikler, enterovirus enfeksiyonlarının tanısında da geniş kullanım alanı bulmuştur8. BOS örneklerinde enterovirus yükü düşük olduğundan nükleik asit amplifikasyon testlerinin (NAT) enteroviral menenjit tanısında virus izolasyonundan daha duyarlı olduğu bildirilmektedir9,10,11,12,13. NAT ile 5 ile 24 saat gibi kısa bir sürede sonuç alınması testin önemli bir üstünlüğüdür7,14,15. Testin bu avantajı ile hastaların tedavisinde zaman geçirmeden değişikliğe gidilebilir. Kısıtlı miktarda alınabilen BOS örneğinin az miktarda kullanılması da moleküler yöntemlerin bir diğer avantajıdır7,10. Bu çalışmada NAT olarak, ticari RT-PCR temelli Enterovirus Consensus Kit (ECK; Argene, Fransa) kullanılmıştır. Bu kitin, farklı NAT veya hücre kültürü yöntemleri ile karşılaştırıldığı çeşitli çalışmalar mevcuttur. Jacques ve arkadaşlarının14 çalışmasında, 54 BOS örneğinin 28 (%52)'i hücre kültürü; 41 (%76)'i "in house" RT-PCR ve 43 (%80)'ü ticari RT-PCR (ECK) ile enterovirus pozitif bulunmuştur. Landry ve arkadaşlarının10 58'i BOS olmak üzere 82 farklı örnekte NASBA, RT-PCR (ECK) ve tüp kültür yöntemini kullanarak yaptıkları çalışmada, 42 enterovirus pozitif örnek saptanmış; bunların %92.9'u NASBA, %88.1'i RT-PCR ve %60.5'i hücre kültürü yöntemiyle tespit edilmiştir10. Gartzonika ve arkadaşlarının9 ECK ile shell vial hücre kültürünü karşılaştırdıkları çalışmalarında, 99 BOS örneğinin 34'ünde enterovirus pozitifliği bulunmuş; bunların 33 (%97)'ü RT-PCR ile, 19 (%54)'u hücre kültürü ile saptanmıştır.
Bizim çalışmamızda, hücre kültürü ile pozitif saptanan üç örneğin biri RT-PCR ile pozitif, ikisi ise negatif olarak tespit edilmiştir (Tablo I). Hücre kültürü ile pozitif bulunan ikinci hastanın, RT-PCR testinde inhibisyon kontrol OD'sinin 0.8'in altında olması ve örneğin OD'sinin negatif olarak saptanması, hücre kültürü ile saptanan pozitifliğin, inhibitör nedeniyle saptanamadığını düşündürmektedir. Bu hastanın örnek miktarı yetersiz olduğundan RT-PCR tekrarı yapılamamıştır. Hücre kültüründe echovirus pozitif olduğu halde RT-PCR ile negatif saptanan üçüncü hastada ise bu sonucun, örneğin hücre kültürüne ekiminden sonra PCR ile hemen çalışılamaması ve bu nedenle dondurulup çözdürülmesi sırasında RNA'nın degrade olmasına bağlı olabileceği düşünülmüştür. Bu örneğin, farklı bir merkezde 5'NTR bölgesini hedefleyen "in house" PCR ile yapılan tekrarında da enterovirus saptanmamış ve bu sonuç viral degredasyon olasılığını kuvvetlendirmiştir. RT-PCR ile ara değer olarak saptanan dördüncü ve beşinci hastalara ait iki örnek, hücre kültürü ile negatif olarak saptanmıştır. Dördüncü hastanın ikinci kez yapılan RT-PCR testinde de sonuç ara değer olarak bulunmuştur. Bu örneklerin miktarları yetersiz olduğundan hücre kültür tekrarları ve beşinci hastanın ikinci RT-PCR tekrarı yapılamamıştır.
Bazı çalışmalarda viral SSS enfeksiyonu etkeni olarak enterovirusların %80-95 oranında saptanmasına rağmen, bazı araştırıcılar farklı NAT yöntemleri ile bu oranı %3-28 arasında bildirmektedir1,5,16,17,18,19,20. Enteroviral etkenli SSS enfeksiyonu ile ilişkili yapılmış çalışmalar ülkemizde çok sınırlı sayıdadır. Bu konuda özellikle Ulusal Polio Referans Laboratuvarı'nın [Refik Saydam Hıfzıssıhha Merkezi Başkanlığı (RSHMB), Viroloji Laboratuvarları] yapmış olduğu çalışmalar dikkati çekmektedir. Uysal ve arkadaşlarının21 1999 yaz aylarında 35 çocuk olgunun dışkı örneklerinde yaptığı çalışmada, geleneksel hücre kültürü ile EcV 30'un daha baskın (15 örnek) olduğu enteroviral menenjit olguları saptanmıştır. Güney ve arkadaşlarının4 68 aseptik menenjitli yeni doğan hastanın BOS örneklerinde yaptığı çalışmada ise, 36 (%53) örnek geleneksel hücre kültürü ile (EcV 30, CxV B), 43 (%63) örnek "in house" RT-PCR ile enterovirus pozitif bulunmuştur. Özkaya ve arkadaşları22 da, 2001-2004 yılları arasında 246 aseptik menenjit ön tanılı hastanın dışkı, BOS ve boğaz sürüntüsü örneğini geleneksel hücre kültürü ile çalışmışlar; 85 (%34.5) olguya ait toplam 95 örnekte (78 dışkı, 9 BOS, 8 boğaz sürüntüsü) enterovirus saptamışlar ve en sık görülen etkenlerin EcV 30 ve CxV B olduğunu bildirmişlerdir. Bu çalışmalar referans laboratuvarında yapıldığından, gelen örnek sayısının fazla olması ve/veya menenjit salgını olan dönemleri kapsaması, enterovirus saptanma oranının yüksek olmasını açıklayabilir. Ülkemizden bildirilen diğer çalışmalarda BOS örneklerinde enterovirus pozitiflik oranı Karakadıoğlu23 tarafından DNA chip yöntemi ile %5 (2/40), Sayıner ve arkadaşları24 tarafından "in house" RT-PCR ile %38.7 (12/31) olarak verilirken, Deniz'in25 çalışmasında aseptik menenjitli 30 hastanın hiçbirinde hücre kültürü ve gerçek zamanlı PCR ile enterovirus varlığı saptanmamıştır. Bizim çalışmamızda, 66 BOS örneğinin 3 (%4.5)'ü hücre kültürü ile pozitif, biri RT-PCR ile pozitif, 2 (%3)'si ara değer olarak saptanmış; bu hastaların nörolojik ve diğer sistemlere ait şikayet ve belirtileri ile fizik muayene ve BOS biyokimyasal bulguları viral SSS enfeksiyonu ile uyumlu bulunmuştur1,2,26. Buna karşın pozitif olgu sayımızın beklenilenden daha az olduğu dikkati çekmiş ve bunun nedenlerinin şu şekilde sıralanabileceği düşünülmüştür: (1) Pediatrik yaş grubu, enteroviral SSS enfeksiyonları için daha yüksek risk taşımakta olup, yapılan çalışmaların çoğu bu grubu içermektedir. Oysa bizim çalışmamızda olguların sadece %34.8 (23/66)'i çocuk yaş grubundadır ve alınan BOS örneğinin sınırlı miktarda olması rutin tanı testleri sonrasında yetersiz kaldığından birçok çocuk hasta çalışma kriterlerine uyduğu halde çalışmaya alınamamıştır. (2) Enteroviral menenjitlerin hafif semptomlu bir kliniğe sahip olması nedeniyle, enteroviral etkenli SSS enfeksiyonu olan tüm hastalar çalışmamız içinde değerlendirilememiş olabilir. (3) Viral SSS enfeksiyonlarında saptanan etkenlerin bölgelere göre değişmekte olduğu bilindiğinden, pozitif olgu sayısında bölgesel farklılığın da etkili olması mümkündür.
Çalışmaya alınan hastaların hastaneye başvuru zamanı tüm yıl içinde benzer dağılım göstermektedir (Şekil 1). Viral SSS enfeksiyonlarında klinik özellikler birbirine benzese de, yıl içinde bulunduğu dönem özgül etiyolojik etkenin belirlenmesinde ipucu olabilir27. Ülkemizde de bildirildiği gibi enteroviral enfeksiyonlar sıklıkla yaz ve sonbahar aylarında görülmektedir1,21. Bizim hastalarımızın sayısı az olmakla birlikte, hücre kültürü ile pozitif bulunan hastaların sonbahar (eylül, ekim) ve ilkbahar (mayıs) aylarında; RT-PCR ile ara değer olarak bulunan hastaların ise Şubat ve Temmuz ayında başvurduğu belirlenmiştir.
Farklı coğrafyalarda ve farklı dönemlerde SSS enfeksiyonu etkeni olan enterovirusların serotip dağılımının literatürdeki farklı çalışmalarda değişiklik gösterdiği izlenmektedir28,29. Yunanistan ve Güney Kıbrıs gibi ülkemize yakın coğrafyada yer alan ülkelerde en sık EcV tip 11, 9, 30, 13, 6 ile CxV B5 ve A9 etken olarak bildirilmiştir30,31. Bizim çalışmamızda, hücre kültüründe enterovirus pozitifliği saptanan üç örnekten ikisinde tiplendirme yapılmış (1 ve 3 no'lu örnek), diğer örneğin (2 no'lu örnek) miktarı yeterli olmadığından tiplendirme yapılamamıştır. Birinci örnek, RSHMB Ulusal Polio Referans Laboratuvarında tüp kültür ve nötralizasyon yöntemi ile EcV 30 olarak tiplendirilmiş; üçüncü örnek ise laboratuvarımızda FITC işaretli monoklonal antikorlar ile echovirus olarak tanımlanmıştır. Sonuçlarımız, ülkemizde yapılan diğer çalışmaların verileri ile uyumlu bulunmuştur21,22.
Viral SSS enfeksiyonlarının tanısında yüksek duyarlılık ve özgüllüğünün yanı sıra NAT, hastaneye gereksiz yatışların azaltılmasını, daha az beyin BT, MR, röntgen ve EEG kullanılmasını ve hastaların daha kısa süre antibiyotik almasını sağlayarak ciddi ekonomik kazanç sağlamaktadır. Enterovirus Consensus Kit'in örnek içerisinde amplifikasyon inhibitörlerini saptayan plazmid kontrollerini içermesi ile PCR inhibisyonun olup olmadığının görülebilmesi, testin pozitif kontrolünün olması ve enterovirus serotipleri arasında korunmuş bölge olan 5'NTR'yi hedefleyerek 64 enterovirus serotipini saptayabilmesi testin üstünlüğüdür. Ayrıca shell vial yöntemine (72 saat) göre daha kısa zamanda (8 hasta için toplam 9-10 saat) sonuç alınabilmektedir. Buna karşın, her örnek için inhibisyon kontrolünü içeren ikinci bir tüpün olması, işlem sayısının ve süresinin artmasına neden olmakta; ters transkriptaz enziminin amplifikasyon basamakları arasında ısı döngü cihazında pipetlenmesi, hibridizasyon ve ekstraksiyon basamağında uzun ve tekrarlayan pipetleme işlemlerinin olması testi zorlaştırmakta ve hata olasılığını artırmaktadır. Ayrıca ELISA yöntemi ile yapılan saptama basamağında ara değerlerin elde edilmesi, hastaya kesin sonuç verilmesini önlemekte ve yorumu güçleştirmektedir. Sonuç olarak, çalışmalarda belirtilen avantajlarına rağmen Enterovirus Consensus Kit, laboratuvarımızda rutin kullanım için pratik bulunmamış ve hücre kültürüne bir üstünlük sağlamamıştır. Dolayısıyla, enteroviral SSS enfeksiyonlarının tanısında, daha pratik farklı bir nükleik asit amplifikasyon yönteminin, hücre kültürü yöntemi ile paralel olarak, özellikle çocuk yaş grubunu içeren daha geniş çalışma gruplarında değerlendirilmesinin yararlı olacağı kanısına varılmıştır.
TEŞEKKÜR
Teknik yardımlarından dolayı Seyhan Dargı, Sinan Ercan, Nur Tarhan ve Yelda Utangan'a teşekkür ederiz.
KAYNAKLAR
- Tunkell AR, Scheld WM. Acute meningitis, pp: 1083-120. In: Mandell LG, Bennet JE, Dolin R (eds), Principles and Practice of Infectious Diseases. 2005, 6th ed. Elsevier, Philadelphia.
- Rotbart HA. Viral meningitis. Semin Neurol 2000; 20(3): 277-92. [Özet]
- Smalling TW, Sefers SE, Li H, Tang YW. Molecular approaches to detecting herpes simplex virus and enteroviruses in the central nervous system. J Clin Microbiol 2002; 40(7): 2317-22. [Özet] [PDF]
- Guney C, Ozkaya E, Yapar M, Gumus I, Kubar A, Dogancı L. Laboratory diagnosis of enteroviral infections of the central nervous system by using a nested RT-polymerase chain reaction (PCR) assay. Diagn Microbiol Infect Dis 2003; 47(4): 557-62. [Özet]
- Chadwick DR. Viral meningitis. Brit Med Bull 2006; 10(1): 1-14. [Özet] [Tam Metin] [PDF]
- Romero JR, Rotbart HA. Enteroviruses, pp: 1427-38. In: Murray PR, Baron EJ, Pfaller MA, Jorgensen JH, Yolken RH (eds), Manual of Clinical Microbiology. 2003, 6th ed. ASM Press, Washington DC.
- Sawyer MH. Enterovirus infections: diagnosis and treatment. Curr Opin Pediatr 2002; 13(1): 40-7. [Özet]
- Tunkel AR, Glaser CA, Bloch KC, et al. The management of encephalitis: Clinical Practice Guidelines by the Infectious Diseases Society of America. Clin Infect Dis 2008; 47(3): 303-27. [Özet] [Tam Metin] [PDF]
- Gartzonika C, Vrioni G, Levidiotou S. Evaluation of a commercially available reverse transcription-PCR enzyme immunoassay (Enterovirus Consensus Kit) for the diagnosis of enterovirus central nervous system infections. Clin Microbiol Infect 2005; 11(1): 131-7. [Özet] [Tam Metin] [PDF]
- Landry ML, Garner R, Ferguson D. Comparison of the Nuclisens Basic Kit (nucleic acid sequence based amplification) and the Argene Biosoft Enterovirus Consensus reverse transcription-PCR assays for rapid detection of enterovirus RNA in clinical specimens. J Clin Microbiol 2003; 41(11): 5006-10. [Özet] [Tam Metin] [PDF]
- Petitjean J, Vabret A, Dina J, Gouarin S, Freymuth F. Development and evaluation of a real time RT-PCR assay on the LightCycler for the rapid detection of enterovirus in cerebrospinal fluid specimens. J Clin Virol 2005; 35(3): 278-84. [Özet]
- Kupila L, Vuorinen T, Vainionpäa R, Marttila RJ, Kotilainen P. Diagnosis of enteroviral meningitis by use of polymerase chain reaction of cerebrospinal fluid, stool, and serum specimens. Clin Infect Dis 2005; 40 (7): 982-7. [Özet] [Tam Metin] [PDF]
- Leland DS, Ginocchio CC. Role of cell culture for virus detection in the age of technology. Clin Microbiol Rev 2007; 20(1): 49-78. [Özet] [Tam Metin] [PDF]
- Jacques J, Carquin J, Brodard V, et al. New reverse transcription-PCR assay for rapid and sensitive detection of enterovirus genomes in cerebrospinal fluid specimens of patients with aseptic meningitis. J Clin Microbiol 2003; 41(12): 5726-8. [Özet] [Tam Metin] [PDF]
- Mohamed N, Elfaitouri A, Fohlman J, Friman G, Blomberg J. A sensitive and quantitative single-tube real-time reverse transcriptase-PCR for detection of enteroviral RNA. J Clin Virol 2004; 30(2): 150-6. [Özet]
- Read SJ, Kurtz JB. Laboratory diagnosis of common viral infections of the central nervous system by using a single multiplex PCR screening assay. J Clin Microbiol 1999; 37(6): 1352-5. [Özet] [Tam Metin] [PDF]
- Hukkanen V, Vuorinen T. Herpesviruses and enteroviruses in infections of the CNS: a study using time-resolved fluorometry PCR. J Clin Virol 2002; 25(3): 87-94. [Özet]
- Tavakoli NP, Wanga H, Nattanmaia S, Dupuisa M, Fuscoa H, Hulla R. Detection and typing of enteroviruses from CSF specimens from patients diagnosed with meningitis/encephalitis. J Clin Virol 2008; 43(2): 207-11. [Özet]
- Frantzidou F, Kamaria F, Dumaidi K, Skoura L, Antoniadis A, Papa A. Aseptic meningitis and encephalitis because of herpesviruses and enteroviruses in an immunocompetent adult population. Eur J Neurol 2008; 15(9): 995-7. [Özet]
- Capaul SE, Hrisoho MG. Detection of enterovirus RNA in cerebrospinal fluid using NucliSens EasyQ enterovirus assay. J Clin Virol 2005; 32(4): 236-40. [Özet]
- Uysal G, Güven A, Özkaya E, Yılmaz N, Korukluoğlu G. Yaz aylarındaki aseptik menenjitli olgularda etiyolojide echovirüs 30. İnfeksiyon Derg 2002; 16(3): 275-8.
- Özkaya E, Uysal G, Atak T, Alkan M. 2001-2004 yılları arasında aseptik menenjit ön tanılı pediatrik olgulardan izole edilen enterovirus serotiplerinin dağılımı. Mikrobiyol Bul 2005; 39(1): 43-51. [PDF]
- Karakadıoğlu S. Aseptik menenjit ve kardit etyolojisinde enteroviruslerin chip tekniği (microarray) ile araştırılması. Uzmanlık tezi, 2007. Manisa.
- Sayıner AA, Oktem IMA, Ergani A, Ergon C, Kurul S, Abacioglu YH. Detection of herpes simplex virus DNA and enterovirus RNA in cerebrospinal fluid using PCR and microplate or strip hybridization assay (Abstract). Clin Microbiol Infect 2003; 9(Suppl 1): 410.
- Deniz E. Aseptik menenjitli hastaların BOS örneklerinde enterovirüs ve herpesvirüslerin hücre kültürü ve PCR yöntemleri ile araştırılması. Uzmanlık tezi, 2006. Kayseri.
- Archimbaud C, Chambon M, Bailly JL, et al. Impact of rapid enterovirus molecular diagnosis on the management of infants, children, and adults with aseptic meningitis. J Med Virol 2009; 81(1): 42-8. [Özet]
- Sayıner A. Viral santral sinir sistemi enfeksiyonlarında tanı. ANKEM 2005; 19(2): 129-44.
- Santos GPL, Skraba I, Oliveira D, et al. Enterovirus meningitis in Brazil, 1998-2003. J Med Virol 2006; 78(2): 98-104. [Özet]
- Bernit E, Lamballerie X, Zandotti C, et al. Prospective investigation of a large outbreak of meningitis due to Echovirus 30 during summer 2000 in Marseilles, France. Medicine 2004; 83(4): 245-53. [Özet]
- Richter J, Koptides D, Tryfonos C, Christodoulou C. Molecular typing of enteroviruses associated with viral meningitis in Cyprus, 2000-2002. J Med Microbiol 2006; 55(8): 1035-41. [Özet] [Tam Metin] [PDF]
- Dumaidi K, Frantzidou F, Papa A, Diza E, Antoniadis A. Enterovirus meningitis in Greece from 2003-2005: diagnosis, CSF laboratory findings and clinical manifestations. J Clin Lab Anal 2006; 20(5): 177-83. [Özet]
İletişim (Correspondence):
Doç. Dr. İmre Altuğlu,
Ege Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
35100, Bornova, İzmir, Türkiye.
Tel (Phone): +90 232 390 2991,
E-posta (E-mail): imre.altuglu@ege.edu.tr