Hacettepe Üniversitesi Hastanesi Kan Donörlerinde Batı
Nil Virusu Seroprevalansının Araştırılması ve
Pozitif Sonuçların Plak Redüksiyon Nötralizasyon Testi ile Doğrulanması*
Investigation
of West Nile Virus Seroprevalence in Hacettepe University Hospital Blood Donors
and
Confirmation of the Positive Results by Plaque Reduction Neutralization Test
Şeniz AYTURAN1, Sibel AYDOĞAN1, Koray ERGÜNAY1, Osman İ. ÖZCEBE2, Dürdal US1
1 Hacettepe Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Ankara.
1 Hacettepe University Faculty of Medicine, Department of Medical Microbiology, Ankara, Turkey.
2 Hacettepe Üniversitesi Tıp Fakültesi, Hematoloji Bilim Dalı, Kan Bankası ve Transfüzyon Ünitesi, Ankara.
2 Hacettepe University Faculty of Medicine, Blood Bank and Transfusion Unit of Hematology Department, Ankara, Turkey.
* Bu çalışma, ilk yazarın tıpta uzmanlık tez çalışmasını içermekte olup, Hacettepe Üniversitesi Bilimsel Araştırmalar Birimi tarafından desteklenmiştir (Proje no: 09A101004).
ÖZET
Flaviviridae ailesi içinde yer alan Batı Nil virusu (BNV), zarflı, ikozahedral yapılı, tek iplikli pozitif polariteli bir RNA virusudur. İnsana özellikle Culex türü sivrisineklerin ısırmasıyla bulaşan BNV, asemptomatik enfeksiyonlardan ciddi meningoensefalite kadar değişen geniş bir spektrumda klinik tablolar oluşturabilmektedir. Bu çalışmada, seçilmiş sağlıklı bir popülasyonda BNV seroprevalansının belirlenmesi, doğrulanması ve enfeksiyonun bölgemizdeki güncel durumu hakkında bilgi sağlanarak Türkiye verilerine katkıda bulunulması amaçlanmıştır. Çalışmaya, Nisan-Aralık 2009 tarihlerinde Hacettepe Üniversitesi Hastanesi Kan Merkezine başvuran 1200 kan donörüne ait (400 kadın, 800 erkek; yaş aralığı: 18-61 yıl, yaş ortalaması: 37.8) serum örneği dahil edilmiştir. Serum örneklerinde BNV IgG antikor varlığı ELISA yöntemi (Euroimmun, Almanya) ile araştırılmış; taramada pozitif bulunan örneklere, virus ile karşılaşma zamanının belirlenebilmesi için BNV IgG avidite testi uygulanmıştır. BNV IgG antikor pozitifliğinin doğrulanması ise, indirekt immünofloresan antikor (IFA) testi (Euroimmun, Almanya) ve referans yöntem olarak kabul edilen plak redüksiyon nötralizasyon testi (PRNT) ile yapılmıştır. Çalışmada; 19 (%1.6) donöre ait serum örneğinde ELISA ile BNV IgG antikor pozitifliği saptanmış ve örneklerin tümünde yüksek aviditeli IgG antikorları (Avidite indeksi değer aralığı: %67.8-99.2) tespit edilmiştir. BNV ELISA IgG pozitif 19 donörün 8 (%42.1)'inde açık alanda bulunma, sivrisinek/kene teması ve çiğ süt/süt ürünleri tüketme öyküsü gibi risk faktörlerinin bulunduğu izlenmiştir. Doğrulamaya alınan 19 serum örneğinin 15 (%78.9)'i IFA ile, 10 (%52.6)'u ise PRNT testi ile pozitif bulunmuştur. Çalışmamızda 10 örneğin BNV antikor pozitifliği PRNT ile doğrulanmış, buna karşın hem ELISA hem de IFA ile BNV IgG pozitif bulunan sekiz örnek PRNT ile negatif sonuç vermiştir. Bu durum, virusla enfekte hücrelerin substrat olarak kullanıldığı ELISA ve IFA yöntemlerinin, virusun zarf glikoproteinine karşı oluşan nötralizan antikorlardan ziyade, nükleokapsid antijenlerine karşı oluşan nötralizan olmayan antikorları saptadığını düşündürmüştür. Sadece ELISA ile düşük değerde pozitif sonuç veren bir örnek ise testin özgüllük sorunu olarak yorumlanmıştır. Sonuç olarak çalışmamızda, ELISA ile kan donörlerinin %1.6 (19/1200)'sında saptanan pozitiflik, altın standart yöntem olan PRNT ile %0.8 (10/1200) olarak doğrulanmıştır. Bu çalışmanın sonuçları, bölgemiz için düşük oranda bulunmasına rağmen, ülkemizdeki BNV enfeksiyonlarının, sürveyans ve kontrol programları içerisine dahil edilebilir özellikte olduğunu düşündürmektedir.
Anahtar sözcükler: Batı Nil virusu; kan donörü; seroprevalans; plak redüksiyon nötralizasyon testi; ELISA; IFA.
ABSTRACT
West Nile virus (WNV), a member of Flaviviridae family, is an enveloped, icosahedral, single-stranded positive-sense RNA virus. WNV is transmitted to humans by infected mosquitoe (especially Culex spp.) bites and cause a variety of clinical outcomes, ranging from asymptomatic infection to severe meningoencephalitis. The aims of this study were to determine and confirm the WNV seroprevalence in a chosen healthy population and to provide epidemiological data for Turkey about the recent status of the infection at our region. A total of 1200 serum samples collected from blood donors (400 were female, 800 were male; age range: 18-61 years, mean age: 37.8) who were admitted to Hacettepe University Hospital Blood Donation Center between April to December 2009, were included to the study. The presence of WNV IgG antibodies were screened by ELISA (Euroimmun, Germany), and the positive samples have been further investigated by WNV IgG avidity test in order to estimate the time of encounter to the virus. Indirect immunofluorescence antibody (IFA) test (Euroimmun, Germany) and plaque reduction neutralization test (PRNT) which is accepted as the reference method, were performed for the confirmation of WNV IgG positive results. Nineteen (1.6%) of the samples yielded WNV IgG positivity with ELISA, and all of which were IgGs with high avidities (Avidity index values were between 67.8-99.2%). Eight of 19 (42.1%) WNV ELISA IgG positive donors, had risk factors such as joining outdoor activities, contact with mosquitos and ticks and consuming raw milk and milk products. Of 19 samples that were taken into confirmation tests, 15 (78.9%) were found positive with IFA, and 10 (52.6%) were found positive with PRNT. WNV antibody positivity of 10 samples were then confirmed by PRNT, however eight samples which were found positive with both ELISA and IFA yielded negative results with PRNT. This data might indicate that ELISA and IFA methods in which virus-infected cells were used as substrates, have detected non-neutralizing antibodies against viral nucleocapsid antigens rather than the neutralizing antibodies detected against envelope glycoproteins by PRNT method. One sample which yielded low positive result only by ELISA test has been evaluated as a specificity issue of the test. As a result, the positivity rate (19/1200; 1.6%) of WNV IgG detected by ELISA in blood donors, has been confirmed as 0.8% (10/1200) by a gold standard method, PRNT. The data of this study indicated that the prevalence of WNV infections, although low in our region, deserves attention to be considered in surveillance and control programs related to WNV in Turkey.
Key words: West Nile virus; blood donor; seroprevalence; plaque reduction neutralization test; ELISA, IFA.
Geliş Tarihi (Received): 05.08.2010 • Kabul Ediliş Tarihi (Accepted): 21.10.2010
GİRİŞ
İlk kez 1937 yılında tanımlanan Batı Nil virusu (BNV), Flaviviridae ailesi, Flavivirus cinsi ve Japon ensefaliti virusu (JEV) serokompleksi içerisinde sınıflandırılan, 45-50 nm büyüklüğünde, zarflı ve ikozahedral yapılı bir virustur1. BNV'nin tek iplikli pozitif polariteli RNA genomu; kapsid (C), membran (prM/M) ve zarf (E) proteinleri olmak üzere üç yapısal ve yedi yapısal olmayan (NS1, NS2A, NS2B, NS3, NS4A, NS4B, NS5) protein kodlamaktadır. Yapısal proteinler, olgun virionun yapısını oluştururken, yapısal olmayan proteinler viral transkripsiyon ve replikasyonu düzenlemekte ve virusun konak immün yanıtından kaçmasını kolaylaştırmaktadır2,3.
BNV'nin doğal yaşam döngüsü, başta Culex türleri olmak üzere sivrisinekler ve kuşlar arasında gerçekleşir4,5. BNV'nin insana bulaşmasında en önemli ve primer yol enfekte sivrisineklerin ısırmasıdır; ancak kan transfüzyonu, organ transplantasyonu, transplasental yol, anne sütü ve enfekte hayvanlarla yakın temas sonucu kazanılan enfeksiyonlar da bildirilmiştir4,6. İnsanda BNV enfeksiyonları büyük oranda (%80) asemptomatik seyretmekte, enfekte olan kişilerin yaklaşık %20'sinde kendiliğinden iyileşen hafif ateşli hastalık (Batı Nil Ateşi) gelişmektedir1,7. BNV enfeksiyonu olan hastalarda santral sinir sistemi (SSS) tutulumu ile ciddi hastalık gelişme oranı ise %1'den az oranda bildirilmektedir3,7. Enfekte kişilerde, miyokardit, pankreatit ve fulminant hepatit gibi nörolojik olmayan diğer ciddi komplikasyonlar ise nadiren saptanmaktadır6-8. BNV enfeksiyonlarının tanısı, klinik olarak hastalık belirtilerinin görülmesi ve özgül laboratuvar test sonuçlarının klinik ile uyumu sonucu konulur4. Virolojik tanıda, kan veya beyin omurilik sıvısı (BOS)'nda BNV'ye özgül antikorların veya viral nükleik asidin gösterilmesi esastır. Klinik örnekten virus izolasyonu ise, viremi düzeyinin düşük ve kısa süreli olması nedeniyle genellikle başarılı olmamaktadır4,9,10.
Batı Nil virusu günümüzde dünyanın birçok ülkesinde saptanmaktadır6. Coğrafi açıdan Türkiye, BNV salgınlarının olduğu ve insan/hayvan olgularının sıklıkla tespit edildiği ülkelerle yakın ilişkili bir konumda yer almaktadır. Ayrıca ülkemiz, iklim ve ekolojik koşullar, sivrisinek faunası ve vektör aktiviteleri ile göçmen kuşların göç yolları üzerinde bulunması açısından BNV dolaşımına oldukça açık bir konumdadır. Ülkemizde BNV seropozitifliği ile ilgili veriler 30 yıldan uzun süredir bilinmekte ve her geçen gün yeni yayınlarla desteklenmektedir11,12,13,14,15,16,17. Son olarak Ağustos 2010 tarihinde, Manisa ve çevresinde menenjit tablosu ile seyreden olguların ortaya çıkışı ve hastalardan üçünün ölümü ile de, bu virus ülkemizin gündemindeki yerini almıştır18.
Türkiye'deki varlığının gösterilmesine karşın, BNV seroprevalansının bölgelerimize göre dağılımına ilişkin veriler sınırlıdır. Buna ek olarak, gerçek BNV seropozitifliğinin belirlenmesi için, çalışmalarda yaygın olarak kullanılan hızlı serolojik testler (örn. ELISA) ile alınan pozitif sonuçların, flaviviruslar arasında görülen çapraz reaksiyonlar nedeniyle doğrulanma zorunluluğu vardır. Bu çalışmanın amacı, Hacettepe Üniversitesi Hastanesi Kan Merkezine başvuran sağlıklı kan donörlerinde BNV seroprevalansının araştırılması ve elde edilen pozitif sonuçların altın standart yöntem olan plak redüksiyon nötralizasyon yöntemi ile doğrulanmasıdır.
GEREÇ ve YÖNTEM
Bu çalışmaya, Nisan-Aralık 2009 tarihleri arasında Hacettepe Üniversitesi Tıp Fakültesi Kan Merkezine başvuran 1200 kan donörü dahil edildi. Çalışma için Etik Kurul onayı alındı (Onay No: HEK 08/150-25) ve tüm donörler "Aydınlatılmış Onam Formu" ile bilgilendirildi. Çalışmaya katılmayı kabul eden donörlere, yaş, meslek, sürekli yaşanılan yer ve arboviral enfeksiyonlar açısından muhtemel risk faktörlerini belirleyici anket uygulanarak yanıtlar kaydedildi.
BNV IgG Antikorlarının ELISA ile Araştırılması ve Avidite Testi
Kan donörlerine ait serum örneklerinde BNV IgG varlığı, virusla enfekte hücre lizatının substrat olarak kullanıldığı ticari bir ELISA kiti (Euroimmun, Almanya) ile araştırıldı. Yöntem, örneklerin 1/101 oranında sulandırılmasıyla üretici firmanın önerilerine göre uygulandı ve değerlendirmede BNV IgG düzeyinin ≥ 20 RU/ml olarak tespit edilmesi pozitiflik olarak kabul edildi. Üretici firma BNV IgG ELISA testinin duyarlılığını %99.5, özgüllüğünü ise %96.9 olarak vermektedir.
ELISA ile tarama sonucunda pozitif bulunan örneklere, virus ile karşılaşma zamanının öngörülebilmesi için ELISA temelli BNV IgG avidite testi (Euroimmun, Almanya) uygulandı ve avidite indeksi (Aİ) > %60 bulunan örnekler yüksek aviditeli IgG pozitifliği olarak değerlendirildi.
BNV ELISA IgG Pozitifliğinin Doğrulanması
ELISA yöntemi ile BNV IgG antikorları pozitif/şüpheli pozitif bulunan örneklerin doğrulanması; duyarlılık ve özgüllüğü ELISA yöntemine göre görece olarak daha yüksek olan indirekt immünofloresan antikor (IFA) yöntemi ve altın standart olarak kabul edilen plak redüksiyon nötralizasyon testi (PRNT) ile yapıldı9.
IFA yöntemi: Bu yöntem, virusla enfekte hücrelerin substrat olarak kullanıldığı ticari bir kit (Euroimmun, Almanya) ile gerçekleştirildi. Örnekler 1/100 titrede çalışıldı ve floresan mikroskopta pozitif ve negatif kontrol serumları ile alınan floresansın şiddeti ile karşılaştırılarak değerlendirildi. Sonuçlar kalitatif olarak zayıf (+), orta (++) ve güçlü (+++) pozitif şeklinde yorumlandı. Üretici firma, BNV IgG IFA testinin duyarlılığını %100, özgüllüğünü ise %98 olarak vermektedir.
PRNT'de kullanılan virus suşu ve üretilmesi: Standart BNV suşu (West Nile virus NY99-4132 strain), Ankara Üniversitesi Veteriner Fakültesi, Viroloji Anabilim Dalı virus koleksiyonundan sağlandı ve laboratuvarımızda çoğaltılıncaya kadar -80°C'de saklandı. Daha önceden plak yöntemi ile kantitasyonu yapılmış olan bu suş [3 x 105 plak oluşturan ünite (pfu)/ml], çalışmada, virus kontrol çukurunda 50-100 adet plak oluşturmak üzere 1/300 oranında sulandırılarak kullanıldı.
BNV'nin üretilmesi amacıyla kullanılan Vero (Afrika yeşil maymun böbrek) hücre kültürleri (ATCC CCL81), Ankara Üniversitesi Veteriner Fakültesi, Viroloji Anabilim Dalından sağlandı ve standart yöntem ile pasajları yapılarak laboratuvarımızda idame ettirildi19. 25 cm2'lik şişede tek tabaka halinde üretilmiş Vero hücre kültürüne standart BNV suşunun ekimi ve üretilmesi, daha önce tarif edildiği şekilde yapıldı20. Virusun ekiminden sonra hücreler günlük olarak sitopatik etki (CPE) varlığı yönünden izlendi ve hücrelerin %80-90'ında piknozis tipi CPE'nin görüldüğü üçüncü gün sonunda, hücre kültürü şişesi -80°C'lik derin dondurucuya kaldırıldı (Resim 1). Ertesi gün uygulanan çözme işlemi sonucu, hücreler şişe yüzeyinden kaldırıldı, hücre süspansiyonu iyice homojenize edilerek 3000 devirde 10 dakika santrifüj edildi. Santrifüj işleminden sonra virusun bulunduğu üst sıvı alındı ve birer ml'lik hacimlerde -80°C'de saklandı.
PRNT'nin uygulanması: Sonuçların doğrulanmasında referans yöntem olan PRNT daha önceden tanımlandığı şekilde uygulandı20,21,22. Bu amaçla, 24 çukurlu mikroplaklarda tek tabaka olarak üretilen Vero hücre kültürleri kullanıldı. Serum örnekleri 56°C'de 30 dakika inaktive edildikten sonra, her bir örneğin DMEM (Dulbecco's Modified Eagle Medium; Sigma-Aldrich, Almanya) vasatı ile 1/20 ve 1/40 sulandırımları hazırlandı. Stok virus suşu çözülerek DMEM içinde 1/300 oranında sulandırıldı ve her bir serum dilüsyonu ile 1:1 hacimde steril ependorf tüpler içerisinde karşılaştırıldı. 37°C'de bir saat inkübasyondan sonra, virus ile karıştırılmış örnek sulandırımları mikroplaklarda üretilmiş ve vasatları boşaltılmış hücre kültürlerine 200'er µl inoküle edildi. Her bir örnek sulandırımı (1/20 ve 1/40) için ikişer çukur kullanıldı. Mikroplağın son sırasındaki ikişer çukur ise, hücre kontrolü (sadece DMEM eklenen) ve virus kontrolü (sadece virus süspansiyonu eklenen) olarak ayrıldı. Mikroplak, %5 CO2'li etüvde 37°C'de bir saat inkübe edilerek virusun -eğer antikorlar tarafından nötralize edilmemiş ise- hücrelere adsorbe olması sağlandı. İnkübasyon sonrası, her bir mikroplak çukuruna, ortamın stabilize edilmesi amacıyla 1 ml %1.6'lık karboksi-metil-selüloz (CMC; Sigma-Aldrich, Almanya) ilave edildi. Mikroplaklar aynı koşullarda inkübasyona bırakıldı ve günlük olarak CPE odakları (plak) yönünden izlendi. İnkübasyonun dördüncü gününde, hücrelerin üzerindeki CMC uzaklaştırılmaksızın, tüm çukurlara fosfat tamponu içinde hazırlanmış %10'luk formaldehid solüsyonu eklendi ve 20 dakika oda ısısında fikse edildi. Fiksasyon işleminden sonra hücreler %0.35'lik kristal viyole ile boyandı, kurutuldu ve her örnek sulandırımlarına ait çukurlarda oluşan plaklar sayıldı. Yöntemin geçerliliği; hücre kontrol çukurlarında hiç plak oluşmaması, virus kontrol çukurlarında ise > 80 adet plak oluşumunun gözlenmesi olarak kabul edildi21,22. Değerlendirmede, virus kontrol çukurlarından elde edilen ortalama plak sayısı ile serum örneklerinin bulunduğu çukurlardaki ortalama plak sayısı karşılaştırıldı. Virus kontrol çukurundaki plak sayısının %80 ve daha yüksek oranda azalmasına yol açan en yüksek serum sulandırımı, o örneğin BNV nötralizan antikor titresi (PRNT80) olarak değerlendirildi.
Hücre kültürü, virus izolasyonu ve nötralizasyon çalışmalarının tümü biyogüvenlik kabininde (Labgard 440 Class II Type A2 Biosafety Cabinet, NuAire, ABD) gerçekleştirildi.
BULGULAR
Çalışmaya alınan 1200 kan donörünün 400'ü kadın, 800'ü erkek olup yaşları 18-61 yıl arasında (yaş ortalaması 37.8 yıl) değişmektedir. Donörlerin 1061 (%88)'i Ankara ili ve ilçelerinde, 45 (%4)'i İç Anadolu bölgesinin diğer illerinde, 94 (%8)'ü ise diğer bölgelerimizde ikamet etmektedir.
ELISA yöntemi ile donörlerin 19 (%1.6)'unda BNV IgG pozitifliği saptanmış; bu örneklerin tümünde BNV IgG antikorlarının yüksek aviditeye sahip olduğu belirlenmiştir (Tablo I).
Kan donörlerinin %61 (730/1200)'inde arboviral enfeksiyonlar için risk faktörü varlığı saptanmış; bunların da 13 (%1.8)'ünde BNV IgG antikorlarının pozitif olduğu tespit edilmiştir (Tablo II). BNV ELISA IgG pozitif 19 kan donörünün ise 8 (%42.1)'inde risk faktörü mevcuttur (Tablo I).
Çalışmamızda, ELISA ile BNV IgG pozitif bulunan 19 örneğin yedisi güçlü, yedisi orta ve 1 (%5.2)'i zayıf pozitif olmak üzere toplam 15 (%78.9)'i IFA ile de pozitif sonuç vermiştir (Tablo I).
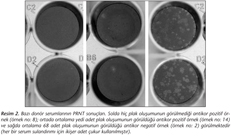
Referans yöntem olan PRNT sonuçları irdelendiğinde; BNV ELISA IgG pozitif 19 serum örneğinin dokuzunda 1/40, birinde ise 1/20 titrede olmak üzere toplam 10 (%52.6)'unda pozitiflik saptanmış ve BNV antikor varlığı doğrulanmıştır (Tablo I) (Resim 2). Örneklerden elde edilen PRNT sonuçları, ELISA IgG ve IFA IgG sonuçları ile karşılaştırmalı olarak Tablo III'te görülmektedir.
TARTIŞMA
BNV'nin yayılımı, önceleri Afrika, Asya, Avrupa, Orta Doğu ve Avusturalya gibi Eski Dünya ülkelerinde sınırlı iken, Ağustos 1999 tarihinde New York şehri salgını ile Yeni Dünya'ya da ulaşmış ve Amerika kıtasına hızla yayılarak 2009 yılına kadar yaklaşık 29.600 insan (1423 ölüm) olgusunun ortaya çıkmasına neden olmuştur5,8,10,23. Türkiye, BNV'nin endemik ve epizootik olarak görüldüğü bir coğrafi bölgenin ortasında yer almaktadır24. Ülkemizde BNV enfeksiyonlarının varlığı, ilk kez serolojik olarak 1977 yılında Meço'nun11 çalışmasıyla ortaya konmuştur. Bu araştırıcı, Güneydoğu Anadolu bölgesi popülasyonunda hemaglütinasyon önlenim yöntemi ile BNV seropozitifliğini %42.8 oranında saptamış; 1980 yılında ise Serter12, Ege bölgesi popülasyonunda BNV seropozitifliğini yine hemaglütinasyon önlenim yöntemi ile %29.1 oranında bildirmiştir. 2006 yılında Özkul ve arkadaşları13, Türkiye'nin çeşitli bölgelerindeki farklı hayvan türlerinde PRNT yöntemi ile %1-37.7, insanlarda ise %20.4 oranında BNV seropozitifliği rapor etmişlerdir. Ergünay ve arkadaşlarının14 2007 yılında Güneydoğu Anadolu bölgesinde yaptıkları çalışmada, 181 sağlıklı kişinin %16'sında IFA yöntemiyle pozitiflik bulunmuş ve bunların %9.5i PRNT ile doğrulanmıştır. Ankara'da Hızel ve arkadaşlarının15 yaptıkları çalışmada, Gazi Üniversitesi Hastanesine başvuran 2821 sağlıklı kan donöründe BNV seropozitifliği ELISA yöntemi ile %2.4 olarak bildirilmiş, ancak bu çalışmada PRNT ile doğrulama yapılmamıştır. Ergünay ve arkadaşlarının16 Orta Anadolu bölgesi kan merkezlerine başvuran kan donörlerinde yaptıkları çalışmada ise, 2516 kan donörünün 25 (%1)'inde ELISA yöntemi ile BNV IgG seropozitifliği saptanmış ve bunların 14 (%0.6)'ü PRNT yöntemi ile doğrulanmıştır.
Sunulan bu çalışmada, Hacettepe Üniversitesi Tıp Fakültesi Kan Merkezine başvuran sağlıklı kan donörlerinde BNV IgG antikor varlığının ELISA yöntemi ile araştırılması ve pozitif sonuç alınan örneklerin doğrulanarak Türkiye'deki BNV seroepidemiyolojik verilerine katkıda bulunulması amaçlanmıştır. Ek olarak, bölgemizde BNV aktivitesinin varlığı ve düzeyinin belirlenmesi, BNV hastalıklarının belirtileri ve tanı yöntemleri konusunda bilinç oluşturulmasına yardımcı olacak ve tanısı konulamayan ateşli hastalıklar ve MSS enfeksiyonları konusuna katkıda bulunacaktır. Çalışmamızda, kan donörlerinin %1.6 (19/1200)'sında ELISA ile BNV IgG antikor pozitifliği saptanmış ve bu sonuç bölgemizde yapılan diğer çalışmaların sonuçlarıyla uyumlu bulunmuştur15,16.
BNV enfeksiyonlarının serolojik tanısında antikor kinetiğinin takibi, akut enfeksiyonun geçirilme zamanı ile ilgili bilgi edinmede yetersiz kalabilir. Bu durumda IgG avidite testleri ek bir yöntem olarak önerilmektedir25,26,27. Çalışmamızda, BNV ELISA IgG pozitif 19 donörün serum örneklerine, virus ile karşılaşma zamanının öngörülebilmesi amacıyla BNV IgG avidite testi uygulanmış ve örneklerin tümünde yüksek aviditeli IgG pozitifliği saptanmıştır (Tablo I). Bu sonuç, donörlerin BNV ile karşılaşmasının altı ay ve daha öncesinde olduğunu vurgulamaktadır26.
Çalışmaya katılan donörlerin sorgulanması sonunda, %61 (730/1200)'inde arboviral enfeksiyonlar için risk faktörü varlığı saptanmış; bunların da 13 (%1.8)'ünde BNV IgG antikor pozitifliği tespit edilmiştir (Tablo II). Diğer taraftan, ELISA ile BNV IgG antikor pozitifliği saptanan 19 kan donörünün risk faktörleri değerlendirildiğinde; 8 (%42.1)'inde açık alanda bulunma, sivrisinek/kene teması ve çiğ süt/süt ürünleri tüketme öyküsü gibi risk faktörlerinin bulunduğu izlenmiş, 11 (%57.9)'inde ise herhangi bir risk faktörünün olmadığı görülmüştür (Tablo I). Ancak bu sonuç ihtiyatla değerlendirilmelidir; zira bir kişinin hayatı boyunca bir sivrisinek tarafından ısırılmamış olması -özellikle de ülkemiz koşullarında- pek olası görünmemektedir. Dolayısıyla negatif yanıt veren bu donörlerin, risk faktörü mevcudiyeti açısından sorgulanmaları sırasında, sivrisinek ısırığını beyana değer bulmama, göz ardı etmiş ya da unutmuş olma olasılığı daha yüksek görünmektedir.
BNV enfeksiyonlarının laboratuvar tanısında en yaygın olarak kullanılan yöntemler serolojik testlerdir9. Bu amaçla sıklıkla ELISA yönteminin tercih edilmesine karşın, IFA ve hemaglütinasyon önlenim testleri de uygulanmaktadır25,28. Ancak, BNV'ye karşı bu yöntemlerle elde edilen antikor pozitifliği, antijenik olarak yakın ilişkili flaviviruslar arasındaki çapraz reaksiyonlar yönünden dikkatle değerlendirilmeli ve yalancı pozitifliğin dışlanabilmesi için altın standart yöntem olan PRNT ile doğrulanmalıdır4,10,25,29. Almanya'da 2004-2005 yıllarında yapılan bir çalışmada, kan donörlerinde ELISA yöntemi ile %5.9 oranında saptanan pozitiflik, nötralizasyon testi ile doğrulandığında %0.03'e gerilemiştir30. Benzer olarak Yunanistan'da 2007 yılında yapılan çalışmada da, 392 kan donörünün 6 (%1.5)'sında ELISA ve IFA yöntemleri ile BNV IgG pozitifliği saptanmış, bunların 4 (%1)'ü nötralizasyon yöntemi ile doğrulanmıştır31. Çalışmamızda, ELISA yöntemi ile BNV IgG pozitif bulunan örnekler, duyarlılık ve özgüllüğü görece olarak daha yüksek olan IFA ile tekrar çalışılmış ve doğrulama altın standart PRNT yöntemi ile yapılmıştır9,21,25,28. BNV ELISA IgG pozitif 19 serum örneğinin 15 (%78.9)'i IFA ile de pozitif sonuç vermiş; IFA ile negatif sonuç alınan dört örneğin ise kantitatif ELISA değerlerinin düşük olduğu izlenmiştir (Tablo I). ELISA yönteminde ≥ 20 RU/ml değerleri pozitif kabul edilmekle birlikte, üç örneğin (no: 6, 15, 19) IgG düzeyleri sırasıyla; 28.3, 25.6 ve 36.4 RU/ml olarak saptanmış, bir örneğin (no: 10) ise sınırda pozitif (17.6 RU/ml) değer verdiği görülmüştür (Tablo I). Buna karşın kantitatif ELISA değerleri ile kalitatif IFA değerleri arasında bir korelasyon olmadığı da dikkati çekmiştir (Tablo I). Bu sonuçlar, IFA yönteminin analitik duyarlılığının ELISA yöntemine göre daha düşük olduğunu düşündürmektedir.
PRNT yöntemi ile çalışılan 19 serum örneğinin 10 (%52.6)'undan pozitif sonuç alınmış ve bu 10 örneğin dokuzu 1/40, biri ise 1/20 titrede pozitif sonuç vermiştir (Tablo I). Dolayısıyla 10 donöre ait örnekte (no: 3, 6, 7, 8, 10, 11, 13, 14, 16, 19) BNV antikor varlığı doğrulanmıştır. Çalışmamızın en ilginç ve yoruma açık bulgusu, ELISA ve IFA ile BNV IgG pozitif bulunan sekiz donöre ait (no: 1, 2, 4, 5, 9, 12, 17 ve 18) serum örneğinde PRNT ile negatif sonuç alınmış olmasıdır (Tablo I). Bu durum, bu örneklerde ELISA ve IFA ile saptanan antikorların nötralizan özellikte olmayan (non-neutralizing antibody) antikorlar olduğunu düşündürmektedir. Benzer sonuçlar Niedrig ve arkadaşlarının çalışmasında da bildirilmiştir32. Bizim çalışmamızda kullanılan ELISA yönteminde, çukurların kaplı olduğu antijenler BNV ile enfekte hücre lizatından oluşmaktadır. Yine çalışmamızda kullandığımız IFA yönteminde, lam üzerine fikse edilen substratlar da BNV ile enfekte edilmiş hücre kültürü örnekleridir. Dolayısıyla bu yöntemlerde, BNV antikorları ile birleşen antijenler, daha ziyade virusun replikasyonu sırasında hücre içinde biriken kapsid ve membran antijenleridir. Oysa nötralizan antikorlar, virusun zarf glikoproteinlerine (E) karşı oluşan antikorlardır. PRNT yönteminde plak oluşumunun azalması ya da inhibisyonu, bu antikorların serbest virusun yüzey glikoproteinlerine bağlanması sonucu hücreleri enfekte etmesini önlemesi sonucu ortaya çıkmaktadır. Bu durumda, ELISA ve IFA yöntemleri ile saptanan pozitif sonuçların, PRNT yöntemi ile yüksek uyum göstermesi doğal olarak beklenilen bir sonuç değildir32. Örneklerden birinde ise (no: 15), sadece ELISA yöntemi ile saptanan pozitiflik, testin özgüllük sorunu olarak yorumlanmıştır.
Ülkemizde BNV ile ilgili olarak uzun zamandır bilinen gerçeklere karşın, klinik BNV olgularının bildirildiği ilk resmi açıklama T.C. Sağlık Bakanlığı tarafından Ağustos 2010 tarihinde yapılmıştır33. Manisa ilinde ortaya çıkan nedeni belirlenemeyen menenjit benzeri 16 olgunun serum ve BOS örnekleri Refik Saydam Merkez Hıfzıssıhha Enstitüsü, Viroloji Bölümüne gönderilmiş ve bu olguların üçünde BNV enfeksiyonu saptanmıştır. Daha sonra Sakarya, İzmir, Aydın ve Isparta'dan toplam dört yeni olgu daha Batı Nil ateşi olarak tanımlanmıştır. Batı Nil enfeksiyonu tanısı konulan bu yedi hastadan üçü kaybedilmiştir18,33. Ege bölgesinde ortaya çıkan bu olguların, yakın komşumuz Yunanistan'da34 aynı tarihlerde ortaya çıkan bir salgının hemen sonrasında saptanması, vektör ve rezervuar hareketlerinin ülkemizi yakından etkilediğini vurgulamaktadır. Ayrıca, son yıllarda ortaya çıkan epidemilerde BNV'nin virülansında artışın olması ve klinik BNV enfeksiyonlarının daha ciddi seyretmesi, ileri tarihlerde bu virusun ülkemiz için de büyük sorunlar oluşturabileceğini düşündürmektedir35.
Sonuç olarak çalışmamızda, Hacettepe Üniversitesi Tıp Fakültesi Kan Merkezine başvuran donörlerde BNV IgG seropozitiflik oranı ELISA yöntemi ile %1.6 (19/1200) olarak saptanmış ve PRNT yöntemi ile %0.8 (10/1200) olarak doğrulanmıştır. Çalışmamızda, kan donörlerinde saptanan bu düşük BNV IgG pozitiflik oranı, donörlerin BNV açısından rutin olarak taranmasının -şimdilik- gerekli olmadığını vurgulamaktadır. Buna karşın seçilmiş sağlıklı bir gruptan elde edilen sonuçlarımız, BNV enfeksiyonlarının ülkemizde sürveyans ve kontrol programları içerisine dahil edilebilir özellikte olduğunu işaret etmektedir. Çalışmamızın verilerinin, Türkiye'de BNV seroprevalansı ile ilgili gerçek oranları yansıtması açısından değerli olduğu ve ülkemizde yeni oluşturulmaya başlanılan strateji planlarına katkı sağlayacağı ümit edilmektedir.
TEŞEKKÜR
Virus suşunun ve Vero hücre kültürlerinin teminindeki yardım ve destekleri için Ankara Üniversitesi Veteriner Fakültesi, Viroloji Anabilim Dalı Öğretim Üyesi Sayın Prof. Dr. Aykut Özkul'a teşekkür ederiz.
KAYNAKLAR
- Campbell GL, Marfin AA, Lanciotti RS, Gubler DJ. West Nile virus. Lancet 2002; 2(9): 519-29. [Özet]
- Samuel MA, Diamond MS. Pathogenesis of West Nile virus infection: a balance between virulence, innate and adaptive immunity, and viral evasion. J Virol 2006; 80(19): 9349-60. [Tam Metin] [PDF]
- Kramer LD, Li J, Shi PY. West Nile virus. Lancet Neurol 2007; 6(2): 171-81. [Özet]
- Sampathkumar P. West Nile virus: epidemiology, clinical presentation, diagnosis and prevention. Mayo Clin Proc 2003; 78(9): 1137-44. [Özet] [PDF]
- Dauphin G, Zientara S, Zeller H, Murgue B. West Nile: worldwide current situation in animals and humans. Comp Immunol Microbiol Infect Dis 2004; 27(5): 343-55. [Özet]
- Hayes EB, Gubler DJ. West Nile virus: epidemiology and clinical features of an emerging epidemic in the United States. Annu Rev Med 2006; 57: 181-94. [Özet]
- Solomon T, Ooi MH, Beasley DW, Mallewa M. West Nile encephalitis. BMJ 2003; 326(7394): 865-9. [Tam Metin] [PDF]
- Reiter P. West Nile virus in Europe: understanding the present to gauge the future. Euro Surveill 2010; 15(10): 19508. [Özet] [Tam Metin] [PDF]
- Shi PY, Wong SJ. Serologic diagnosis of West Nile virus infection. Expert Rev Mol Diagn 2003; 3(6): 733-41. [Özet]
- Dauphin G, Zientara S. West Nile virus: recent trends in diagnosis and vaccine development. Vaccine 2007; 25(30): 5563-76. [Özet]
- Meco O. West Nile arbovirus antibodies with hemagglutination inhibition (HI) in residents of southeast Anatolia. Mikrobiyol Bul 1977; 11(1): 3-17. [Özet]
- Serter D. Present status of arbovirus sero-epidemiology in the Aegean region of Turkey, pp: 155-61. In: Vesenjak-Hirjan J, Caliserh C (eds), Arboviruses in the Mediterranean Countries. 1980, Suppl 9. Gustav Fischer Verlag, Stuttgart.
- Ozkul A, Yildirim Y, Pinar D, Akcali A, Yilmaz V, Colak D. Serological evidence of West Nile Virus (WNV) in mammalian species in Turkey. Epidemiol Infect 2006; 134(4): 826-9. [Özet]
- Ergunay K, Ozer N, Us D, et al. Seroprevalence of West Nile virus and tick-borne encephalitis virus in southeastern Turkey: first evidence for tick-borne encephalitis virus infections. Vector Borne Zoonotic Dis 2007; 7(2): 157-61. [Özet] [PDF]
- Hizel K, Yenicesu I, Erdal B, et al. Investigation of West Nile virus seroprevalence in healthy blood donors. Mikrobiyol Bul 2010; 44(3): 425-30. [Özet] [PDF]
- Ergunay K, Saygan MB, Aydogan S, et al. West Nile virus seroprevalence in blood donors from central Anatolia, Turkey. Vector Borne Zoonotic Dis 2010; 10(8): 771-5. [Özet] [Tam Metin] [PDF]
- Ergunay K, Aydogan S, Menemenlioglu D, et al. Investigation of West Nile virus in central nervous system infections of unknown etiology in Ankara, Turkey. Mikrobiyol Bul 2010; 44(2): 255-62. [Özet] [PDF]
- http://www.saglik.gov.tr/TR/belge/1-10898/eski2yeni.html
- Schmidt NJ. Cell culture procedures for diagnostic virology, pp: 51-100. In: Schmidt NJ, Emmons RW (eds), Diagnostic Procedures for Viral, Rickettsial, and Chlamydial Infections. 1989, 6th ed. American Public Health Association, Washington DC.
- Beaty BJ, Calisher CH, Shope RS. Arboviruses, pp: 797-856. In: Schmidt NJ, Emmons RW (eds), Diagnostic Procedures for Viral, Rickettsial, and Chlamydial Infections. 1989, 6th ed. American Public Health Association, Washington DC.
- Buckley A, Dawson A, Moss SR, Hinsley SA, Bellamy PE, Gould EA. Serological evidence of West Nile virus, Usutu virus and Sindbis virus infection of birds in the UK. J Gen Virol 2003; 84 (Pt 10): 2807-17. [Özet] [Tam Metin] [PDF]
- World Health Organization. Guidelines for plaque reduction neutralization testing of human antibodies to dengue viruses. Department of Immunization, Vaccines and Biologicals, WHO. Geneva, Switzerland. 2007. www.who.int/vaccines-documents/
- Huhn GD, Sejvar JJ, Montgomery SP, Dworkin MS. West Nile virus in the United States: an update on an emerging infectious disease. Am Fam Physician 2003; 68(4): 653-60. [Özet] [Tam Metin] [PDF]
- Murgue B, Murri S, Triki H, Deubel V, Zeller HG. West Nile in the Mediterranean basin: 1950-2000. Ann NY Acad Sci 2001; 951: 117-26. [Özet]
- Centers for Disease Control and Prevention. Epidemic/epizootic West Nile virus in the United States: revised guidelines for surveillance, prevention, control, 2003. http://www.cdc.org/ncidod/dubid/westnile/lab_guidance.htm
- Levett PN, Sonnenberg K, Sidaway F, et al. Use of immunoglobulin G avidity assays for differentiation of primary from previous infections with West Nile virus. J Clin Microbiol 2005; 43(12): 5873-5. [Özet] [Tam Metin] [PDF]
- Busch MP, Kleinman SH, Tobler LH, et al. Virus and antibody dynamics in acute West Nile virus infection. J Infect Dis 2008; 198(7): 984-93. [Özet] [Tam Metin] [PDF]
- Centers for Disease Control and Prevention. Information and guidance for clinicians: West Nile virus: clinical description. 2004. http://www.cdc.gov/ncidod/dvbid/westnile/clinicians/clindesc.htm
- Martin DA, Biggerstaff BJ, Allen B, Johnson AJ, Lanciotti RS, Roehrig JT. Use of immunoglobulin M cross-reactions in differential diagnosis of human flaviviral encephalitis infections in the United States. Clin Diagn Lab Immunol 2002; 9(3): 544-9. [Özet] [Tam Metin] [PDF]
- Pfleiderer C, Blümel J, Schmidt M, et al. West Nile virus and blood product safety in Germany. J Med Virol 2008; 80(3): 557-63. [Özet]
- Papa A, Perperidou P, Tzouli A, Castilletti C. West Nile virus neutralizing antibodies in humans in Greece. Vector Borne Zoonotic Dis 2010; 10(7): 655-8. [Özet] [Tam Metin] [PDF]
- Niedrig M, Sonnenberg K, Steinhagen K, Paweska JT. Comparison of ELISA and immunoassays for measurement of IgG and IgM antibody to West Nile virus in human sera against virus neutralisation. J Virol Methods 2007; 139(1): 103-5. [Özet]
- Sağlık Bakanlığı Basın Açıklaması. http://www.saglik.gov.tr/TR/Genel/BelgeGoster.aspx?F6E10F8892433 CFFF88F742D0D711251E9C66FF13E126BBA
- Papa A, Danis K, Baka A, et al. Ongoing outbreak of West Nile virus infections in humans in Greece, July-August 2010. Euro Surveill 2010; 15(34): pii: 19644. [Tam Metin] [PDF]
- Brault AC. Changing patterns of West Nile virus transmission: altered vector competence and host susceptibility. Vet Res 2009; 40(2): 43. [Özet] [Tam Metin] [PDF]
İletişim (Correspondence):
Prof. Dr. Dürdal Us,
Hacettepe Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
06100, Ankara, Türkiye.
Tel (Phone): +90 312 311 4752,
E-posta (E-mail): durdalus@hacettepe.edu.tr